Obliczanie mas cząsteczkowych
Cząsteczki mają niezmiernie małą masę, dlatego – podobnie jak masę atomów – wyraża się ją w atomowych jednostkach masy. Masa cząsteczek zależy od masy atomów, które wchodzą w ich skład. Do określania masy cząsteczkowej niezbędna jest znajomość wzoru związku chemicznego. Na jego podstawie można także ustalić udział każdego pierwiastka w całej masie związku chemicznego.
że do określania masy atomowej stosuje się atomową jednostkę masy, tj. 1 unit = 1,66 · 10Indeks górny -24-24 g;
masy atomowe to masa atomu wyrażone w atomowych jednostkach masy;
masa atomowa pierwiastka chemicznego to wielkość uśredniona, zależna od zawartości procentowej poszczególnych izotopów.
obliczać masę cząsteczkową prostych związków chemicznych;
określać stosunki masowe pierwiastków w związkach chemicznych;
ustalać skład procentowy związku chemicznego.
1. Co to jest masa atomowa pierwiastka?
Masa atomu jest bardzo mała, stanowi tylko niewielką część grama (około 10Indeks górny -24-24 g). Z tego względu wyraża się ją w atomowych jednostkach masy, zwanych unitami. Wartość jednego unitu wynosi 0,00000000000000000000000166 g (1,66 · 10Indeks górny -24-24 g).
Atomy należące do tego samego pierwiastka mogą różnić się masą z uwagi na możliwość występowania odmian tego pierwiastka różniących się liczbą neutronów w jądrze. Dlatego masa atomowa pierwiastka jest średnią ważoną jego mas izotopowych. Przy jej obliczaniu uwzględniamy zawartość procentową izotopów danego pierwiastka. Średnie masy atomowe pierwiastków są podane w układzie okresowym.
Masa atomowa jest niepowtarzalną cechą pierwiastka i nie ma dwóch różnych pierwiastków, które miałyby jednakową jej wartość. Dlatego też znając tylko masę atomową, można zidentyfikować pierwiastek.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D1BibgbAf
Korzystając z układu okresowego, odszukaj pierwiastki o masach atomowych: 32 u, 23 u, 4 u i 40 u, a następnie podaj ich nazwy oraz symbole chemiczne.
2. Jak obliczamy masę cząsteczkową związku chemicznego?
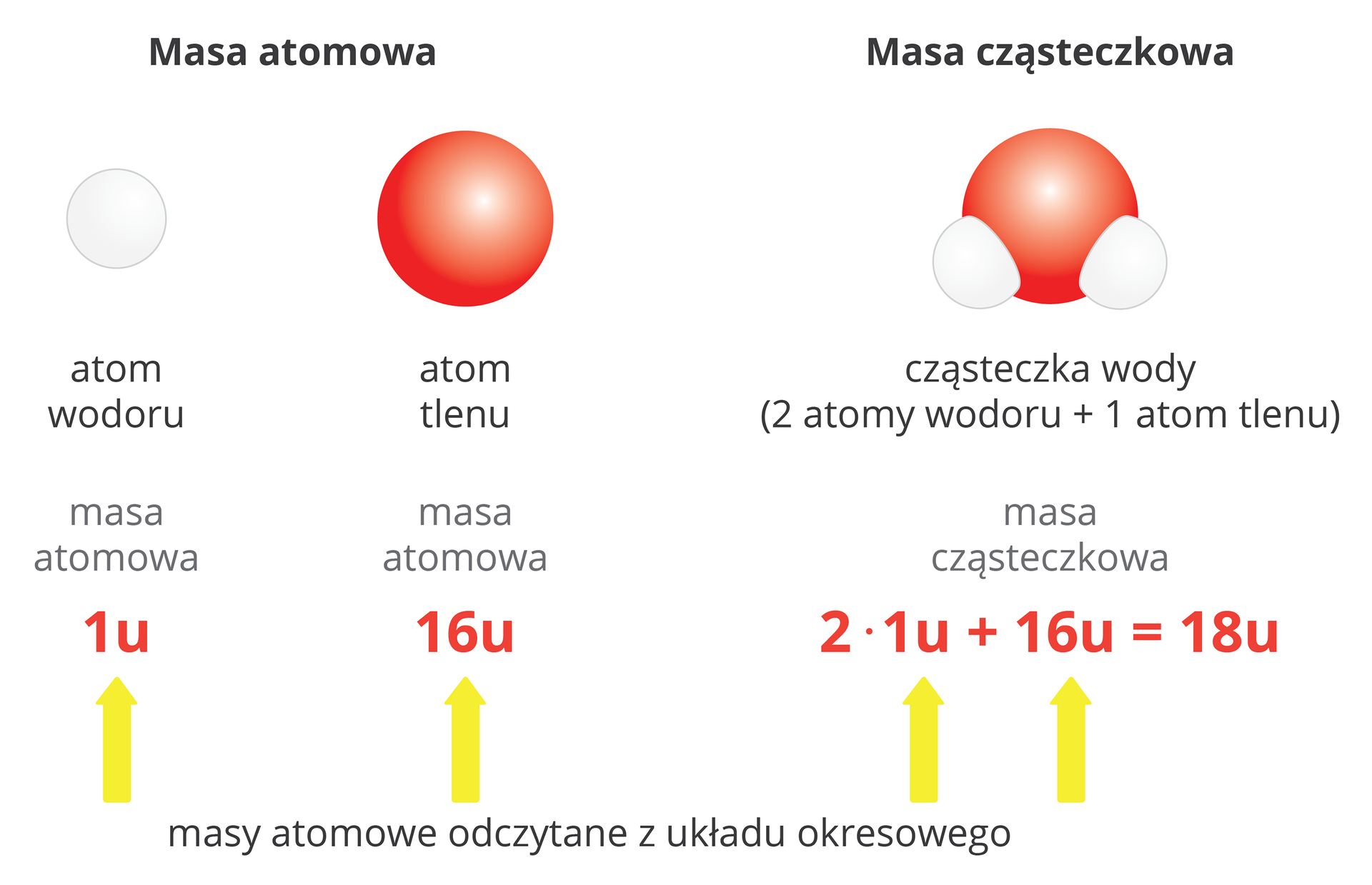
Związki chemiczne są zbudowane z cząsteczek lub tworzą sieci krystaliczne, w których jony występują w określonym stosunku ilościowym. Wzór sumaryczny związku przedstawia budowę cząsteczki lub – gdy jest to związek jest jonowy – odpowiada najprostszemu stosunkowi stechiometrycznemu tworzących związek jonów. Masa tych najmniejszych struktur związków chemicznych, wyrażona w atomowych jednostkach masy, jest nazywana masą cząsteczkowąmasą cząsteczkową związku. Mimo że w nazwie tej występuje wyraz „cząsteczkowa”, to jednak jej zakres nie ogranicza się tylko do związków cząsteczkowych, ale obejmuje także substancje zbudowane z jonów.
Masa cząsteczkowa związku chemicznego jest równa sumie mas atomowych pierwiastków wchodzących w skład najmniejszej struktury związku chemicznego, która jest opisana wzorem chemicznym związku.
Masę atomową poszczególnych pierwiastków można odczytać z układzie okresowym. Jest ona zazwyczaj wyrażona liczbą niecałkowitą, z kilkoma cyframi po przecinku. W typowych obliczeniach chemicznych masy atomowe zaokrągla się do liczb całkowitychIndeks górny **. Jedynymi wyjątkami są masy atomowe chloru i miedzi:
Indeks górny **Dokonując przybliżeń, trzeba kierować się pewnymi zasadami:
1. Jeśli pierwsza cyfra po przecinku jest mniejsza od 5, to odrzucamy wszystkie cyfry znajdujące się za przecinkiem, na przykład:
2. Jeśli cyfra znajdująca się jako pierwsza po przecinku jest większa od 5, to zwiększamy cyfrę odpowiadającą jedności o 1, na przykład:
3. Dla chloru i dla miedzi pierwsza cyfra po przecinku wynosi 5 (ich mas atomowych nie zaokrągla się do liczb całkowitych).
Film dostępny na portalu epodreczniki.pl
Film rozpoczyna się od planszy z treścią zadania: Oblicz masę cząsteczkową chlorowodoru. Pod spodem pojawia się wzór cząsteczki: HCl. Następnie pojawia się informacja, że masa cząsteczkowa HCl jest równa sumie masy atomowej wodoru i masy atomowej chloru. Wyświetlony zostaje układ okresowy pierwiastków, na którym dokonane zostają zbliżenia pól dla wodoru i chloru. Następuje powrót do poprzedniej planszy, podstawienie danych do wzoru i przeprowadzenie obliczeń. Pojawia się wynik końcowy: Masa cząsteczkowa chlorowodoru wynosi 36 i pół unita.

Film dostępny na portalu epodreczniki.pl
Film rozpoczyna się od planszy z treścią zadania: Oblicz masę cząsteczkową kwasu fosforowego pięć. Pod spodem pojawia się wzór cząsteczki: H3PO4. Następnie pojawia się informacja, że masa cząsteczkowa H3PO4 jest równa sumie mas atomowych trzech atomów wodoru, atomu fosforu i czterech atomów tlenu. Wyświetlony zostaje układ okresowy pierwiastków, na którym dokonane zostają zbliżenia pól dla wodoru, fosforu i tlenu. Następuje powrót do poprzedniej planszy, podstawienie danych do wzoru i przeprowadzenie obliczeń. Pojawia się wynik końcowy: Masa cząsteczkowa kwasu fosforowego pięć wynosi 98 unitów.
Wzór sumaryczny | Nazwa związku | Wyrażenie na masę cząsteczkową związku | Wartość |
chlorek sodu | 58,5 | ||
chlorek glinu | 133,5 | ||
metan | 16 | ||
kwas siarkowy(VI) | 98 | ||
sacharoza | 342 | ||
wodorotlenek magnezu | 58 |
3. Kiedy posługujemy się pojęciem masy cząsteczkowej pierwiastka chemicznego?
Niektóre pierwiastki chemiczne, takie jak: wodór, azot, tlen, fluor, chlor, brom czy jod, występują w postaci cząsteczek dwuatomowych. Określając ich masę posługujemy się pojęciem masy cząsteczkowej pierwiastkamasy cząsteczkowej pierwiastka. Masa cząsteczkowa pierwiastka chemicznego jest iloczynem jego masy atomowej i liczby atomów tworzących cząsteczkę.
Na przykład masa cząsteczkowa azotu zbudowanego z cząsteczek dwuatomowych o wzorze , wynosi:
Nazwa pierwiastka | Budowa cząsteczki pierwiastka | Obliczenia masy cząsteczkowej | Masa cząsteczkowa [u] |
azot | 28 | ||
tlen | 32 | ||
fluor | 38 | ||
chlor | 71 | ||
brom | 160 | ||
jod | 254 | ||
fosfor | 124 | ||
siarka | 256 |
4. Jak obliczamy stosunek liczby atomów poszczególnych pierwiastków w związku chemicznym?
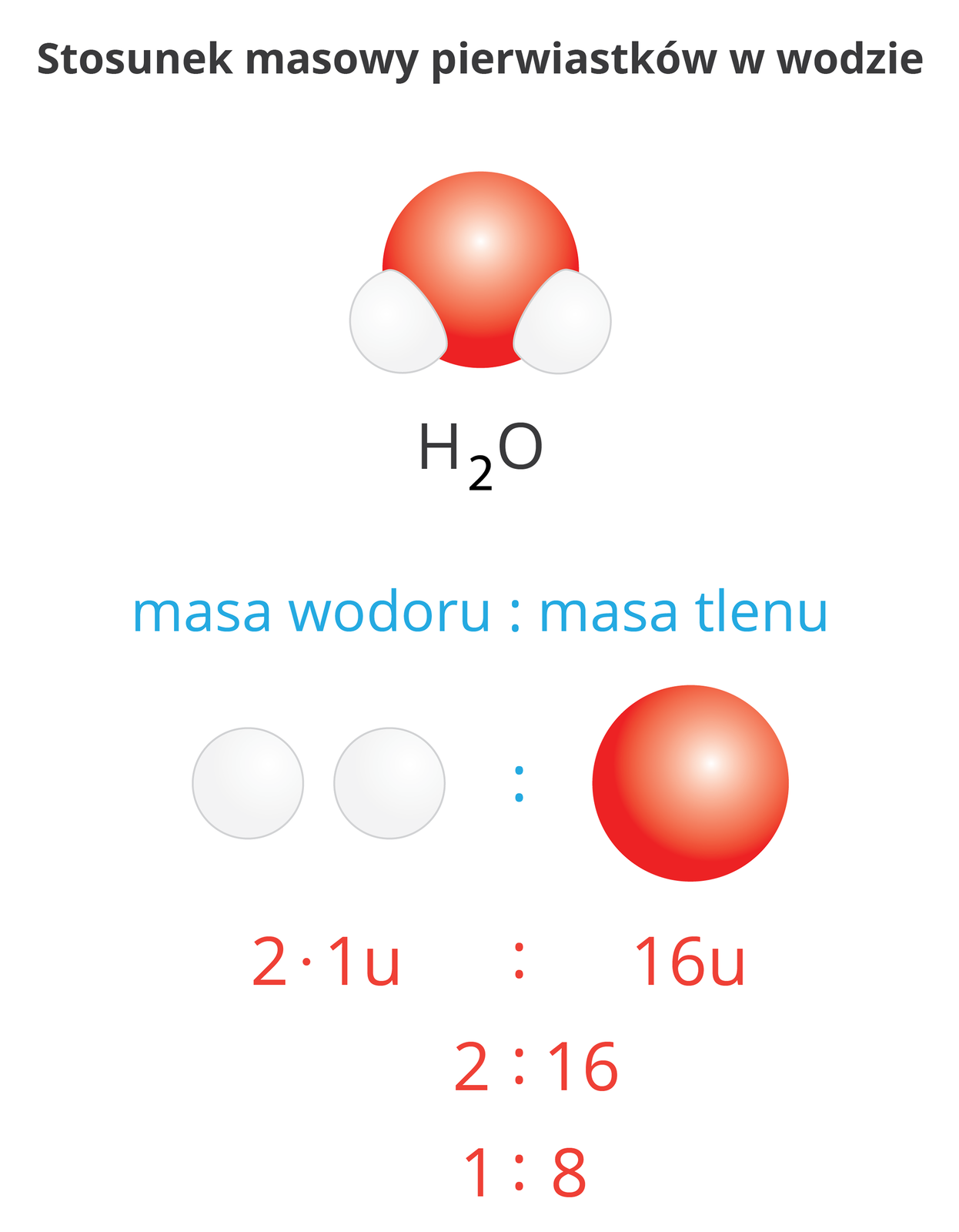
Na podstawie wzoru sumarycznego związku chemicznego można określić wzajemny stosunek liczby atomów (lub jonów) poszczególnych pierwiastków tworzących ten związek. Na przykład w chlorowodorze o wzorze sumarycznym na jeden atom wodoru przypada jeden atom chloru. Stosunek liczby atomów wodoru do liczby atomów chloru równy jest 1 : 1. W przypadku wody, której wzór sumaryczny jest następujący: , stosunek liczby atomów wodoru do liczby atomów tlenu wynosi 2 : 1.

Wzór | Nazwa związku | Rodzaj stosunku liczbowego\* | Stosunek liczby atomów lub jonów tworzących związek |
chlorek sodu | |||
chlorek glinu | |||
kwas siarkowy(VI) | |||
sacharoza | |||
\*Nie jest wielkim błędem, jeśli niezależnie od rodzaju związku (kowalencyjny czy jonowy) w opisie stosunku liczbowego będziemy posługiwać się pojęciem atom. | |||
5. Jak obliczamy stosunek masowy poszczególnych pierwiastków w związku chemicznym?
Wzór sumaryczny związku chemicznego zawiera informacje o tym, jakie pierwiastki wchodzą w jego skład tego związku oraz w jakich stosunkach ilościowych łączą się one ze sobą. Mając taką wiedzę, łatwo obliczyć stosunek masowystosunek masowy poszczególnych pierwiastków. Wielkość ta jest określana jako stosunek mas atomów poszczególnych pierwiastków wchodzących w skład związku chemicznego. W cząsteczce chlorowodoru o wzorze występuje jeden atom wodoru o masie atomowej 1 u i jeden atom chloru o masie atomowej 35,5 u. Stosunek masowy wodoru do chloru w cząsteczce chlorowodoru wynosi zatem 1 : 35,5.
W związku o wzorze ogólnym:
stosunek masowy jest następujący:
Wzór chemiczny związku | Nazwa związku | Wyrażenie na stosunek masowy | Stosunek masowy |
chlorek sodu | |||
chlorek glinu | |||
kwas siarkowy(VI) | |||
sacharoza |
6. Jak obliczamy procentową zawartość pierwiastka w związku chemicznym?
Zawartość procentowąZawartość procentową pierwiastka w związku chemicznym oblicza się według następującego wzoru:
gdzie:
Zawartość procentowa pierwiastka w związku chemicznym to stosunek masy atomów tego pierwiastka (wyrażonej w unitach) w najmniejszej części związku chemicznego do masy cząsteczkowej związku, pomnożony przez 100%. Za najmniejszą część związku chemicznego w przypadku związków kowalencyjnych uważa się cząsteczkę, a w związkach o budowie jonowej – najmniejszy zbiór powtarzających się jonów.
Zawartość procentowa to udział masowy, jaki ma dany pierwiastek w całej masie związku chemicznego. Dlatego czasami wielkość ta jest nazywana procentową zawartością masową. Gdy podane są zawartości procentowe wszystkich pierwiastków tworzących związek, wtedy mówimy o procentowym składzie związku chemicznego.
Wzór sumaryczny chlorowodoru | |
Stosunek liczby atomów wodoru do liczby atomów chloru | |
Masa cząsteczkowa chlorowodoru | 36,5 u |
Procentowa zawartość wodoru | % |
Procentowa zawartość chloru | |
Suma zawartości procentowych wodoru i chloru |
Suma zawartości procentowej wszystkich pierwiastków wchodzących w skład związku chemicznego jest zawsze równa 100%. To oznacza, że nie znając zawartości procentowej jednego pierwiastka wchodzącego w skład związku, można ją łatwo obliczyć na podstawie znajomości tej wartości dla pozostałych składników tego związku.
Jaka jest zawartość tlenu w tlenku magnezu o wzorze jeśli zawartość procentowa magnezu w tym związku wynosi 60%?

Film dostępny na portalu epodreczniki.pl
Nagranie prezentuje sposób obliczania składu procentowego na przykładzie cząsteczki tlenku krzemu o wzorze SiO2. Film zaczyna się od planszy z treścią zadania, pod którą pojawia się informacja: Skład procentowy związku to zawartość procentowa wszystkich pierwiastków tworzących związek chemiczny. Następnie pojawiają się pytania o zawartość procentową krzemu oraz tlenu w związku. Wzór na tę zawartość to masa atomów pierwiastka w najmniejszej strukturze związku chemicznego wyrażona w unitach podzielona przez masę cząsteczkową związku chemicznego, pomnożona przez 100 procent. Następnie następuje obliczenie masy cząsteczkowej SiO2. Po lewej stronie ekranu pojawia się czarny pasek z wyciętymi z układu okresowego pierwiastków kwadratami dla tlenu i krzemu. W równanie masy cząsteczkowej podłożone zostają odpowiednie wartości mas atomowych: 28 u dla krzemu i 16 u dla tlenu. Wynik obliczeń to 28 u plus 2 razy 16 u, czyli 60 unitów. Po podłożeniu wszystkich wartości do wzorów na zawartości procentowe wyniki wynoszą 28 unitów przez 60 unitów razy 100%, czyli 46,7 procent dla krzemu oraz 2 razy 16 unitów przez 60 unitów razy 100%, czyli 53,3 procent dla tlenu. Następuje ostateczne podanie wyników i koniec prezentacji.
Wzór związku chemicznego | Nazwa związku chemicznego | Wyrażenie na procentową zawartość tlenu | Procentowa zawartość tlenu [%] |
tlenek magnezu | 40,0 | ||
tlenek siarki(IV) | 50,0 | ||
tlenek siarki(VI) | 60,0 | ||
kwas siarkowy(IV) | 58,5 | ||
kwas siarkowy(VI) | 65,3 |
Ustal, jaki pierwiastek chemiczny kryje się pod literą , jeżeli wiadomo, że masa cząsteczkowa jego tlenku o wzorze wynosi 108 u.
Podsumowanie
Na podstawie wzoru związku chemicznego można obliczyć jego masę cząsteczkową, stosunek masowy poszczególnych pierwiastków chemicznych wchodzących w jego skład, oraz zawartość procentową tych pierwiastków.
Masa cząsteczkowa związku chemicznego jest równa sumie mas atomów pierwiastków wchodzących w skład cząsteczki (jeśli związek jest kowalencyjny) lub najmniejszego zbioru powtarzających się jonów (jeśli związek ma budowę jonową). Wyraża się ją w atomowych jednostkach masy.
Stosunek mas poszczególnych pierwiastków tworzących związek chemiczny nazywany jest stosunkiem masowym pierwiastków w związku.
Udział masowy pierwiastka w związku chemicznym jest nazywany zawartością procentową. Można ją obliczyć ze stosunku masy atomów pierwiastka w najmniejszej strukturze związku chemicznego do masy cząsteczkowej związku pomnożonego przez 100%. Najmniejszą częścią związku kowalencyjnego są cząsteczki, natomiast związku o budowie jonowej – najmniejszy zbiór powtarzających się jonów.
Uszereguj podane związki chemiczne według rosnących mas cząsteczkowych: , , .
Oblicz, w którym z wymienionych związków procentowa zawartość żelaza jest największa: , , .
Słowniczek
masa cząsteczki pierwiastka chemicznego wyrażona w atomowych jednostkach masy
masa cząsteczki (związek kowalencyjny) bądź najmniejszego zbioru powtarzających się jonów o przeciwnych znakach (związek jonowy) wyrażona w atomowych jednostkach masy
stosunek mas poszczególnych pierwiastków wchodzących w skład związku chemicznego
udział masowy danego pierwiastka w związku chemicznym; stosunek masy atomów pierwiastka w najmniejszej strukturze związku chemicznego do masy cząsteczkowej związku pomnożony przez 100%; za najmniejszą część związku chemicznego uważa się cząsteczkę (w przypadku związków kowalencyjnych) bądź najmniejszy zbiór powtarzających się jonów (w związku o budowie jonowej)
Zadania
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Masa cząsteczkowa pierwiastka lub związku chemicznego jest równa różnicy mas atomowych pierwiastków tworzących daną cząsteczkę. | □ | □ |
| Skład procentowy związku chemicznego to wyrażony w procentach stosunek masy pierwiastka w cząsteczce do masy całej cząsteczki. | □ | □ |
| Zawartość procentowa tlenu w tlenkach wszystkich pierwiastków jest taka sama. | □ | □ |
| Masa cząsteczkowa pierwiastka jest zawsze większa od jego masy atomowej. | □ | □ |
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| W przypadku pierwiastków do opisu ich masy można zamiennie stosować wyrażenia: „masa cząsteczkowa pierwiastka” lub „masa atomowa pierwiastka”. | □ | □ |
| Masę cząsteczkową związku jonowego oblicza się, sumując masy atomowe wszystkich pierwiastków wchodzących w skład najmniejszego zbioru powtarzających się jonów, pomnożone przez ich liczbę w tym zbiorze. | □ | □ |
| Masę atomową pierwiastków wyraża się w gramach. | □ | □ |
| Masę cząsteczkową wyraża się w atomowych jednostkach masy. | □ | □ |
| Skład procentowy związku chemicznego określa zawartość procentową poszczególnych pierwiastków w związku chemicznym. | □ | □ |
Połącz nazwy substancji z wartościami ich masy cząsteczkowej.
tlenek węgla(IV), fluor, tlenek wapnia, gazowy chlor
| 71 u | |
| 44 u | |
| 38 u | |
| 56 u |
Wskaż zapis określający stosunek liczby atomów węgla do liczby atomów tlenu w tlenku węgla(II).
- 1 : 1
- 1 : 2
- 2 : 1
- 12 : 16
- 3 : 4
Wskaż zapis określający stosunek liczby atomów glinu do liczby atomów tlenu w tlenku glinu.
- 2 : 3
- 3 : 2
- 1 : 1
- 27 : 16
- 1 : 2
- 2: 1
Wskaż zapis określający stosunek masowy siarki do tlenu w tlenku siarki(VI).
- 2 : 3
- 1 : 3
- 1 : 1
- 32 : 16
- 4 : 1
Wskaż zapis określający stosunek masowy tlenu do chloru w tlenku chloru(VII).
- 112 : 71
- 2 : 7
- 16 : 35,5
- 7 : 2
- 32 : 71
Wskaż zapis składu procentowego amoniaku – związku o wzorze: .
-
– 82,35%
– 17,65% -
– 25,00%
– 75,00% -
– 14,00%
– 1,00% -
– 93,33%
– 66,67%
Wskaż zapis składu procentowego związku o wzorze: .
-
– 26,53%
– 35,37%
– 38,10% -
– 18,20%
– 18,20%
– 64,60% -
– 36,40%
– 48,60%
– 15,00% -
– 36,45%
– 48,60%
– 14,95%
Masa cząsteczkowa tlenku pewnego metalu o wzorze wynosi 102 u. Wykonaj odpowiednie obliczenia i wskaż pierwiastek, który kryje się pod symbolem .
Masa cząsteczkowa tlenku pewnego dwuwartościowego metalu wynosi 56 u. Wykonaj odpowiednie obliczenia i wskaż wzór tego tlenku.