Przeczytaj
Kryształy kowalencyjne a jonowe
Kryształy kowalencyjne
Kryształy kowalencyjne zbudowane są z atomów niemetali, połączonych ze sobą wiązaniem kowalencyjnym, których różnica elektroujemności jest mniejsza od wg skali Paulingaskali Paulinga. Czasami nawet nazywa się je kryształami makromolekularnymi lub olbrzymimi kryształami molekularnymi. Atomy w krysztale molekularnym tworzą struktury trójwymiarowe. Kryształy te do tworzenia wiązań wykorzystują elektrony, znajdujące się na ostatniej powłoce, tzw. elektrony walencyjne.
Jakie wiązania chemiczne występują w strukturze diamentu?
Diament należy do kryształów kowalencyjnych. Jest zbudowany z atomów węgla, połączonych ze sobą wiązaniem kowalencyjnym. Dodatkowo, każdy z nich jest powiązany z czterema innymi atomami węgla, które tworzą zwartą strukturę.

Film dostępny pod adresem /preview/resource/R1ZCHJKzLx905
Film nawiązujący do treści materiału
Diament jest najtwardszym minerałem, występującym naturalnie na Ziemi. Jego twardość wynosi w skali Mohsaskali Mohsa [mo:za]. Nie przewodzi prądu elektrycznego, ponieważ wszystkie elektrony walencyjne są „uwspólniane” przez wiązania węgiel‑węgiel. Krystalizuje w układzie regularnym.
Kryształy jonowe
Kryształy jonowe są zbudowane z przeciwnie naładowanych jonówjonów, związanych ze sobą poprzez przyciąganie elektrostatyczne. Powstają one w wyniku przemieszczenia się elektronu z pierwiastka o mniejszej elektroujemności, do pierwiastka o większej elektroujemności. Różnica elektroujemności powinna być duża, w skali Paulingaskali Paulinga przyjęto, że musi wynosić więcej niż .
Kryształy jonowe mogą być tworzone przez:
chlorki metali grupy , dzięki którym powstają takie kryształy jonowe, jak chlorek litu, chlorek rubidu, chlorek cezu, chlorek potasu;
sole metali, zawierające resztę kwasów beztlenowych, np. siarczek cynku.
W kryształach jonowych ładunki anionów i kationów się znoszą, a cały kryształ jest obojętny elektrycznie.
Jak obliczyć różnicę elektroujemności?

Oblicz różnicę elektroujemności jonów pierwiastków w chlorku sodu. Strukturę, o jakim charakterze tworzy chlorek sodu?
Jony w strukturze krystalicznej muszą być „upakowane” w odpowiedni sposób, tzn. muszą utworzyć upakowanie, w którym jony o przeciwnych znakach maksymalnie się przyciągają, a jony o takich samych znakach znajdują się jak najdalej od siebie. Przykładem kryształu jonowego jest chlorek sodu .

W strukturze krystalicznej chlorku sodu anionyaniony chloru są umieszczone w narożach i na środku ściany sześcianu, a między nimi mieszczą się mniejsze kationykationy sodu. Każdy z jonów chloru jest otoczony sześcioma jonami sodu i odwrotnie – każdy jonjon sodu jest otoczony sześcioma jonami chloru. Innym przykładem kryształu jonowego jest chlorek cezu, który krystalizuje w układzie regularnym. Komórka elementarna chlorku cezu zbudowana jest z ośmiu kationów cezu, znajdujących się w narożach. W jej środku znajduje się anion chloru.
Struktury homodesmiczne
Jak wcześniej wspomniano, diament jest przykładem kryształu kowalencyjnego – oddziałują w nim jedynie wiązania kowalencyjne. Struktury, w których występuje tylko jedno oddziaływanie między indywiduami chemicznymi, nazywamy strukturami homodesmicznymistrukturami homodesmicznymi. Przykładami takich struktur są:
diament i węglik krzemu – wiązania kowalencyjne;
chlorek sodu i chlorek cezu – oddziaływania jonowe;
cynk i sód – wiązania metaliczne.
Czym są kryształy jonowo‑kowalencyjne? Struktury heterodesmiczne
Wiesz już, z czego są zbudowane kryształy kowalencyjne i kryształy jonowe. Pozostaje tylko zapytać, czym są kryształy jonowo‑kowalencyjne? W kryształach kowalencyjnych występuje jedynie wiązanie kowalencyjne, a w kryształach jonowych jedynie oddziaływanie elektrostatyczne. Kryształy jonowo‑kowalencyjne należą do grupy struktur heterodesmicznychstruktur heterodesmicznych, czyli takich, które powstają w wyniku występowania różnego rodzaju oddziaływań – w tym przypadku mowa jest o oddziaływaniu kowalencyjnym i elektrostatycznym. Przykładami takich związków są sole oraz, wspomniany wcześniej, cyrkon.
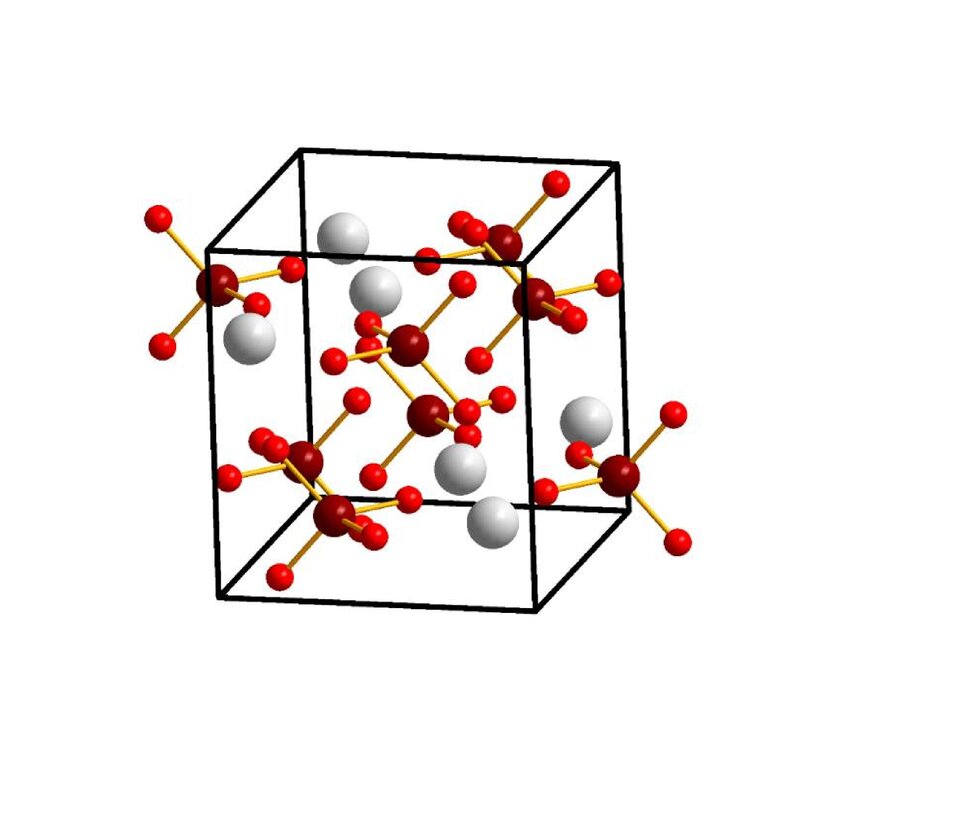
Cyrkon krystalizuje w układzie heksagonalnym. W jego komórce elementarnej znajdują się jony i .
Sole składają się z atomu metalu i reszty kwasowej. KationKation będzie utworzony z atomu metalu, zaś reszta kwasowa pełni rolę anionuanionu (może być to jon pojedynczy np. , bądź jon złożony ). W cyrkonie kation oddziaływuje elektrostatycznie z jonem złożonym . Elektroujemność cyrkonu wynosi , atomu tlenu , zaś różnica ich elektroujemności wynosi: . Kiedy wartość jest większa od , formalnie możemy mówić o oddziaływaniu jonowym między tymi atomami. Kation cyrkonu otoczony jest przez osiem jonów tlenu – oddziaływania między nimi mają charakter jonowy, natomiast atomy tlenu są związane kowalencyjne z atomami krzemu.
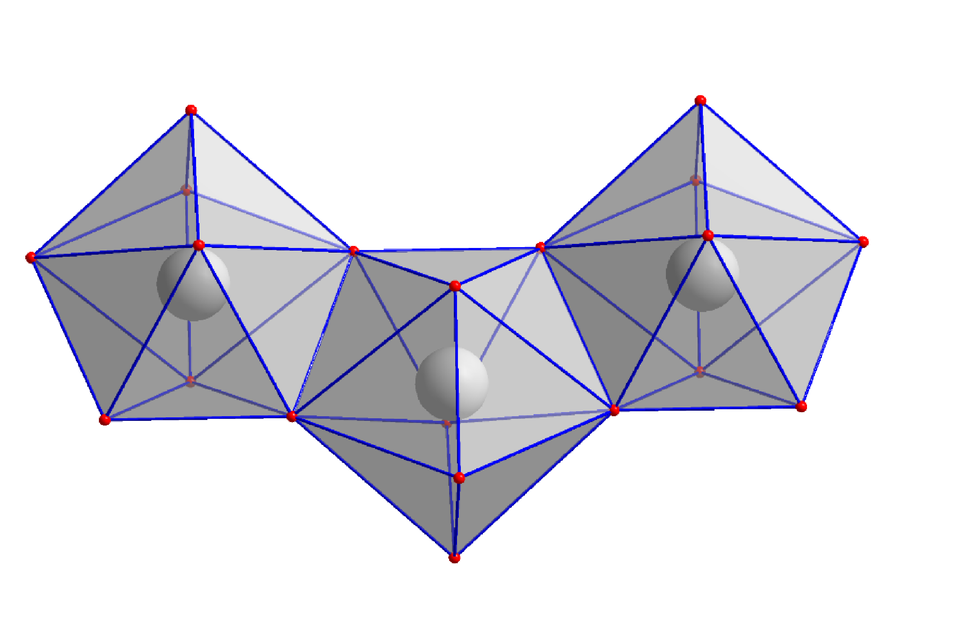
Cyrkon charakteryzuje się mniejszą twardością, wytrzymałością i trwałością termiczną niż diament.
Innym przykładem kryształu jonowo‑kowalencyjnego jest ortofosforan() sodu. Między kationem sodu występuje oddziaływanie elektrostatyczne z anionem tlenu, pochodzącym z reszty kwasowej kwasu ortofosforowego (). Różnica elektroujemności między atomem fosforu a tlenu wynosi . W tym przypadku, między tymi atomami występuje wiązanie kowalencyjne.

Kryształy heterodesmiczneKryształy heterodesmiczne wykazują na ogół niższą temperaturą topnieniatemperaturą topnienia niż struktury o budowie homodesmicznej.
Porównanie struktur jonowych i jonowo‑kowalencyjnych przedstawiono w tabeli poniżej.
Właściwość | Kryształy jonowe | Kryształy jonowo‑kowalencyjne |
|---|---|---|
Indywidua chemiczne występujące w krysztale | Jony – kationy i aniony | Atomy, jony – kationy i aniony |
Różnica w elektroujemności | Powyżej | Powyżej , między jonem metalu a atomem łączącym się z resztą kwasową, oraz poniżej , w jonie złożonym między atomami wchodzącymi w jego skład |
Charakter wiązań | Oddziaływania elektrostatyczne‑jonowe | Oddziaływania elektrostatyczne oraz wiązania kowalencyjne |
Temperatura topnienia | Wysoka | Niższa niż w przypadku kryształów jonowych |
Rozpuszczalność | Rozpuszczają się w rozpuszczalnikach polarnych | Rozpuszczają się w rozpuszczalnikach polarnych |
Twardość | Duża | Gorsza niż w przypadku analogicznych struktur homodesmicznych |
Słownik
powszechnie używana skala, służąca do określania względnej twardości minerałów; wzorcem jest w niej minerałów uporządkowanych wg rosnącej twardości: talk, gips, kalcyt, fluoryt, apatyt, ortoklaz, kwarc, topaz, korund, diament; skalę tę wprowadził w mineralog niemiecki F. Mohs (-)
struktury, w których występuje jedynie jeden rodzaj oddziaływań między indywiduami
struktury, w których występuje więcej niż jeden rodzaj oddziaływań między indywiduami
atom lub grupa atomów obdarzona dodatnim lub ujemnym ładunkiem elektrycznym
umowna skala elektroujemności pierwiastków opracowana przez L.C. Paulinga w r.
temperatura, w której dana substancja stała zmienia stan skupienia na ciekły
(gr. ánodos „w górę”) jon o ujemnym ładunku elektrycznym
(gr. katin „idący w dół”) jon o dodatnim ładunku elektrycznym
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa .
Borchardt‑Ott W., Crystallography an intoduction, Third Edition, London, New York .
Finger L. W., King H. E., A revised method of operation of the single‑crystal diamond cell and refinement of the structure of NaCl at 32 kbar, „American Mineralogist” , , s. -.
Meerssche M. V., Feneau‑Dupont J., Krystalografia i chemia strukturalna. Warszawa .
Robinson K., Gibbs G. V., Ribbe P. H., The structure of zircon: A comparison with garnet, „American Mineralogist” , , s. -.
Wyckoff R. W. G., Crystal Structures, Second Edition, New York , s. -.