Przeczytaj
Korozja
Korozja powstaje w procesach chemicznych, elektrochemicznych, biologicznych i mechanicznych. Największe straty gospodarcze przynosi elektrochemiczna odmiana korozji, która niszczy stopy żelaza. Te, podobnie jak różne gatunki stali i żeliwa, zawierają dodatek grafitu. Kryształy grafitu oraz cementytu () tworzą z żelazem ogniwa galwaniczne. W obecności elektrolitu (woda wraz z rozpuszczonymi solami i gazami, przede wszystkim z tlenem), powodującego zamknięcie obwodu, zaczynają zachodzić niekorzystne procesy korozyjne. W przypadku żelaza i jego stopów, na ich powierzchni w wyniku korozji, czyli niszczenia, powstaje rdza – mieszanina tlenków, wodorotlenków i węglanów żelaza.
Procesy zachodzące na powierzchni korodowanych metali w obecności wody – na przykładzie żelaza:
Wodorotlenki żelaza częściowo przechodzą w tlenki lub węglany żelaza (w reakcji z z powietrza).
Pasywacja
PasywacjaPasywacja, podobnie jak korozja, zachodzi pod wpływem czynników atmosferycznych, choć może także odbywać się pod wpływem stężonych kwasów silnie utleniających. W przeciwieństwie jednak do korozji, proces ten często rozpatrujemy jako korzystny. W wyniku pasywacji na powierzchni metalu tworzy się bowiem pasywna warstwa tlenku danego metalu (lub innych pasywnych chemicznie związków). Stanowi ona zabezpieczenie metalu przed korozją. Pasywacji ulegają metale, takie jak: glin, ołów, miedź czy cynk.
Zabezpieczanie metali przed korozją
W celu zabezpieczenia metalu przed korozją, stosuje się między innymi dodatki stopowe w postaci mniej aktywnych metali w stosunku do metalu, który się chroni. W przypadku żelaza, takim dodatkiem może być molibden. Do innych metod ochrony należy stosowanie inhibitorówinhibitorów korozji, farb, lakierów czy też powłok ochronnych. Te ostatnie mogą być wykonane z innych metali, wówczas możemy podzielić je na katodowe i anodowe.
Ochrona anodowa
Ochrona anodowa jest wykonana z metalu mniej aktywnego niż metal chroniony, ale ochrona ta działa wyłącznie wtedy, gdy powłoka jest szczelna. W przypadku jej uszkodzenia, na powierzchni metalu chronionego tworzy się mikroogniwo, w którym metal chroniony pełni funkcję anody i zachodzi na nim proces utleniania, prowadzący do korozji chronionego metalu.
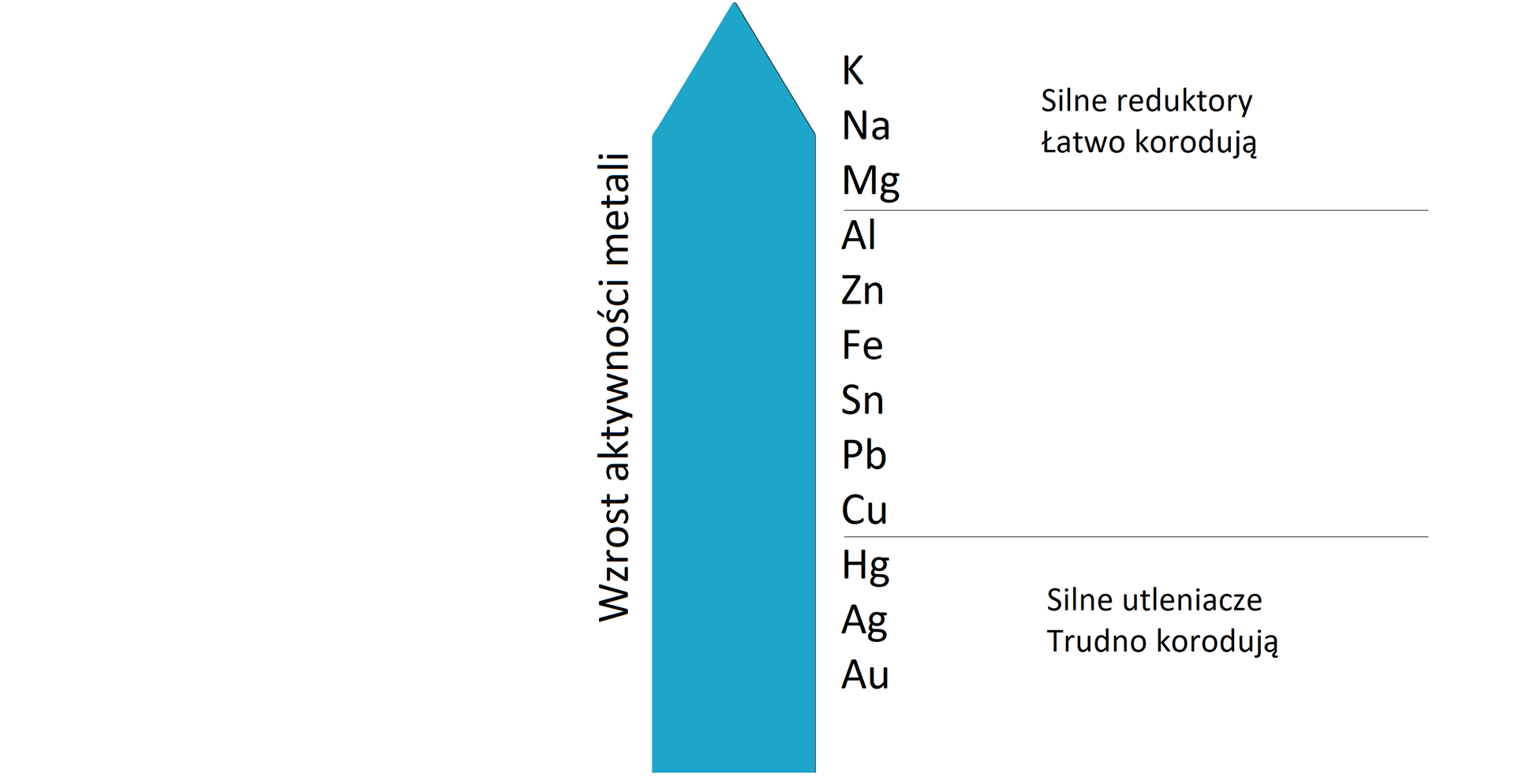
Ochrona katodowa
Ochrona katodowa jest z kolei wykonana z metalu o wyższej aktywności niż metal chroniony. W tym przypadku powłoka pełni funkcję protektora, ulegając korozji (lub czasem pasywacji), zamiast metalu chronionego. W przypadku jej uszkodzenia, metal chroniony i powłoka tworzą ogniwo, w którym katodą jest metal chroniony, co sprawia, że korozji ulega powłoka, a mimo uszkodzenia dalej pełni funkcję protekcyjną.
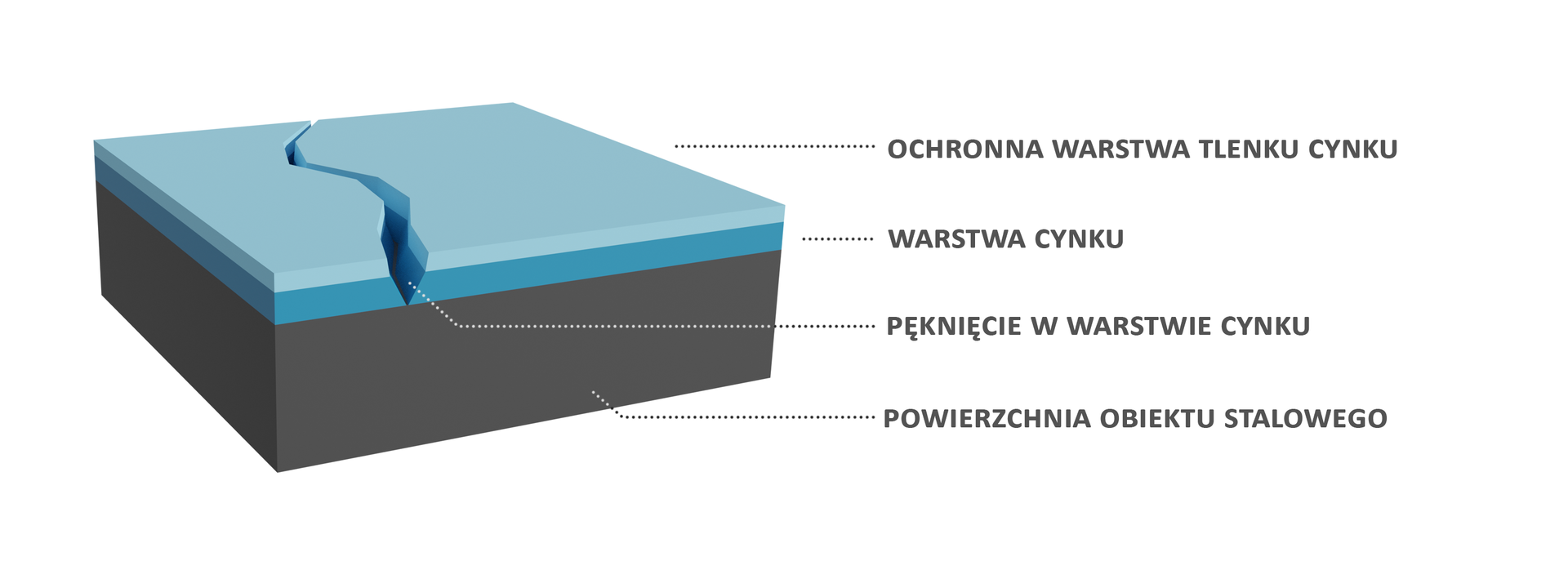
Pokrywanie żelaza cynkiem jest przykładem powłoki katodowej. Cynk, mając niższy potencjał elektrochemiczny niż żelazo, będzie ulegał korozji szybciej. W przypadku, gdy do uszkodzonej powłoki dostanie się wilgoć, w tworzącym się mikroogniwie cynk pełni funkcję anody, a żelazo katody.
Dodatkową zaletą powłoki cynkowej jest to, że pod wpływem składników atmosfery, tlenu, tlenku węgla() lub wody tworzy cienką powierzchniową warstwę nierozpuszczalnego w wodzie węglanu cynku, która stanowi ochronną barierę, skutecznie zapobiega dalszym reakcjom cynku, hamując jego korozję. Czas powstawania węglanu cynku zależy od warunków atmosferycznych i trwa od sześciu miesięcy do dwóch lat. Dlatego też malowanie ocynkowanych konstrukcji zaleca się dopiero po ok. dwóch latach, gdy warstwa barierowa jest prawidłowo utworzona.
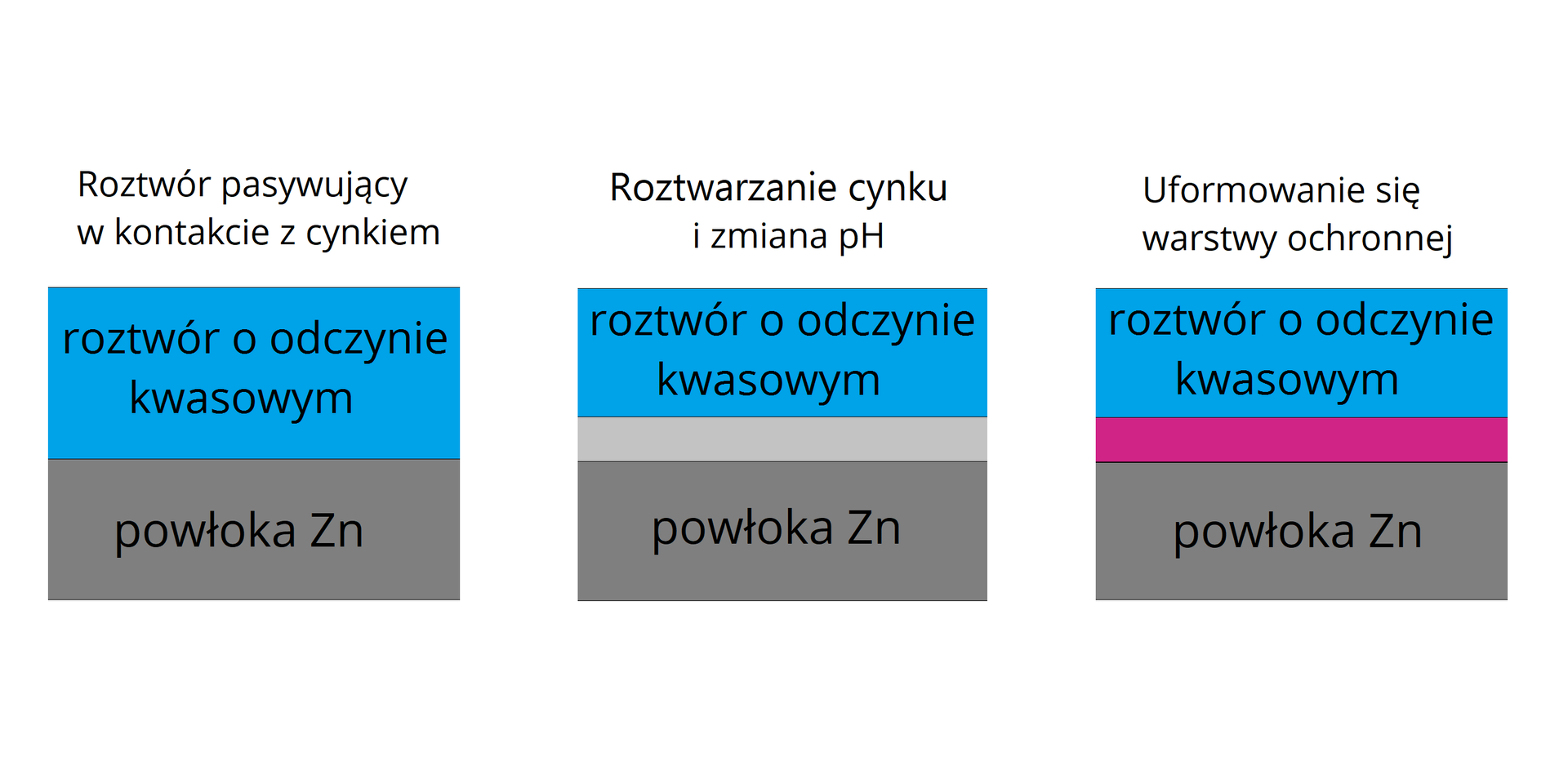
Poniżej zostały przedstawione reakcje chemiczne opisujące powstanie warstwy ochronnej powierzchni cynku.
Na poniższej grafice ukazano, w jaki sposób przebiega pasywacja w przypadku cynku:
Biała korozja (biała rdza)
W niektórych przypadkach na powierzchni powłok cynkowych mogą powstawać białe plamy. Jest to tzw. „biała rdza”, która powstaje, gdy powłoka cynkowa nie zdołała wytworzyć ochronnej warstwy tlenku, a miała kontakt z wilgocią (mgła, para, rosa, śnieg, deszcz). Wówczas w skład białej rdzy wchodzą przede wszystkim tlenek i wodorotlenek cynku. Biała korozja nie pogarsza jakości warstwy ochronnej cynku, wpływa jedynie na jego estetykę. Białej rdzy można pozbyć się poprzez szorowanie miękką szczotką mosiężną lub specjalnymi mieszankami chemicznymi. Pozbycie się jej jest szczególnie istotne w przypadku dalszej obróbki wyrobu, takiej jak np. malowanie.
Patyna
Jednym z metali ulegających pasywacji jest miedź. Dzięki tej właściwości wykonuje się z niej pokrycia dachowe, a z jej stopów, takich jak brąz czy mosiądz, elementy dekoracyjne i pomniki. W przypadku tego metalu pasywny nalot nosi nazwę patyny. Ten zielony osad składa się głównie z węglanu diwodorotlenku dimiedzi() – lub , powstającego pod wpływem wody, tlenku węgla() oraz innych związków zawartych w powietrzu. Proces tworzenia się patyny na powierzchni miedzi jest procesem długotrwałym – trwa nawet kilkadziesiąt lat, choć pierwsze oznaki pojawiają się już po kilku miesiącach.
W zależności od warunków atmosferycznych patyna może składać się z różnych związków chemicznych. Przykładowo, gdy w powietrzu występuje tlenek siarki() (a zatem w miastach oraz w pobliżu przemysłu cementowego, hutniczego czy chemicznego), zawarty jest w niej także siarczan() diwodorotlenek dimiedzi() – , jednak związek ten nie stanowi ochrony przed korozją. W poniższej tabeli zostały przedstawione różne związki wchodzące w skład patyny oraz warunki, w jakich powstają. Warto przy tym zaznaczyć, że mogą pojawiać się one na różnym etapie tworzenia się warstwy:
Składowe patyny | Charakterystyka |
|---|---|
Czerwonobrunatna; tworzona w atmosferze suchego powietrza | |
Czarna; tworzona w atmosferze suchego powietrza, w podwyższonej temperaturze; łatwo się łuszczy | |
Zielona patyna; powietrze atmosferyczne, warunki normalne | |
Szara patyna; tworzona w atmosferze przemysłowej |
Powstawanie patyny
Pierwszą fazą powstawania patyny jest utlenianie, podczas którego tworzy się tlenek miedzi() () o czerwonym lub czerwono‑pomarańczowym zabarwieniu, gdy atomy miedzi reagują z molekułami tlenu z powietrza.
Tlenek miedzi() utlenia się następnie do tlenku miedzi() () o czarnym kolorze. Proces ten zachodzi w podwyższonej temperaturze.
Jeżeli w powietrzu znajdują się pary siarki, to tworzy się siarczek miedzi() ().
Z upływem lat, i powoli reagują z oraz parą wodną zawartą w powietrzu, w wyniku czego powstają: , , które tworzą patynę. Stopień wilgotności powietrza oraz zanieczyszczenia tlenku siarki() mają istotny wpływ na szybkość powstawania patyny, jak również na proporcję tych składników.

Z uwagi na fakt, że patyna jest pożądanym środkiem ochronnym powierzchni miedzianych, chemicy znaleźli szereg rozwiązań, dzięki którym proces patynowania można przyśpieszyć, m. in. z pomocą metod natryskowych oraz elektrolitycznych. Ma to również miejsce przez wzgląd na właściwości estetyczne produktu. W przypadku, gdy tworzenie patyny jest procesem niepożądanym, jej usunięcie przeprowadza się za pomocą wodnego roztworu amoniaku lub ciepłego roztworu kwasu octowego.
Słownik
pokrywanie się niektórych metali (miedź, cynk, glin, ołów) cienką warstwą ich związków (np. tlenków) pod wpływem czynników środowiska (np. tlenu) lub też pod wpływem silnie utleniających kwasów nieorganicznych
związki obniżające szybkość reakcji chemicznych, po wprowadzeniu ich do elektrolitu, w którym zanurzony jest chroniony wyrób metalowy, opóźniają proces utlenienia poprzez absorbowanie się na powierzchni metalu i izolowanie dostępu do niego czynników korodotwórczych; tworzą zwykle na powierzchni metalu warstewki ochronne, które hamują szybkość korozji; dla korozji w środowisku alkalicznym, jako inhibitory korozji stosowane są sole cyny, arsenu, niklu i magnezu, zaś w środowisku kwasowym: krochmal, klej lub białko
produkt korozji atmosferycznej miedzi i jej stopów w wilgotnym powietrzu; jej powierzchniowa warstwa tworzy powłokę koloru od jasnozielonego do szarozielonego; głównym składnikiem (przy powstawaniu w niezanieczyszczonej atmosferze) jest węglan diwodorotlenek dimiedzi() – lub ; jest powłoką trwałą, powstającą jako ostatni etap procesu pasywacji; cały proces pokrywania się powierzchni metalu nalotem patyny trwa kilkadziesiąt lat, choć pierwsze objawy mogą zacząć pojawiać się już po kilku miesiącach
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987.
Bogdańska‑Zarembina A., Matusewicz E. I., Matusewicz J., Chemia dla szkół średnich, Warszawa 1995.
Kaczyński J., Czaplicki A., Chemia ogólna, Warszawa 1974.
Litwin M., Styka‑Wlazło Sz., Szymońska J., Chemia ogólna i nieorganiczna, Warszawa 2002.
Pazdro K. M., Chemia. Podręcznik do kształcenia rozszerzonego w liceach, Warszawa 2009.


