Przeczytaj
Reakcje alkinów terminalnych z metalami alkalicznymi
Aby odpowiedzieć na pytanie dlaczego alkiny mogą reagować z metalami alkalicznymi, należałoby się zastanowić nad charakterem chemicznym tych związków organicznych.
Okazuje się, że alkinyalkiny terminalne, czyli takie, w których cząsteczkach wiązanie potrójne znajduje się przy skrajnym atomie węgla, są słabymi kwasami.
Zgodnie z teorią Brønsteda-Lowry'ego kwas jest donorem protonu, a więc drobiną, która w odpowiedniej reakcji chemicznej może oddać kationu wodoru (). Atom węgla, związany wiązaniem potrójnym, wywiera inny wpływ na pozostałe atomy w cząsteczce niż atom węgla związany wiązaniem podwójnym czy pojedynczym. Taki atom zachowuje się tak, jak gdyby był atomem silnie elektroujemnego pierwiastka, takiego jak tlen czy azot. W cząsteczkach alkinów terminalnych, przy jednym z atomów węgla związanych wiązaniem potrójnym znajduje się atom wodoru. Przez wzgląd na wspomniane “zachowanie się” atomu węgla związanego wiązaniem potrójnym, to właśnie ten atom wodoru może w odpowiednich warunkach zostać odszczepiony od cząsteczki alkinu w formie kationu.
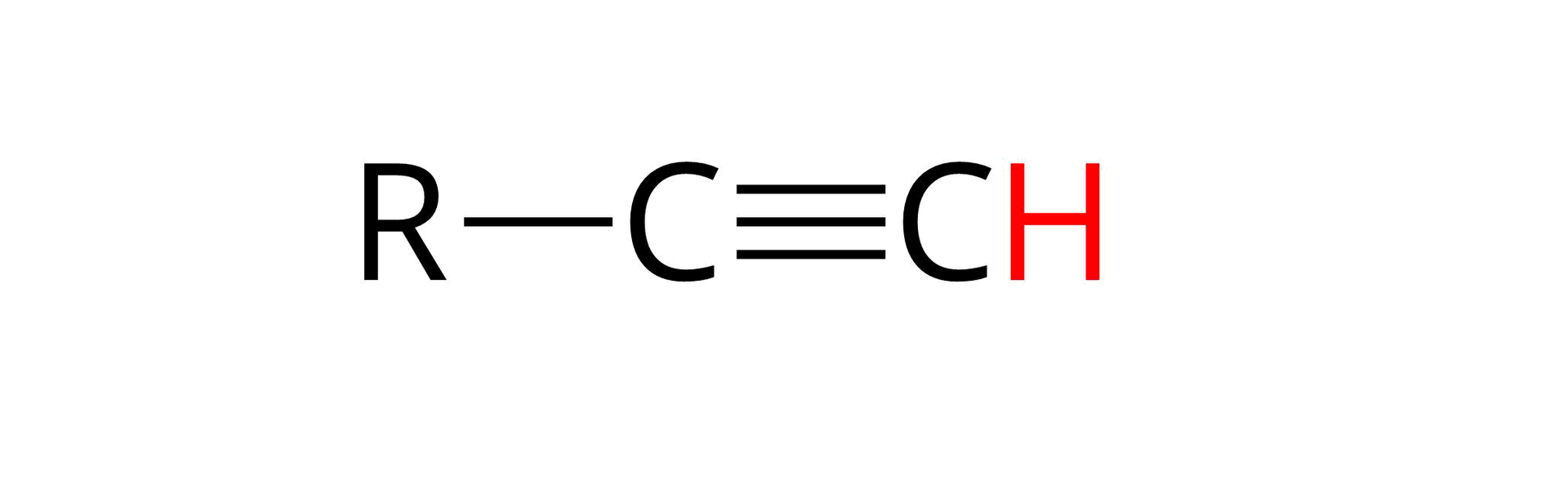
Przykładową reakcją chemiczną pozwalającą na potwierdzenie kwasowego charakteru chemicznego alkinów terminalnych jest reakcja z sodem, w obecności amoniaku. Równanie tej reakcji dla etynu (acetylenu) można w uproszczeniu zapisać jako:
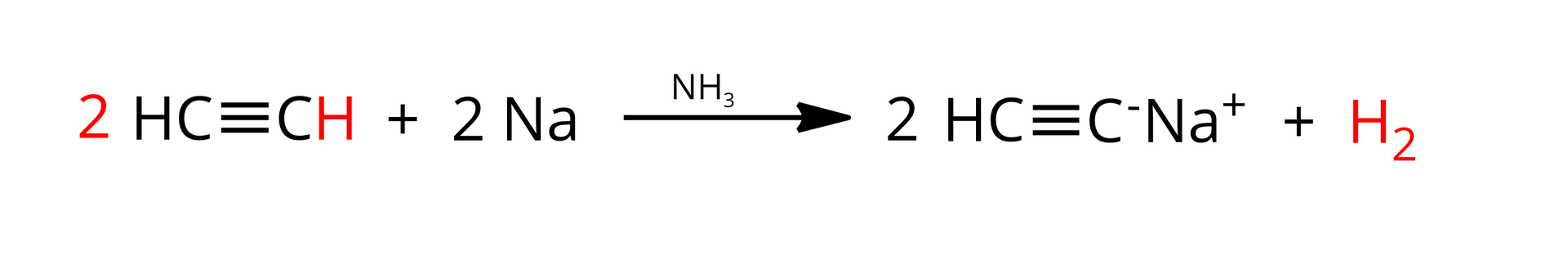
Powstający w wyniku powyższej reakcji związek metaloorganiczny nosi nazwę acetylenku monosodu.
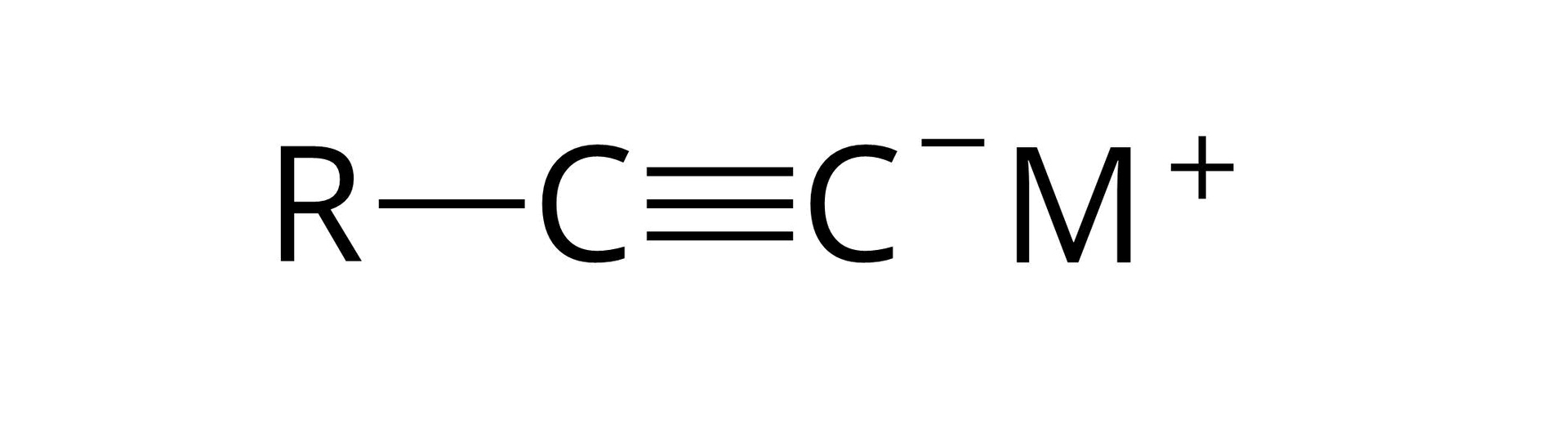
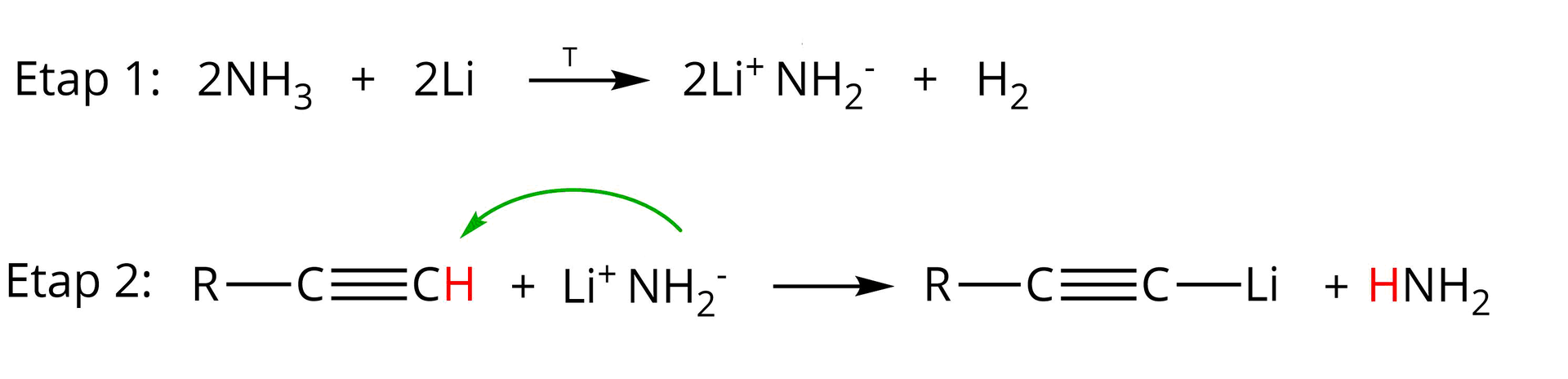
Analizując dokładniej mechanizm wspomnianej reakcji alkinu terminalnego z sodem, należy zwrócić uwagę na fakt, że w rzeczywistości w pierwszym etapie tego procesu sód reaguje z amoniakiem tworząc amidekamidek sodu oraz wodór:

W drugim etapie analizowanej przemiany amidek sodu reaguje z alkinem terminalnym tworząc odpowiedni acetylenek monosodu oraz amoniak:

Poniżej rozpisano dla przykładu mechanizm reakcji etynu (acetylenu) z sodem w obecności amoniaku
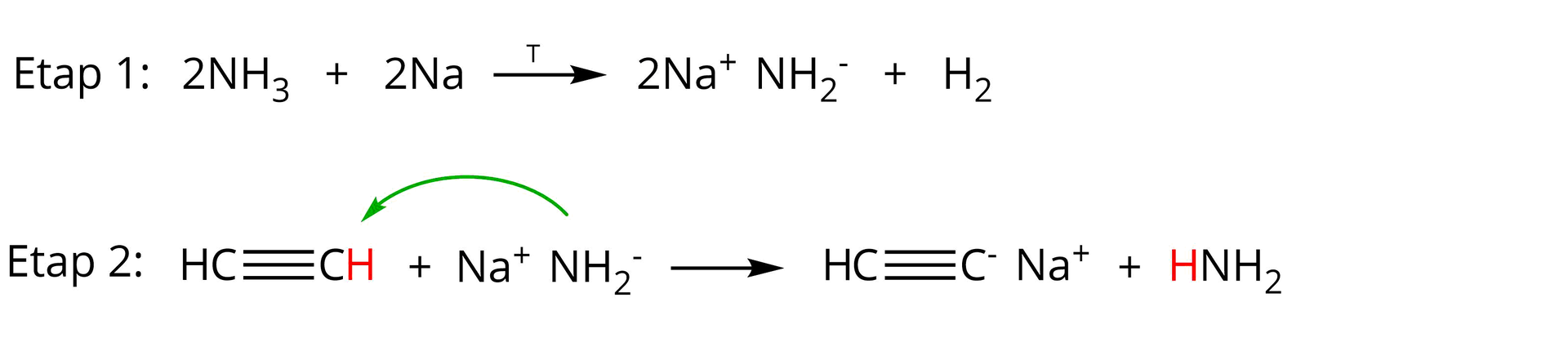
Stała dysocjacji etynu () wynosi w warunkach pokojowych ok. . Dla porównania stała dysocjacji wody (iloczyn jonowy wody) w tych warunkach ma wartość . Porównując obydwie wartości można wnioskować, że woda jest silniejszym kwasem Brønsteda-Lowry'ego niż etyn.
Kwasowość alkinów terminalnych, zawierających więcej niż dwa atomy węgla w cząsteczce, jest porównywalna z kwasowością etynu. W związku z tym, alkiny te również reagują z sodem w analogiczny sposób.
W podobny sposób jak sód, w reakcjach z alkinami terminalnymi, będą zachowywały się pozostałe metale alkaliczne. Wyjątkiem jest jednak lit, który utworzy z alkinem związek chemiczny o budowie kowalencyjnej (atom węgla przy wiązaniu potrójnym, który początkowo związany był z atomem wodoru, utworzy z atomem litu wiązanie kowalencyjne).
Reakcje alkinów wewnętrznych (nieterminalnych) z metalami alkalicznymi
Okazuje się, że nie tylko alkiny terminalne mogą reagować z metalami alkalicznymi. Sód lub lit wykorzystuje się również w reakcjach redukcjiredukcji alkinów. Jest to reakcja selektywna, gdyż redukcja zatrzymuje się na etapie utworzenia alkenu o konfiguracji Ekonfiguracji E. Reakcja ta wymaga użycia ciekłego amoniaku jako rozpuszczalnika, a jej uproszczony schemat można przedstawić w następujący sposób:
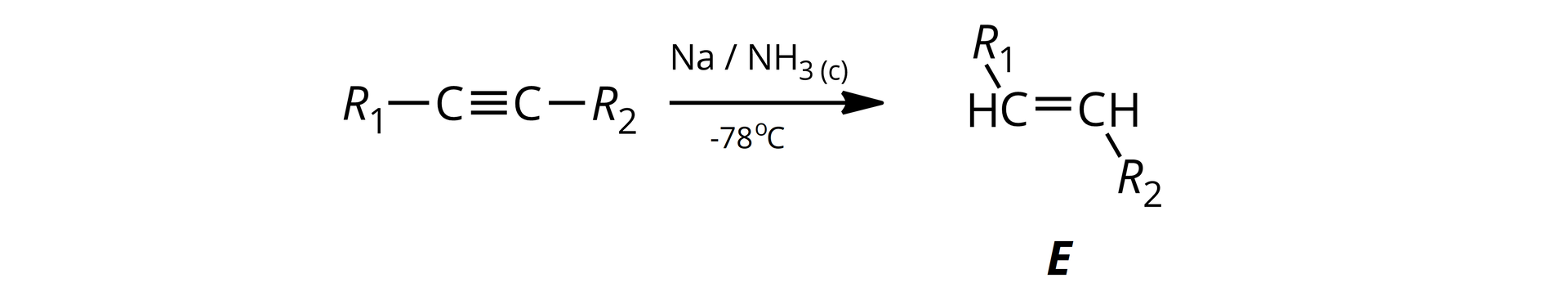
Reakcję tę prowadzi się w niskiej temperaturze (ok. ) w celu utrzymania amoniaku w stanie ciekłym.
Aby przeanalizować mechanizm opisanej przemiany kliknij w poniższy kafelek.
Analizując mechanizm reakcji alkinu wewnętrznego z sodem, w środowisku ciekłego amoniaku, można w uproszczeniu zapisać jej schemat jako:
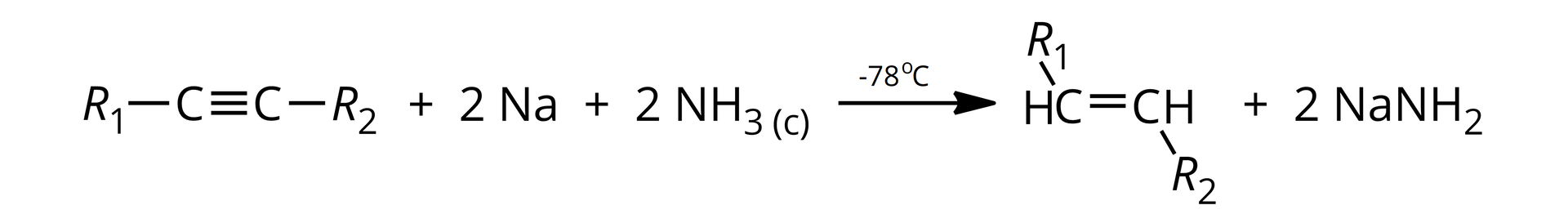
Dla przykładu, traktując but--yn litem, w środowisku ciekłego amoniaku, można otrzymać ()-but--en. Przemianę tę można opisać w uproszczeniu jako:
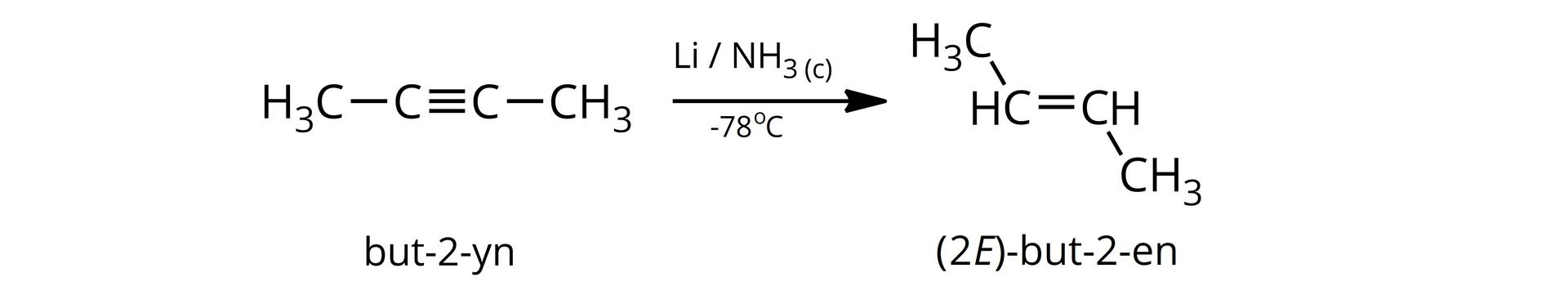
Inny sposób uproszczonego zapisu wspomnianej przemiany to:
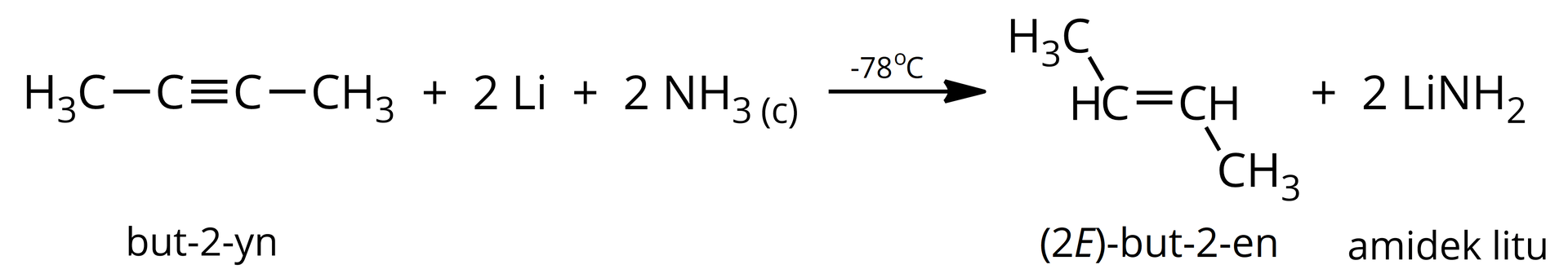
Słownik
alifatyczne węglowodory nienasycone o wzorze ogólnym , których cząsteczki zawierają jedno wiązanie potrójne między atomami węgla
grupa nieorganicznych związków chemicznych o wzorze ogólnym . Związki te mają budowę jonową (kation: , anion: ). Są bardzo silnymi zasadami. Przykładem amidku jest amidek sodu (), który powstaje w wyniku przepuszczania gazowego amoniaku nad metalicznym sodem w temperaturze -
izomeria wynikająca z różnego rozmieszczenia w przestrzeni podstawników przy atomach węgla przy wiązaniach podwójnych lub w układach cyklicznych:
– dwa podstawniki o większej wadze znajdują się po przeciwnych stronach względem płaszczyzny przechodzącej wzdłuż wiązania podwójnego lub pierścienia;
– dwa podstawniki o większej wadze znajdują się po tej samej stronie płaszczyzny wiązania podwójnego lub pierścienia
proces polegający na pobraniu elektronu (elektronów) przez drobinę, w wyniku czego maleje jej stopień utlenienia
Bibliografia
K. Dudek‑Różycki, M. Płotek, T. Wichur, Węglowodory. Repetytorium i zadania. Wydawnictwo Szkolne OMEGA, Kraków, 2020.
K. Dudek‑Różycki, M. Płotek, T. Wichur, Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów. Wydawnictwo Szkolne OMEGA, Kraków, 2020.
J. McMurry, Chemia organiczna, Część 2, Warszawa 2003, s. 275‑276.
R. Morrison, R. Boyd, Chemia organiczna, Warszawa 1990, s. 313‑315.