Przeczytaj
Warto przeczytać
Parametry gazu, ciśnienie, objętość i temperatura, mogą zmienić się na skutek:
Zmiany energii wewnętrznej gazu;
Zmiany ciśnienia zewnętrznego;
Zmiany ilości gazu.
Przyjrzyjmy się bliżej procesom, które mogą wywołać te zmiany.
1. Zmiana energii wewnętrznej gazu.
Energia wewnętrzna gazu doskonałego to całkowita energia kinetyczna wszystkich cząsteczek oraz energia potencjalną ich oddziaływań.
Gaz składa się z ogromnej liczby cząsteczek poruszających się chaotycznie we wszystkie strony, zderzających się ze sobą i zmieniających wskutek zderzeń kierunki i wartości swoich prędkości. Średnia energia kinetyczna przypadająca na jedną cząsteczkę określa temperaturę gazu – mówimy, że temperatura jest miarą średniej energii kinetycznej cząsteczek . Dla gazu doskonałego między tymi wielkościami zachodzi związek
gdzie to stała Boltzmanna, wynosząca . Od temperatury zależna jest energia wewnętrzna gazu doskonałego. Cząsteczki gazu doskonałego - pomijając zderzenia - nie oddziałują ze sobą, ich energia potencjalna jest stała i może być przyrównana do zera. Energia wewnętrzna gazu jest więc równa sumie energii kinetycznych wszystkich cząsteczek. Dla gazu doskonałego jednoatomowego wystarczy uwzględnić tylko ruch postępowy i pomnożyć średnią energię kinetyczną jednej cząsteczki przez liczbę cząsteczek :
Uwaga: w przypadku cząsteczek z wewnętrzną strukturą (np. dwuatomowych, jak duża część pierwiastków występujących w warunkach normalnych w postaci gazowej) istotne jest też uwzględnienie energii kinetycznej wynikającej z możliwości obrotu tych cząsteczek. Wtedy zamiast „3” w liczniku powyższego wzoru pojawia się w najprostszym przypadku cząsteczki liniowej, np. wodoru (HIndeks dolny 22), liczba 5. Jest ona równa liczbie stopni swobody cząsteczek; o tym dość trudnym na pierwszy rzut oka pojęciu przeczytasz w e‑materiale Jaka jest różnica między punktem materialnym a bryłą sztywną?. Od tej chwili zajmujemy się gazami jednoatomowymi, np. szlachetnymi i używamy współczynnika 3/2.
Dla jednego mola gazu liczba cząsteczek to liczba Avogadra . Iloczyn liczby Avogadra i stałej Boltzmanna równy jest z definicji tzw. uniwersalnej stałej gazowej . Dla 1 mola gazu energia wewnętrznaenergia wewnętrzna wynosi wobec tego
A dla moli gazu razy większa:
Ze zmianą energii wewnętrznej jest więc związana zmiana temperatury,
Energię wewnętrzną można zmienić na dwa sposoby:
a) Przez dostarczanie lub odbieranie ciepłaciepła, czyli przekazywanie energii na poziomie mikroskopowym.
b) Przez wykonywanie pracy nad układem przez siły zewnętrzne, czyli przekazywanie energii na poziomie makroskopowym.
Siła zewnętrzna wykonuje pracę zmieniając objętość gazu. Gdy objętość maleje, praca sił zewnętrznych jest dodatnia i powoduje zwiększenie energii wewnętrznej gazu. I na odwrót, podczas zwiększania objętości gazu, praca sił zewnętrznych jest ujemna, energia wewnętrznaenergia wewnętrzna maleje, a wraz z nią temperatura. Możemy też powiedzieć, że siły parcia gazu wykonują w takim przypadku dodatnią pracę kosztem energii wewnętrznej gazu.
Zgodnie z I zasadą termodynamiki całkowita zmiana energii wewnętrznej równa jest sumie pobranego przez układ ciepłaciepła i pracy wykonanej przez siły zewnętrzne:
Parametry opisujące gaz, ciśnienie , objętość i temperatura , powiązane są ze sobą równaniem Clapeyrona , gdzie to liczba moli gazu, - uniwersalna stała gazowa, o której już wspomnieliśmy. Zmiana temperatury i objętości pociąga za sobą zmianę ciśnienia, o ile trzymamy ustalone n.
Możemy teraz rozwiązać zagadkę postawioną we wprowadzeniu. Jak spowodować, aby dostarczaniu ciepłaciepła do gazu towarzyszył spadek temperatury. Wyobraźmy sobie naczynie z ruchomym tłokiem, zawierające 1 mol gazu i ustawione na palniku. Jeśli gaz pobierze ciepłociepło = 800 J, a w tym samym czasie tłok zostanie pociągnięty gwałtownie do góry i nad gazem zostanie wykonana praca = -1200 J, to zmiana energii wewnętrznej wyniesie
Energia wewnętrzna zmalała, a więc zmalała też temperatura. Zmianę temperatury można wyznaczyć ze wzoru
skąd
Gaz pomimo podgrzewania za pomocą palnika ma temperaturę niższą o 32 K lub .
2. Zmiana ciśnienia zewnętrznego.
Gdy pojemnik z gazem, który może zmieniać objętość, znajdzie się w otoczeniu o niższym albo wyższym ciśnieniu niż początkowe ciśnienie gazu, to objętość gazu zmieni się tak, aby ciśnienie wewnątrz i na zewnątrz pojemnika wyrównały się.
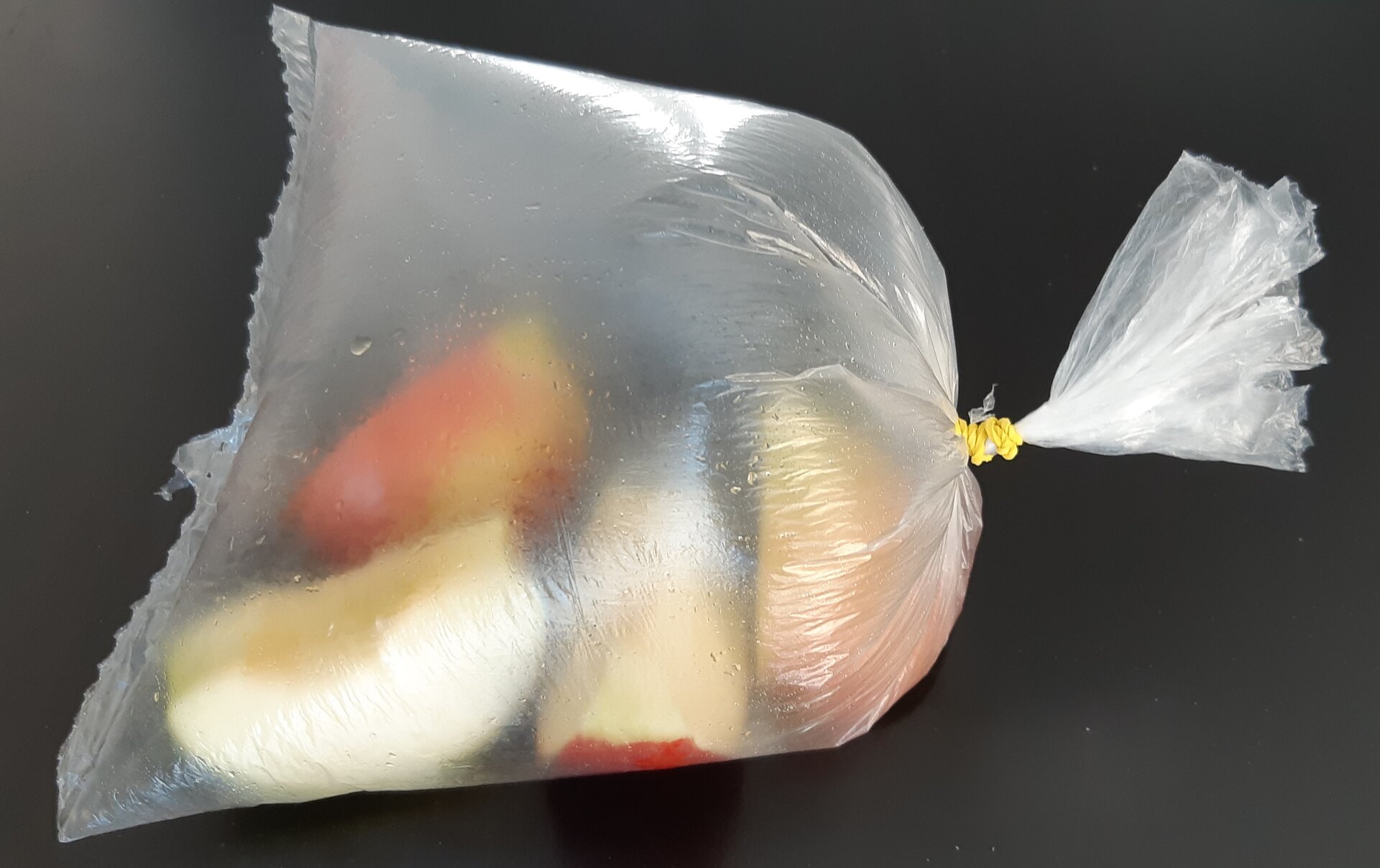
Na przykład, gdy zabierzemy na pokład samolotu owoce zapakowane w foliową torebkę zamkniętą gumką, to podczas lotu ujrzymy, że powietrze w naszej torebce powiększyło objętość i torebka wygląda jak nadmuchany balonik (Rys. 1.). Powodem jest niższe ciśnienie powietrza w samolocie niż przy powierzchni Ziemi. Ciśnienie powietrza w torebce, większe niż na zewnątrz, powoduje rozpychanie ścianek torebki, aż ciśnienia wewnątrz i na zewnątrz wyrównają się.

3. Zmiana ilości gazu.
Przyczyna zmiany parametrów gazu może być też inna niż dostarczenie do układu energii lub zmiana ciśnienia zewnętrznego. Przyjrzyjmy się równaniu Clapeyrona
Widzimy, że oprócz parametrów gazu , i , występuje w równaniu jeszcze jedna wielkość, która może się zmieniać. To – liczba moli gazu. W przemianach izotermicznej, izobarycznej i izochorycznej masa gazu, a więc i liczba moli jest stała. Ale gaz może też podlegać innym przemianom, w których masa gazu się zmienia. Przykładem może być pompowanie balonu lub działanie zaworu, otwierającego się przy określonym ciśnieniu i wypuszczającego z naczynia część gazu. Jeśli znamy trzy z wielkości występujących w równaniu Clapeyrona, , , i , możemy wyznaczyć czwartą wielkość.
Dla przykładu rozwiążemy następujące zadanie:
Pojemnik posiada zawór otwierający się przy ciśnieniu gazu = 1200 kPa. W pojemniku zamknięto gaz o temperaturze i ciśnieniu = 1030 hPa, a następnie podgrzano do temperatury . Oblicz, jaka część masy gazu wyleciała przez zawór z pojemnika.
Do rozwiązania tego zadania zastosujemy równanie stanu gazu
Ciśnienie w stanie końcowym wynosi , bo przy takim ciśnieniu zawór się otwiera i ciśnienie nie może osiągnąć wyższej wartości. Końcowa liczba moli , gdzie to początkowa liczba moli w naczyniu, – część masy gazu, która opuściła pojemnik. Wypiszmy równanie stanu gazu przed podgrzaniem,
i po podgrzaniu układu
Po podzieleniu stronami tych równań otrzymujemy
czyli
skąd
Po wstawieniu wartości liczbowych otrzymamy
Odpowiedź: Pojemnik opuściło 14% masy gazu.
Słowniczek
miara średniej energii kinetycznej przypadająca na jedną cząsteczkę.
suma energii kinetycznych i potencjalnych oddziaływań między cząsteczkami oraz wewnątrzcząsteczkowych.
forma spontanicznego przekazywania energii od ciała o wyższej temperaturze do ciała o niższej temperaturze.
jednostka ciśnienia, 1 Pa to ciśnienie wywierane przez siłę 1 N na powierzchnię .