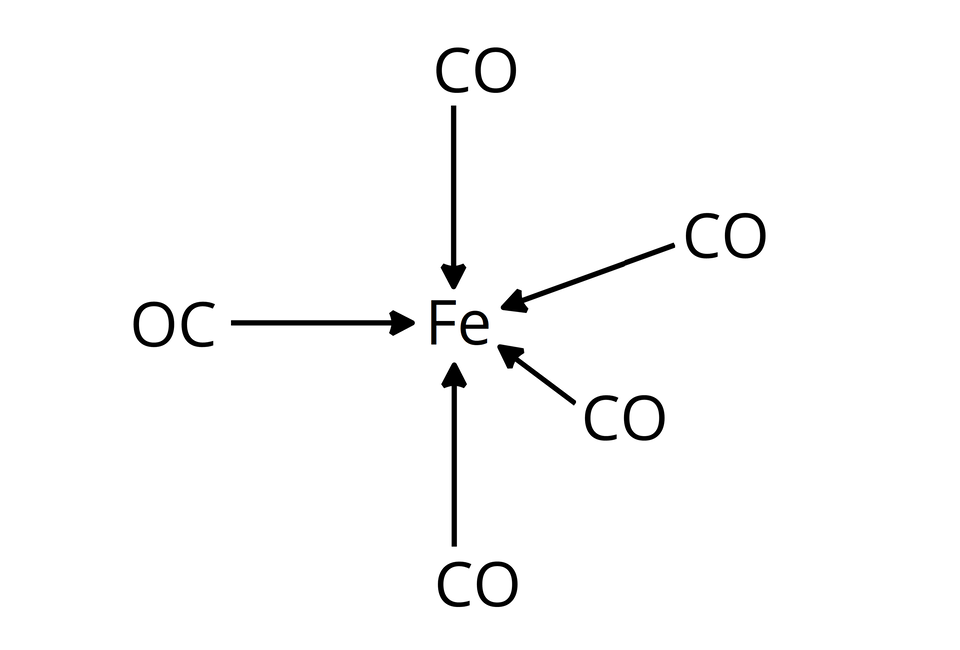
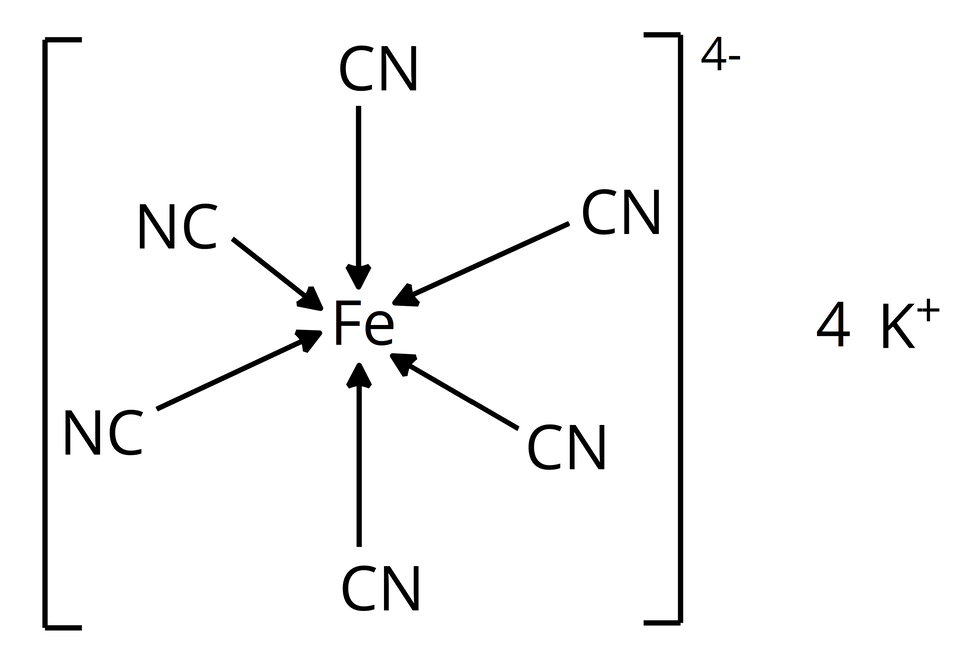
Przeczytaj
Budowa związku koordynacyjnego
Związek koordynacyjny może być związkiem jonowym, w którym jeden z jonów jest jonem kompleksowym (np. wspomniany już błękit pruski ), ale może być też związkiem, w którym nie występują wiązania jonowe np. . Każdy jon lub związek koordynacyjny posiada jon lub atom centralny oraz połączone z nim ligandy. LigandyLigandy (donory pary elektronowej) łączą się z jonem lub atomem centralnym (akceptor pary elektronowej) za pomocą wiązań koordynacyjnychwiązań koordynacyjnych. Liczba ligandów, bezpośrednio połączonych z atomem centralnym, to liczba koordynacyjna. Najczęściej liczby koordynacyjne przyjmują wartości od 2 do 6. Liczba koordynacyjna nie jest cechą charakterystyczną danego jonu centralnego, lecz zależy m.in. od rodzaju ligandów. Decyduje o określonej strukturze przestrzennej związku koordynacyjnego.
Związek koordynacyjny składa się z:

jonu centralnegojonu centralnego, np. , , , , , , , , ;
ligandówligandów, którymi mogą być obojętne cząsteczki, np. (akwa), (amina), (karbonyl), (nitrozyl), lub jony, np. (hydrokso), (chloro), (fluoro), (tiocyjaniano), (cyjano).
Najbardziej typowe liczby koordynacyjne wybranych jonów

Przykładowa klasyfikacja związków koordynacyjnych

Zasady nazewnictwa w oparciu o tzw. system Stocka
W nazwie obowiązuje kolejność alfabetyczna wszystkich ligandów, należy też uwzględnić liczbę ligandów (wtedy stosujemy przedrostki di–, tri–,tetra–, penta–, heksa– itd.), niezależnie od ich rodzaju. Następnie wymienia się jon centralny w odpowiednim przypadku (zależnym od tego, czy jon kompleksowy jest kationem, czy anionem). Gdy ładunek jonu koordynacyjnego wynosi zero, nazwę jonu centralnego podaje się w mianowniku.
Dla przykładu:
chlorek heksaakwaglinu;
heksatiocyjanianożelazian() potasu;
wodorotlenek diaminasrebra();
pentacyjanonitrozylżelazian() sodu.
Jeśli związek koordynacyjny jest solą o budowie jonowej, to niezmienne pozostaje, że najpier wymieniamy nazwę anionu a później kationu, niezależnie który z nich ma budowę koordynacyjną, np. heksacyjanokobaltan() heksaaminachromu() .
Jak zaprojektować doświadczenia, które prowadzą do otrzymania związku koordynacyjnego?
Przeprowadzając doświadczenia opisane poniższymi rysunkami, można otrzymać związek koordynacyjny o charakterystycznej barwie.
Doświadczenie: otrzymywanie heksatiocyjanianożelazianu() potasu.

Obserwacje:
Pojawia się krwistoczerwone zabarwienie roztworu.
Wnioski:
Zachodzi reakcja wg poniższego równania reakcji:
W wyniku reakcji chlorku żelaza() z tiocyjanianem potasu powstaje związek o czerwonym zabarwieniu – heksatiocyjanianożelazian() potasu oraz chlorek potasu.
Doświadczenie: otrzymywanie wodorotlenku tetraaminamiedzi().

Obserwacje:
Osad się roztwarza, a roztwór zabarwia na szafirowo.
Wnioski:
Zachodzi reakcja wg poniższego równania reakcji:
W wyniku reakcji amoniaku z wodorotlenkiem miedzi() powstaje związek o szafirowym zabarwieniu - wodorotlenek tetraaminamiedzi().
Słownik
atom bądź jon, który stanowi rdzeń kompleksu i przyłącza (koordynuje) pewną liczbę ligandów, które mogą stanowić cząsteczki lub jony ujemne
dawniej addend; jon lub cząsteczka związane koordynacyjnie z atomem centralnym w związkach koordynacyjnych
wiązanie donorowo‑akceptorowe; wiązanie chem., które tworzy para elektronów, pochodząca od jednego atomu (donora), wiążącego się z drugim atomem (akceptorem) o niezapełnionej powłoce elektronowej
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. , Warszawa .
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała .
Trzebiatowski W., Chemia nieorganiczna, wyd. , PWN, Warszawa