Przeczytaj
Podział wodorotlenków
Wodorotlenki ze względu na charakter chemiczny dzielimy na:
zasadowe;
amfoteryczne.
Wodorotlenki zasadowe
Wodorotlenki zasadowe to wodorotlenki, które reagują z kwasami, ale nie reagują z zasadami. Zaliczamy do nich głównie wodorotlenki metali i grupy układu okresowego (z wyjątkiem berylu) oraz wodorotlenek chromu() i manganu().
Zapoznaj się z poniższym doświadczeniem, a następnie zapisz obserwacje.
Doświadczenie
Wykazywanie charakteru chemicznego wodorotlenku magnezu.
Schemat doświadczenia:

Reakcje chemiczne:
Probówka
Zapis cząsteczkowy:
Zapis jonowy:
Zapis jonowy skrócony:
Wodorotlenki amfoteryczne
Wodorotlenki amfoteryczne to wodorotlenki, które reagują zarówno z mocnymi kwasami, jak i z mocnymi zasadami.
Wodorotlenki amfoteryczne nie rozpuszczają się w wodzie.
Do wodorotlenków amfoterycznych zaliczamy m.in.: , , , , , , , , , , .
Należy podkreślić, że w przypadku niektórych z wodorotlenków, których wzory podano, reakcja z zasadą wymaga zastosowania często drastycznych warunków.
Zapoznaj się z poniższym doświadczeniem, a następnie zapisz wnioski.
Doświadczenie
Wykazywanie charakteru chemicznego wodorotlenku glinu.
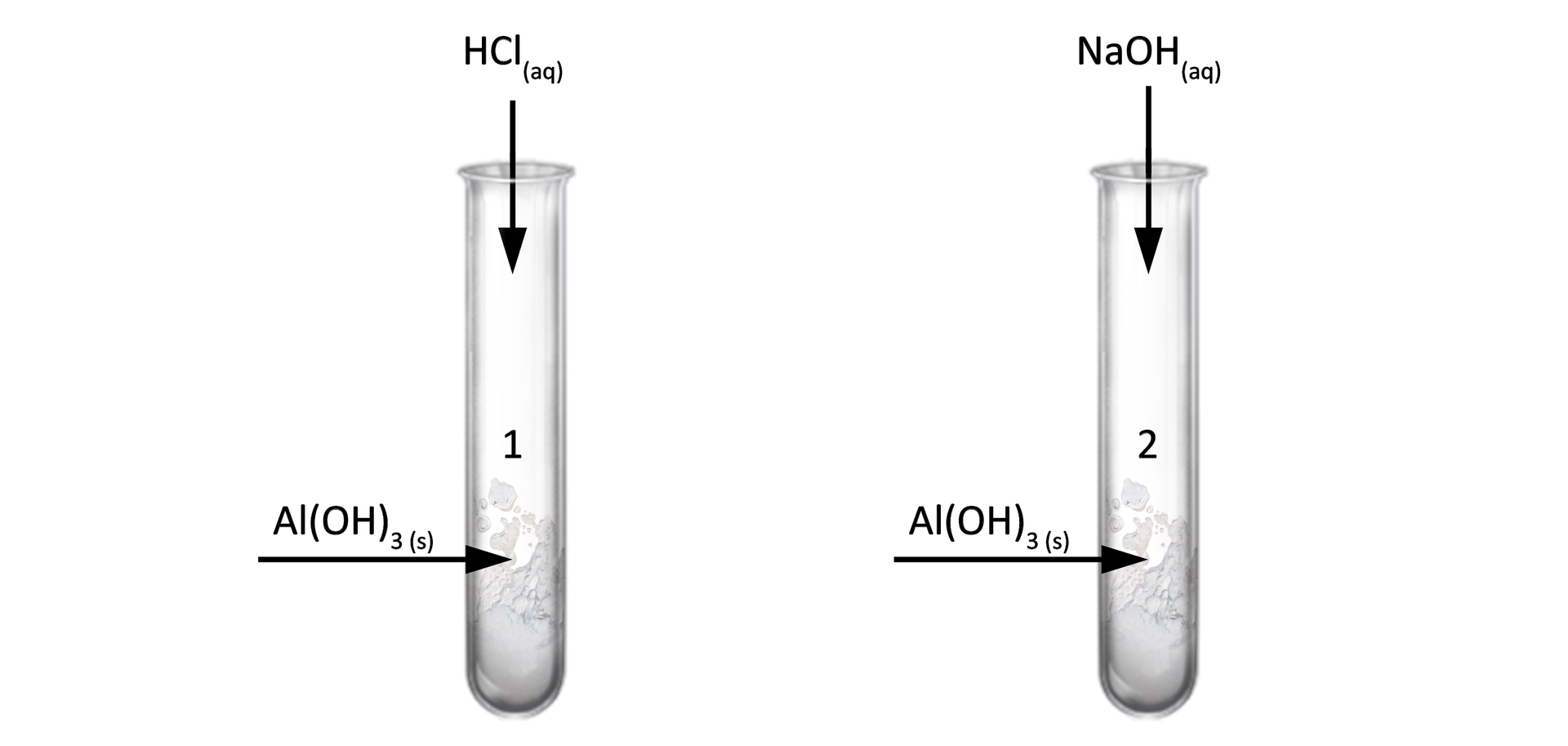
Równania reakcji:
Probówka
Zapis cząsteczkowy:
Zapis jonowy:
Zapis jonowy skrócony:
Probówka
Zapis cząsteczkowy:
Lub przy dużym nadmiarze wodorotlenku sodu:
Zapis jonowy:
Lub przy dużym nadmiarze wodorotlenku sodu:
Zapis jonowy skrócony:
Lub przy dużym nadmiarze wodorotlenku sodu:
Jaki związek kompleksowy powstanie?
Wodorotlenki amfoteryczne typu zazwyczaj tworzą związki kompleksowezwiązki kompleksowe o liczbie koordynacyjnejliczbie koordynacyjnej wynoszącej :
Wodorotlenki amfoteryczne typu zazwyczaj tworzą związki kompleksowezwiązki kompleksowe o liczbie koordynacyjnejliczbie koordynacyjnej wynoszącej lub (przy nadmiarze jonów wodorotlenkowych):
Słownik
inaczej zwany związkiem koordynacyjnym; jest to związek chemiczny, który zawiera w swojej budowie co najmniej jeden atom centralny, otoczony innymi atomami lub grupami atomów (ligandami); atom centralny powinien tworzyć przynajmniej jedno wiązanie o charakterze koordynacyjnym z jednym z ligandów
liczba najbliższych atomów lub jonów otaczających dany atom lub jon w sieci przestrzennej kryształu albo liczba ligandów związana z atomem centralnym w związkach koordynacyjnych
Bibliografia
Bielański A., Podstawy chemii nieorganicznej 2, Warszawa 2013.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1, Warszawa 2015.
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków 2020.
Pac B., Zegar A., Reakcje w roztworach wodnych w teorii i zadaniach, Kraków 2020.