Przeczytaj
Wodne roztwory jonów dichromianowych
Roztwory wodne, które zawierają jony chromianowe , mają barwę żółtą. Po zakwaszeniu powstają z kolei jony dichromianowedichromianowe o barwie pomarańczowej. Są one stosowane w laboratorium jako odczynniki utleniające.
Reakcja redukcjiReakcja redukcji chromu przebiega zgodnie z równaniem:
Zastosowanie roztworów jonów dichromianowych w alkomatach
Zmiana barwy jest bardzo charakterystyczna i łatwa do zaobserwowania. Dlatego znalazła zastosowanie do wykrywania obecności etanolu w wydychanym powietrzu w testerach trzeźwości czyli alkomatachalkomatach.
Dichromian amonu utlenia alkoholalkohol do aldehydu, a sam redukuje się do związków chromu, czemu towarzyszy zmiana barwy z pomarańczowej na zieloną.
Jak zmieniają się stopnie utlenienia węgla w tej reakcji?
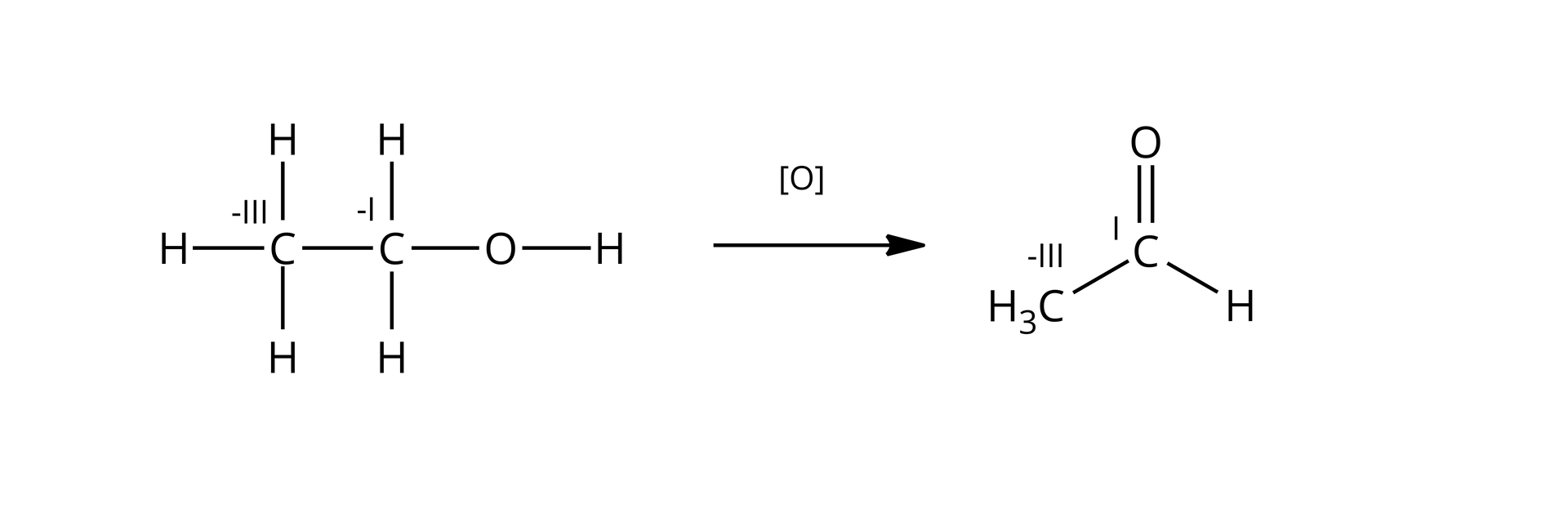
W cząsteczce etanolu utlenianiu ulega tylko atom węgla połączony z grupą hydroksylową. Stopień utlenienia zmienia się z na w grupie aldehydowej. Grupa pozostaje niezmieniona.
Czy potrafisz uzgodnić równanie poniższej reakcji i przeprowadzić bilans elektronowy?
Jak oblicza się stopnie utlenienia w związkach organicznych?
Stopień utlenienia węgla w związku organicznym zależy od tego, z jakimi atomami jest on połączony. Oblicza się go podobnie jak w przypadku atomów innych pierwiastków w związkach nieorganicznych.
Wiązanie | Wkład do stopnia utlenienia atomu |
|---|---|
Na przykład w etanolu:
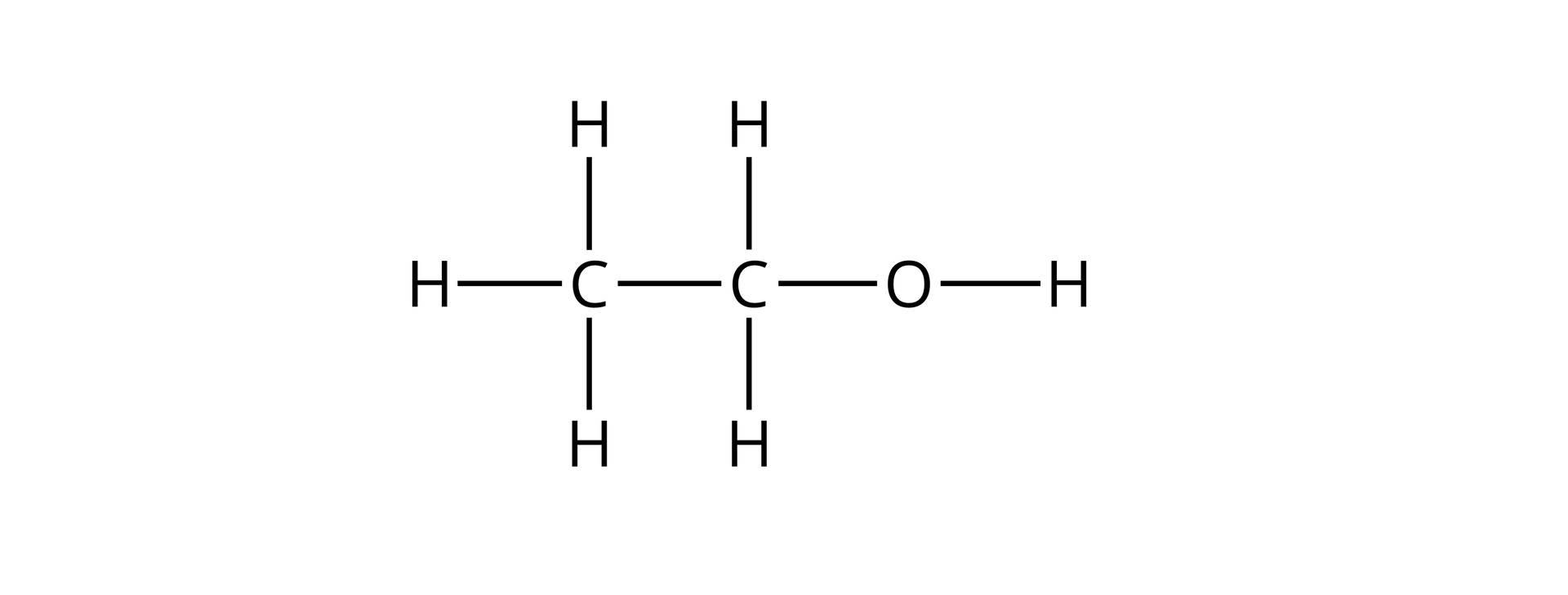
Węgiel połączony z grupą hydroksylową tworzy:
wiązanie z atomem węgla;
wiązania z atomami wodoru;
wiązanie z atomem tlenu.
Jego stopień utlenienia obliczymy następująco:
Węgiel z grupy metylowej tworzy:
wiązanie z atomem węgla;
wiązania z atomami wodoru.
Jego stopień utlenienia obliczymy następująco:
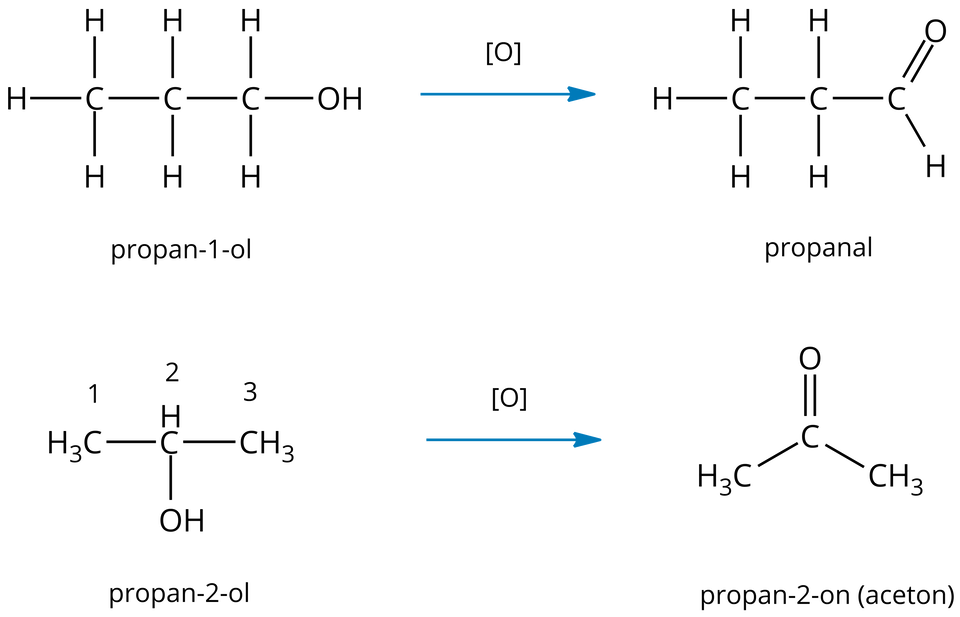
Produkt reakcji utleniania alkoholi zależy od jego rzędowościrzędowości. Alkohole -rzędowe można utlenić do aldehydów, a -rzędowe do ketonów.
Słownik
sole kwasu dichromowego, zawierają anion
polega na wymianie elektronów od atomu, jonu lub cząsteczki donora (czyli reduktora) do akceptora (czyli utleniacza); przejawia się tym, że pierwiastki występują na innych stopniach utlenienia w produktach niż w substratach i w ten sposób łatwo odróżniać reakcje redoks od innych
pochodne węglowodorów, które w cząsteczkach mają co najmniej jedną grupę hydroksylową, połączoną grupą alkilową
alkohole, w których grupa znajduje się na końcu łańcucha węglowego, nazywamy pierwszorzędowymi (-rzędowymi), a alkohole, w których grupa występuje przy „wewnętrznych” atomach węgla mogą być - i -rzędowe
urządzenie do mierzenia stężenia alkoholu etylowego w wydychanym powietrzu
Bibliografia
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002, s. 297‑327.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 2, Warszawa 2003, s. 1138‑167.
Piosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Gdańsk 2004, s. 118‑119.