Przeczytaj
Przygotowanie roztworu o określonym stężeniu
Na początek przypomnijmy sobie, w jaki sposób przygotować roztwór o określonym stężeniu, w którym rozpuszczona jest dana ilość substancji. Wykonaj poniższe ćwiczenie.
Oblicz, jaką masę chlorku sodu należy rozpuścić w wody w temperaturze , aby otrzymać nasycony roztwór tej soli.
Sprzęt potrzebny do przygotowania roztworu o określonym stężeniu
W laboratorium do przygotowania roztworu o określonym stężeniu (który zawiera konkretną masę substancji rozpuszczonej w określonej ilości rozpuszczalnika) posługujemy się naczyniami miarowymi oraz wagą analityczną.
Przygotowanie roztworu nasycony i przesyconego
W podobny sposób możemy otrzymać roztwór nasycony.
Napisz, skąd wiadomo, jaką ilość substancji należy rozpuścić, aby otrzymać roztwór nasycony?
Jak otrzymać roztwór przesyconyroztwór przesycony etanianu sodu (octanu sodu) ?
Cel: Przygotowanie roztworu nasyconego, roztworu przesyconego oraz przeprowadzenie krystalizacji etanianu sodu.
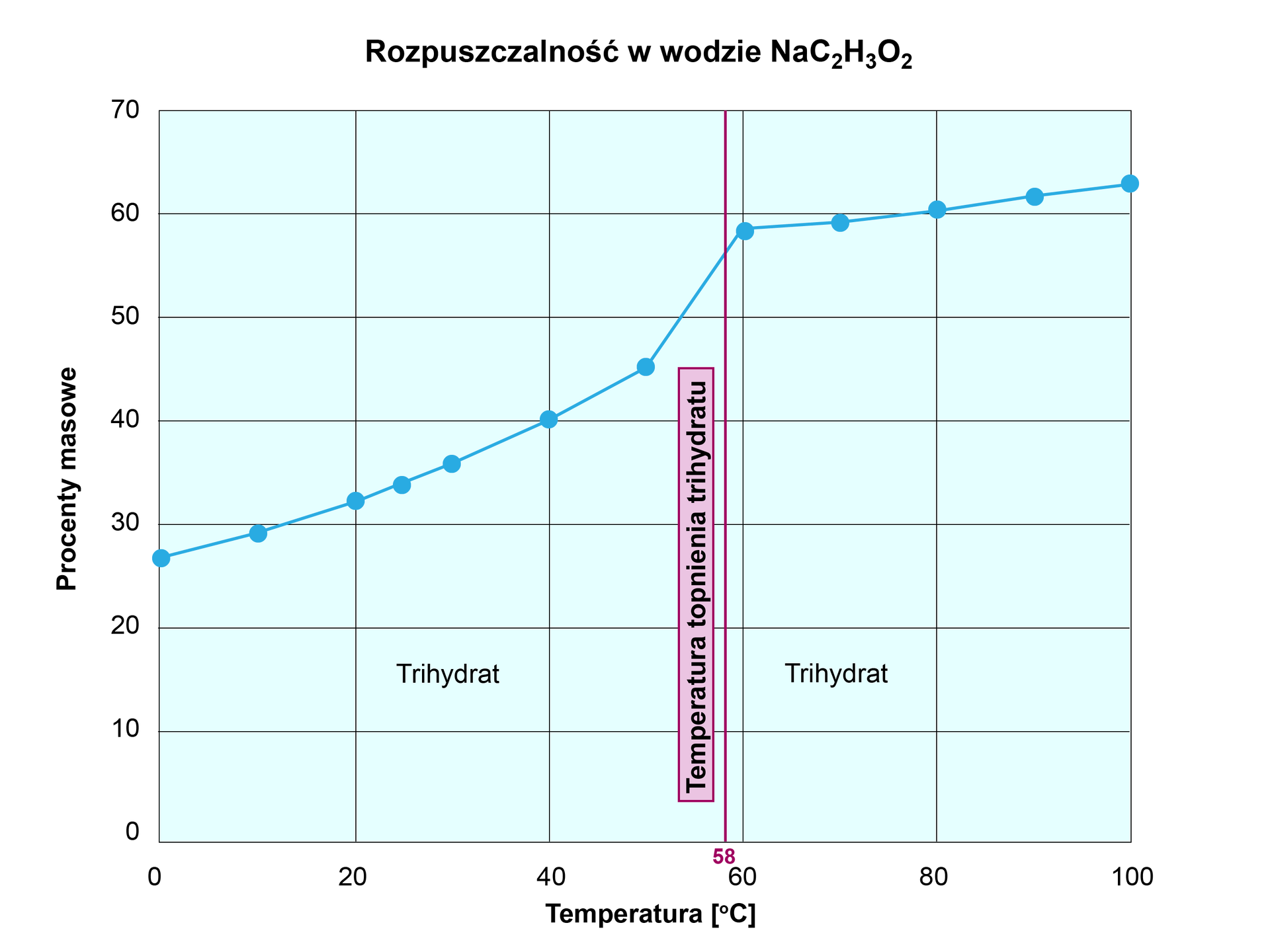
Aby otrzymać roztwór przesycony, należy oziębić gorący, nasycony roztwór. Z wykresu rozpuszczalności uwodnionego etanianu sodu wynika, że w temperaturze roztwór nasycony etanianu sodu posiada w swoim składzie substancji rozpuszczonej () i wody. Po przygotowaniu roztworu nasyconego, należy szybko go schłodzić. Jeżeli obniżymy temperaturę do i cała rozpuszczona substancja pozostanie w roztworze, wówczas uzyskamy roztwór przesycony.
RozpuszczalnośćRozpuszczalność etanianu sodu (octanu sodu):
Należy najpierw usunąć wszelkie pozostałości stałej substancji rozpuszczanej, żeby nie było zarodków krystalizacji.
Roztwór przesycony jest niestabilny. W praktyce oznacza to, że drobne zaburzenie, np. wstrząs, dostanie się do roztworu zanieczyszczenia lub wrzucenie kryształka, spowoduje krystalizację nadmiaru substancji rozpuszczonej.
Rozpuszczalność w temperaturze wynosi , więc masa wykrystalizowanego osadu powinna wynieść:
Roztwór przesycony można także otrzymać przez odparowanie rozpuszczalnika z roztworu nasyconego.
Miód jest roztworem przesyconym ze względu na ilość zawartych w nim cukrów – głównie glukozy i fruktozy. W warunkach przechowywania, czyli w temperaturze pokojowej, krystalizacja glukozy może przebiegać kilka miesięcy, a nawet kilka lat.

Zjawisko wydzielania się ciepła w procesie krystalizacji roztworu przesyconego zostało wykorzystane w pewnym rodzaju kieszonkowych ogrzewaczy dłoni. Wykorzystuje się w nich etanian sodu lub tiosiarczan sodu.

Słownik
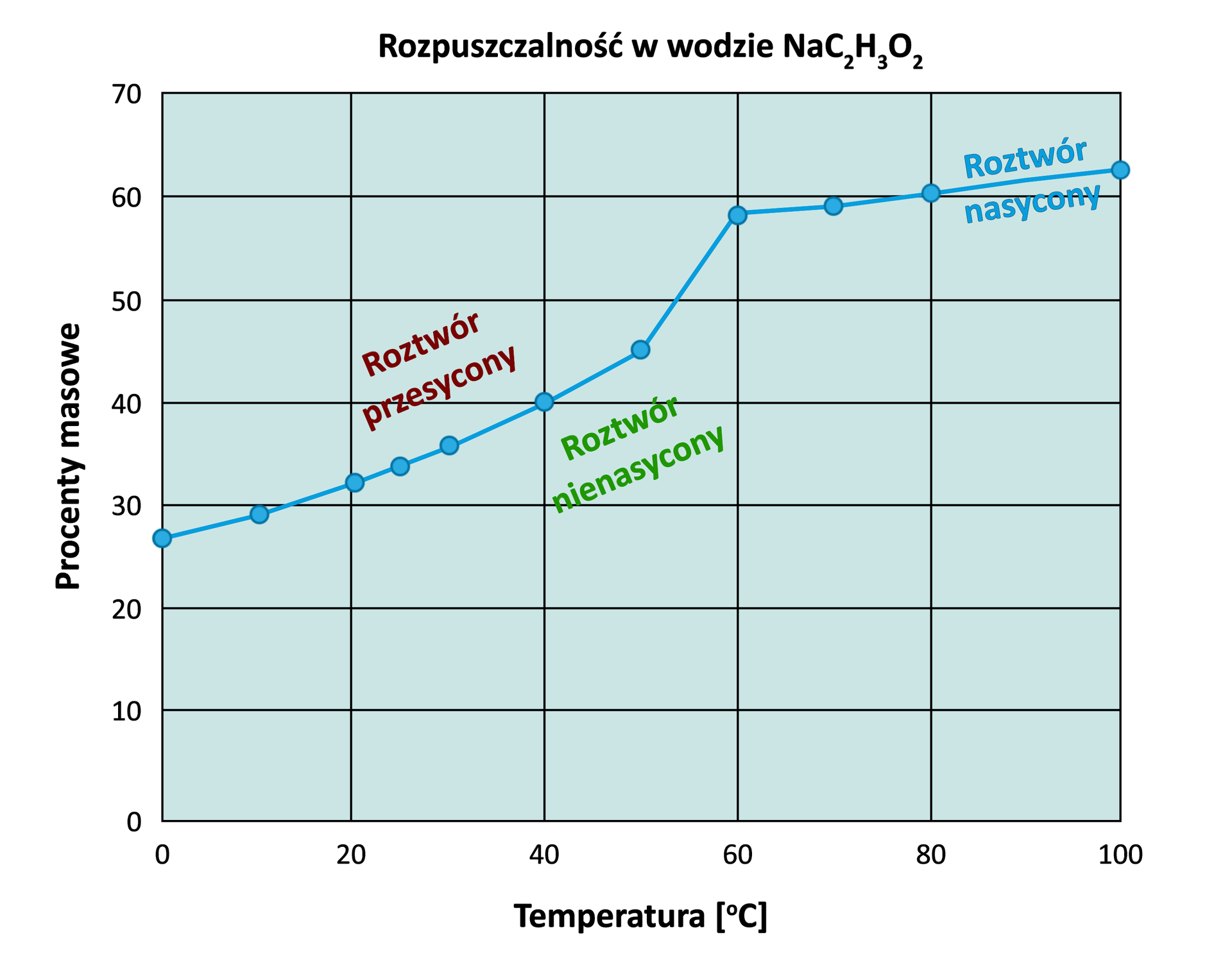
określa maksymalną ilość substancji, jaka może rozpuścić się w rozpuszczalnika w danej temperaturze i pod stałym ciśnieniem
roztwór, który w danej temperaturze zawiera maksymalną ilość substancji rozpuszczonej, a dodana do niej kolejna porcja substancji nie ulega rozpuszczeniu
roztwór o większej zawartości substancji rozpuszczonej względem roztworu nasyconego
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 549‑595.
Litwin m., Styka‑Wlazła Sz., Szymońska J., Chemia ogólna i nieorganiczna. Część 1. Podręcznik dla liceum, Warszawa 2004, s. 1774‑193.
Sawicka J., Janich‑Kilian A., Cejnert‑Mania W., Urbańczyk G., Tablice chemiczne, Gdańsk 2002, s. 222 i 226.