Przeczytaj
KwasyKwasy, zarówno organiczne, jak i nieorganiczne, można otrzymywać na kilka sposobów. Jedną z metod, którą można otrzymać wybrane kwasy, jest reakcja wymiany podwójnej. W tym przypadku, do soli słabego kwasu bądź jej wodnego roztworu dodajemy kwasu mocnego. W wyniku takiej reakcji chemicznej otrzymamy sól oraz słaby kwas, który zostaje wyparty ze swojej soli.
sól słabego kwasu + mocny kwas → słaby kwas + sól mocnego kwasu
Moc kwasu
Kwasy charakteryzują się swoją indywidualną stałą dysocjacji kwasowej, która decyduje o mocy kwasu. Stała ta nie zależy od stężenia elektrolitu, lecz od rodzaju rozpuszczalnika i temperatury (ze wzrostem temperatury wartość stałej dysocjacji kwasowej rośnie). Wraz ze wzrostem wartości stałej dysocjacji kwasowej, dysocjacja zachodzi w większym stopniu, więc moc kwasu także rośnie.
Porównajmy dwa kwasy: kwas octowy oraz kwas chlorowodorowy.
Proces dysocjacji obu kwasów możemy zilustrować następującymi równaniami:
dla kwasu octowego
dla kwasu chlorowodorowego
Zauważasz różnicę w zapisie tych procesów?
Wyrażenia na stałe dysocjacji dla tych kwasów wyglądają następująco:
Jak widzisz, stała dysocjacji kwasu chlorowodorowego jest znacząco wyższa od stałej dysocjacji kwasu octowego. Oznacza to, że w kwasie chlorowodorowym występują tak naprawdę tylko jony, a kwas ten dysocjuje w 100%, stąd zapis reakcji dysocjacji ze strzałką w jedną stronę. W roztworze kwasu octowego stała dysocjacji jest mała – obecne są zdysocjowane jony oraz cząsteczki kwasu, które są w równowadze, dlatego zapisujemy równanie reakcji ze strzałkami w dwie strony.
Stałe dysocjacji wybranych kwasów nieorganicznych w roztworach wodnych w temperaturze 25°C | |
|---|---|
Kwas nieorganiczny | Stała dysocjacji lub KIndeks dolny a1a1 |
6,3 · 10Indeks górny -4-4 | |
1,0 · 10Indeks górny 77 | |
3,0 · 10Indeks górny 99 | |
1,0 · 10Indeks górny 1010 | |
1,0 · 10Indeks górny -7-7 | |
1,9 · 10Indeks górny -4-4 | |
2,5 · 10Indeks górny -3-3 | |
5,0 · 10Indeks górny -8-8 | |
1,1 · 10Indeks górny -2-2 | |
5,0 · 10Indeks górny 22 | |
5,1 · 10Indeks górny -4-4 | |
27,5 | |
1,5 ·10Indeks górny -2-2 | |
5,8 · 10Indeks górny -10-10 | |
5,9 · 10Indeks górny -10-10 | |
6,5 · 10Indeks górny -4-4 | |
6,9 · 10Indeks górny -3-3 | |
3,2 · 10Indeks górny -10-10 | |
4,5 · 10Indeks górny -7-7 | |
Stałe dysocjacji wybranych kwasów organicznych w roztworach wodnych w temperaturze 25°C (jeśli w tabeli nie zaznaczono inaczej) | |
|---|---|
Kwas organiczny | Stała dysocjacji |
1,8 · 10Indeks górny -4-4 (T = 20°C) | |
1,8 · 10Indeks górny -5-5 | |
1,4 · 10Indeks górny -5-5 | |
6,5 · 10Indeks górny -5-5 | |
1,3 · 10Indeks górny -10-10 (T = 20°C) | |
Stałe dysocjacji wybranych zasad w roztworach wodnych w temperaturze 25°C | |
|---|---|
Zasada | Stała dysocjacji KIndeks dolny bb |
1,8 · 10Indeks górny -5-5 | |
4,3 · 10Indeks górny -4-4 | |
5,0 · 10Indeks górny -4-4 | |
4,0 · 10Indeks górny -4-4 | |
7,4 · 10Indeks górny -4-4 | |
7,4 · 10Indeks górny -5-5 | |
4,3 · 10Indeks górny -10-10 | |
Indeks górny Źródło: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
J. Sawicka, A. Janich‑Kilian, W. Cejner‑Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001. Indeks górny koniecŹródło: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
J. Sawicka, A. Janich‑Kilian, W. Cejner‑Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001.
Na podstawie tabeli nr 1, porównaj moc kwasów i uporządkuj od najmocniejszego do najsłabszego.
Moc kwasów beztlenowych (, gdzie to niemetal) można określić za pomocą porównania elektroujemności atomu niemetalu. Wraz ze wzrostem elektroujemności atomu niemetalu w okresie, moc kwasów się zwiększa. Czym większa jest różnica elektroujemności pomiędzy pierwiastkami i w wiązaniu, tym wiązanie jest bardziej spolaryzowane. Większe spolaryzowanie wiązania sprzyja rozpadowi substancji chemicznej na jony. Moc kwasów beztlenowych w grupie zwiększa się wraz ze zmniejszeniem się wartości elektroujemności w atomie .
Powyżej opisana tendencja ma jednak charakter orientacyjny. W przypadku kwasów beztlenowych czynnikiem decydującym o mocy kwasu jest wielkość promienia atomowego – im większy promień atomowy niemetalu, połączonego z atomem wodoru, tym moc kwasu będzie równie większa.
Przeanalizujmy teraz kwasy z pierwiastkami z grupy 17. układu okresowego pierwiastków.
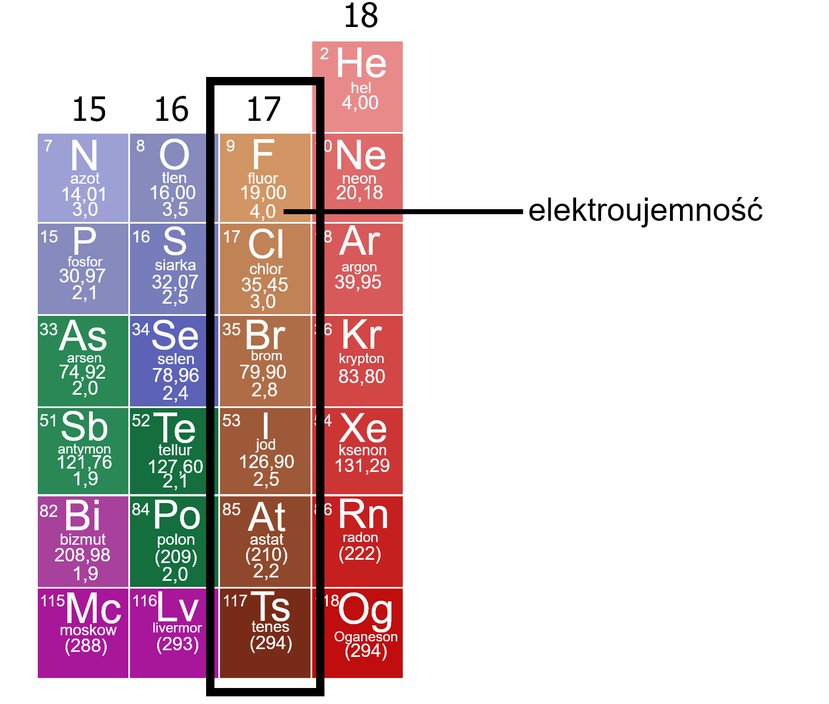
Porównując wartości elektroujemności niemetali 17. grupy układu okresowego pierwiastków, można stwierdzić, że jest kwasem najsłabszym, ponieważ fluor wykazuje największą wartość elektroujemności, a co za tym idzie – promień atomowy fluoru jest najmniejszy. Najmocniejszym kwasem z tej grupy jest natomiast , ponieważ jod ma najniższą wartość elektroujemności, a więc jego promień atomowy jest największy.
Korzystając z powyższego fragmentu układu okresowego pierwiastków, odczytaj wartości elektroujemności fluorowców oraz postaraj się ustalić, który z tych niemetali tworzy kwasy najmocniejsze.
Moc kwasów tlenowych wzrasta wraz ze wzrostem wartości elektroujemności atomów pierwiastka zawartego w reszcie kwasowej – zarówno w grupie, jak i w okresie układu okresowego pierwiastków chemicznych.
Należy jednak pamiętać, że regułę tę możemy stosować tylko w przypadku porównywania kwasów o tej samej budowie, np. , gdzie jest symbolem pierwiastka. Zatem możemy porównywać ze sobą i , nie zaś np. i . Stąd uniwersalnym kluczem, który umożliwia porównanie mocy kwasów, jest analiza zgodna z wartościami stałych dysocjacji.
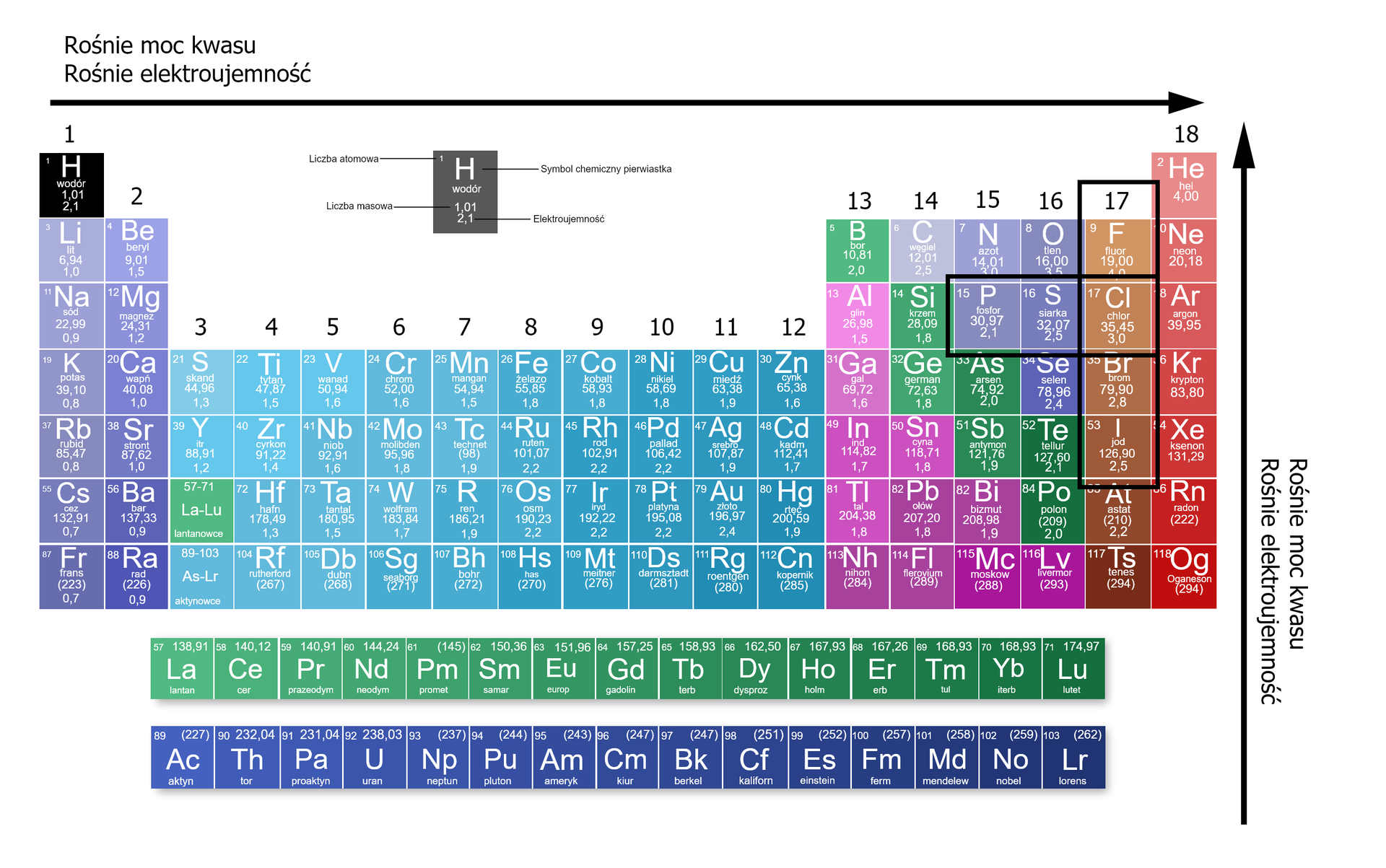
Porównując moc kwasów tlenowych tego samego pierwiastka, należy pamiętać, że moc kwasu wzrasta wraz ze wzrostem stopnia utlenienia atomu centralnego.
Czy zawsze mocniejszy kwas wypiera słabszy z jego soli? Co ma wpływ na tę reakcję chemiczną?
Gdy do roztworu octanu sodu () doda się kwas solny (np. ), to równanie omawianej reakcji chemicznej wygląda następująco:
Jak widać, w wyniku powyższej reakcji otrzymano chlorek sodu oraz kwas octowy (etanowy). Octan (etanian) sodu jest solą złożoną z kationu metalu oraz anionu reszty kwasu octowego, który jest słabym kwasemsłabym kwasem ( = 1,8 · 10Indeks górny -5-5). Natomiast kwas solny jest kwasem mocnym ( = 1,0 · 10Indeks górny 77; ) , który wyparł kwas słabszy (kwas octowy) z roztworu jego soli.
Im większa różnica w mocy kwasu, tym silniej stan równowagi przesunięty jest w prawo. Jednak dotyczy to tylko przypadku słabych kwasów i bardzo mocnych.
Metody otrzymywania kwasu przez wypieranie go z jego soli
Wypierany kwas jest słabszy niż kwas działający na sól
Kwasy, których tlenki nie reagują z wodą, otrzymuje się zazwyczaj z ich soli. Na taką sól działa się innym mocnym kwasem, w wyniku czego interesujący nas kwas zostaje wyparty z soli.
Problem badawczy: czy po zmieszaniu wodnego roztworu krzemianu sodu i rozcieńczonego kwasu chlorowodorowego otrzymamy kwas krzemowy?
Wybierz jedną z poniższych hipotez.
- W wyniku zmieszania roztworu krzemianu sodu i rozcieńczonego kwasu chlorowodorowego otrzyma się kwas krzemowy.
- W wyniku zmieszania roztworu krzemianu sodu i rozcieńczonego kwasu chlorowodorowego nie otrzyma się kwasu krzemowego.
Wykonanie:
1. Do probówki wlej 2-3 cm3 roztworu krzemianu sodu.
2. Dodaj około 1 cm3 kwasu chlorowodorowego.
3. Obserwuj zachodzące zmiany.
Narysuj schemat doświadczenia.
Schemat wykonaj w zeszycie do lekcji chemii, zrób zdjęcie, a następnie umieść je w wyznaczonym polu.
Równanie reakcji chemicznej:
Równanie reakcji zapisz w zeszycie, zrób zdjęcie, a następne umieść je w wyznaczonym polu.
Podsumowanie:
Reakcja wypierania kwasu w wyniku reakcji strąceniowych
W omawianym przypadku sól trudno rozpuszczalna powstaje z kwasu, który jest substratem.
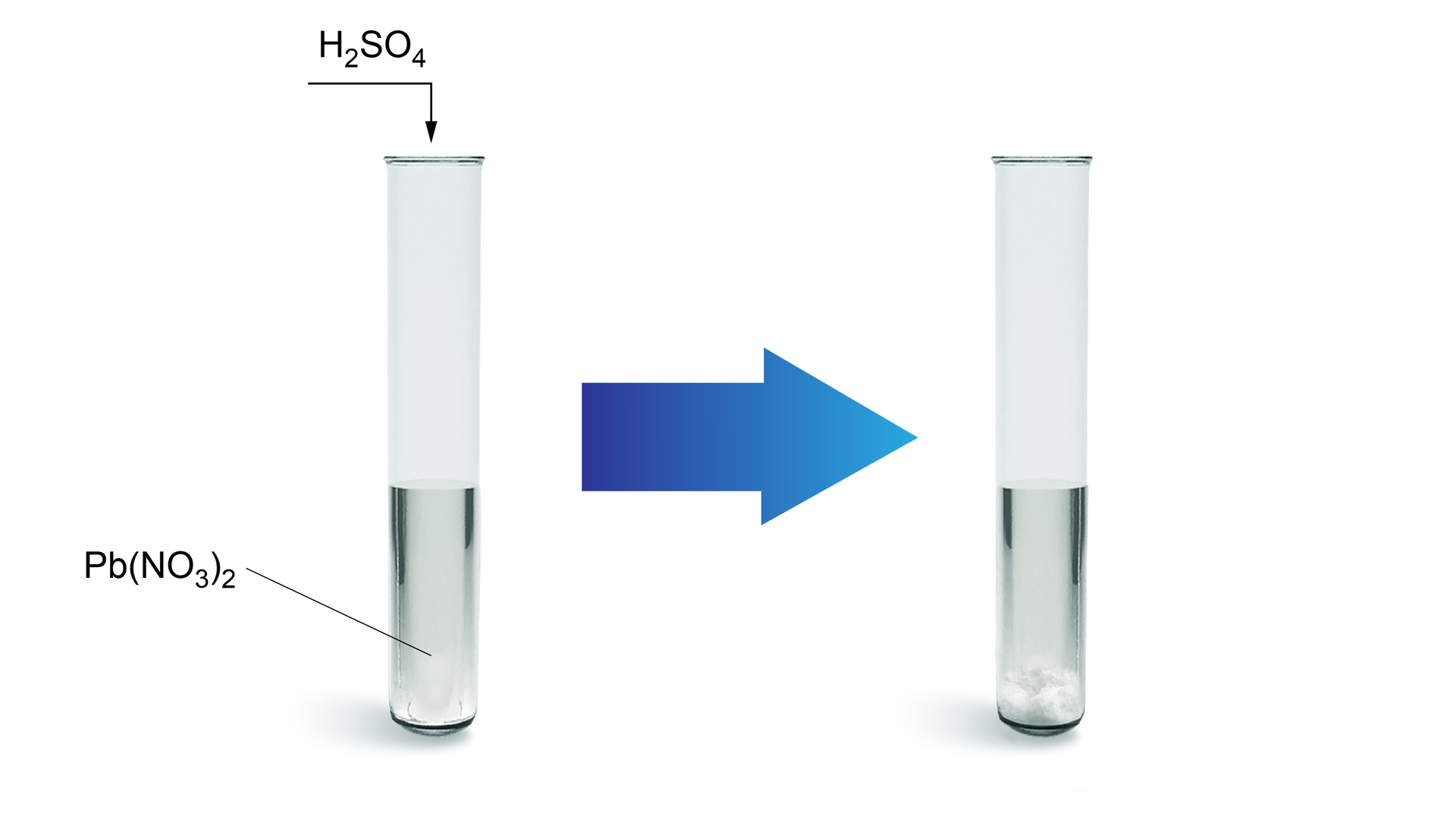
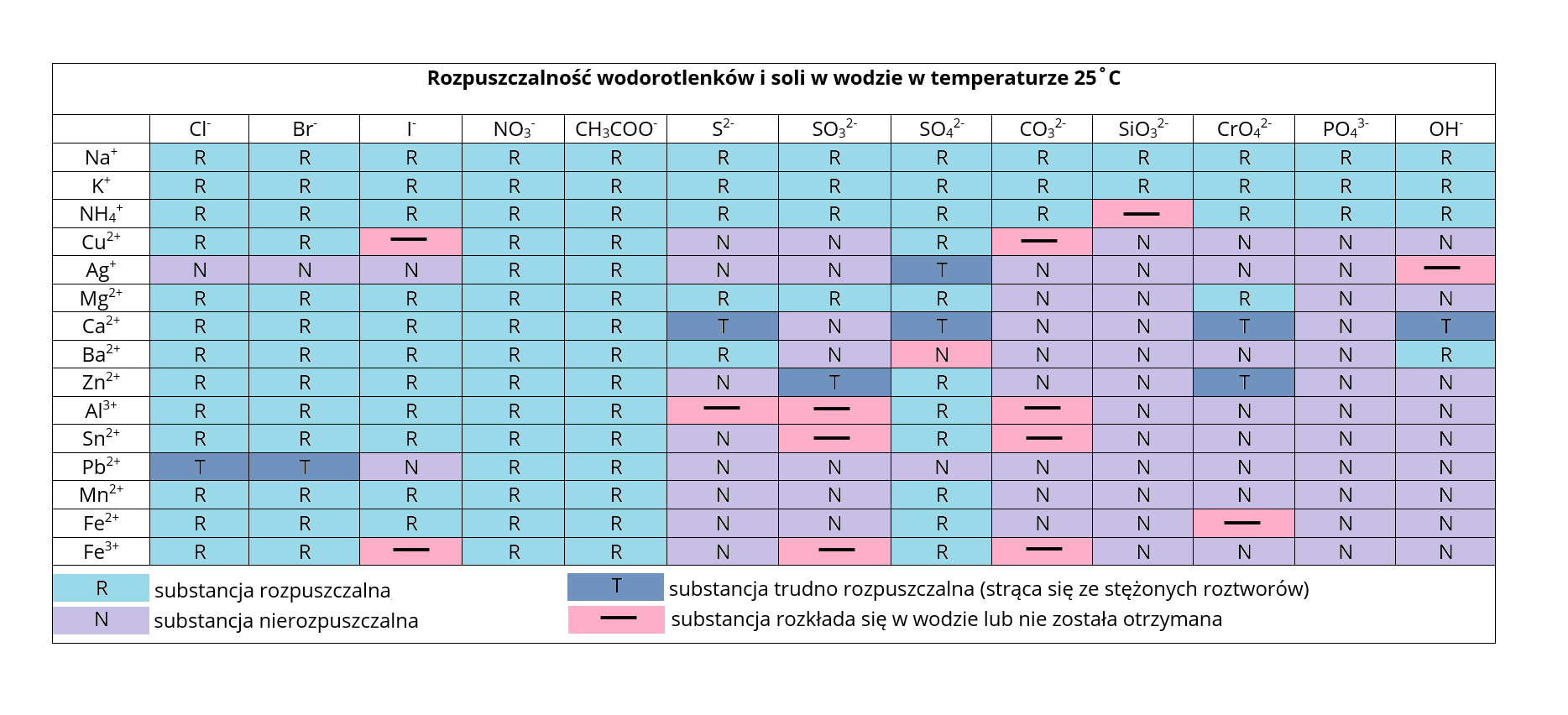
Czy po zmieszaniu roztworów kwasu siarkowego(VI) i azotanu(V) ołowiu(II) otrzymamy kwas azotowy(V)?
Hipoteza:
W wyniku zmieszania dwóch roztworów: kwasu siarkowego(VI) i azotanu(V) ołowiu(II) otrzyma się kwas azotowy(V).
Sprzęt i odczynniki:
Wykonanie:
1. Do probówki wlej 2-3 cm3 roztworu azotanu(V) ołowiu(II).
2. Dodaj około 1 cm3 roztworu kwasu siarkowego(VI).
3. Obserwuj zachodzące zmiany.
Narysuj schemat doświadczenia.
Schemat wykonaj w zeszycie do lekcji chemii, zrób zdjęcie, a następnie umieść je w wyznaczonym polu.
Równanie reakcji chemicznej:
Równanie reakcji zapisz w zeszycie, zrób zdjęcie, a następne umieść je w wyznaczonym polu.
Podsumowanie:
Gdzie sprawdzisz, czy powstająca w hipotetycznej reakcji strąceniowej sól faktycznie się wytrąci? Oczywiście w tabeli rozpuszczalności.
Wypierany kwas jest lotny
Czy po zmieszaniu kwasu bromowodorowego i wodnego roztworu siarczku wapnia otrzymamy siarkowodór?
Hipoteza:
W wyniku zmieszania kwasu bromowodorowego i wodnego roztworu siarczku wapnia otrzymamy siarkowodór.
Sprzęt i odczynniki:
Wykonanie:
1. Do probówki wlej 2-3 cm3 roztworu siarczku wapnia
2. Dodaj około 1 cm3 kwasu bromowodorowego.
3. Zawartość probówki podgrzej w płomieniu palnika.
4. Obserwuj zachodzące zmiany.
Narysuj schemat doświadczenia.
Schemat wykonaj w zeszycie do lekcji chemii, zrób zdjęcie, a następnie umieść je w wyznaczonym polu.
Równanie reakcji chemicznej:
Równanie reakcji zapisz w zeszycie, zrób zdjęcie, a następne umieść je w wyznaczonym polu.
Podsumowanie:
Słownik
według teorii Brønsteda jest to donor protonu, a zgodnie z teorią Arrheniusa substancja, która w roztworze wodnym dysocjuje na kation wodoru i anion reszty kwasowej
kwas, który w roztworze wodnym ulega całkowitej dysocjacji
kwas, który w roztworze wodnym ulega dysocjacji w małym stopniu
Bibliografia
Atkins P., Jones L., Chemia ogólna: cząsteczki, materia, reakcje, Warszawa 2009.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987.