Przeczytaj
Reakcje zobojętniania
Reakcje mocnego kwasu z mocną zasadą
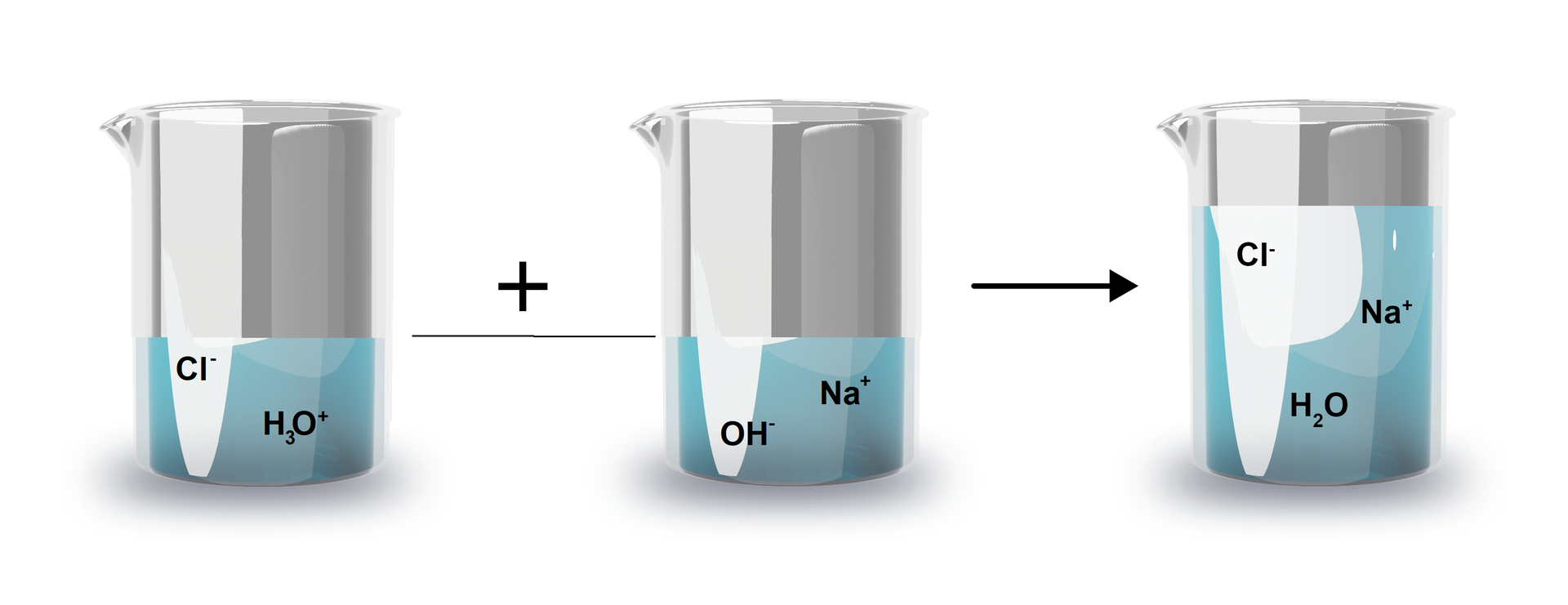
Co się stanie, gdy do kwasu chlorowodorowego dodasz stechiometryczną ilość wodorotlenku sodu? Stosując zapis cząsteczkowy, napisz równanie reakcji opisanej poniższym schematem.
Zarówno , jak i są mocnymi elektrolitamimocnymi elektrolitami. Dlatego też, powyższe równanie reakcji można zapisać w formie jonowej, w następujący sposób:
Mocne elektrolity, pod wpływem wody, ulegają bowiem praktycznie całkowitej dysocjacji elektrolitycznej. W analizowanym przykładzie mieszamy wodny roztwór chlorowodoru (w którym tak naprawdę nie ma cząsteczek tej substancji, a jedynie jony i ) z wodnym roztworem wodorotlenku sodu (w którym związek ten jest całkowicie zdysocjowany na jony i ). Odczyn wodnego roztworu chlorowodoru jest kwasowy, a odczyn wodnego roztworu wodorotlenku sodu jest zasadowy. Jaki więc będzie odczyn roztworu uzyskanego po zmieszaniu opisanych roztworów wyjściowych, jeśli chlorowodór i wodorotlenek sodu występują w nich w ilościach stechiometrycznych?
Przyjrzyjmy się jonowemu skróconemu zapisowi analizowanego równania reakcji:
Zapis ten najlepiej odzwierciedla to co faktycznie dzieje się w roztworze. Reakcja, w której łączą się jony oksoniowe z jonami wodorotlenkowymi to reakcja zobojętnianiazobojętniania. W wyniku reakcji mocnego kwasu i mocnej zasady utworzyła się sól, w tym przypadku całkowicie zdysocjowana, która nie ulega reakcji hydrolizyhydrolizy, a odczyn otrzymanego roztworu jest obojętny.
Reakcje słabego kwasu z mocną zasadą
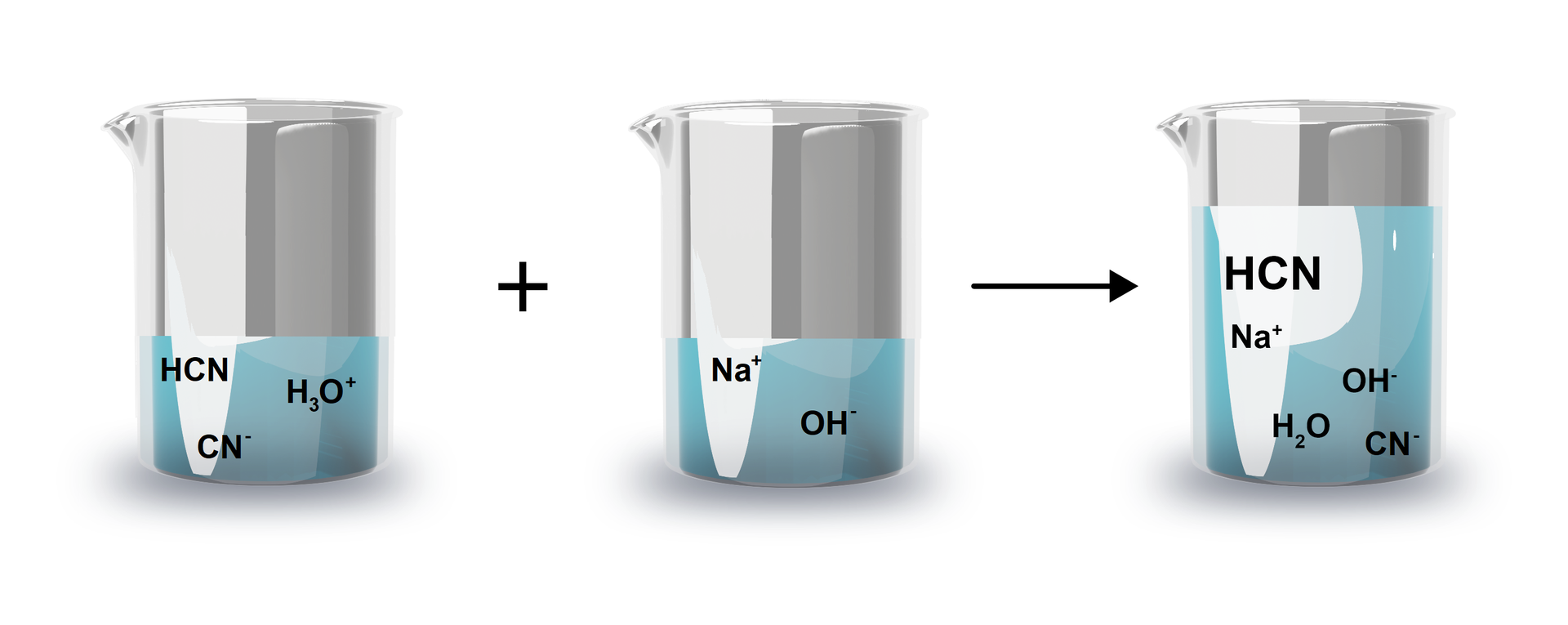
Rozpatrzmy przykład, w którym zmieszano stechiometrycznie kwas słaby – z zasadą mocną – .
Kwas cyjanowodorowy jest kwasem słabym, a więc w roztworze dominuje niezjonizowana forma słabego kwasu. Zatem do równania jonowego nie wprowadzamy jonów i , ale właśnie formę niezdysocjowaną .
Pełny zapis równania jonowego:
Pomijając jony powtarzające się po obu stronach równania, otrzymujemy:
W powyższej reakcji kwas zostaje zobojętniony w wyniku przeniesienia protonu z cząsteczki kwasu na zasadę, a dokładnie na jon wodorotlenkowy. Odczyn otrzymanego roztworu jest jednak zasadowy, ponieważ obecne w roztworze jony ulegają hydrolizie anionowej:
Reakcje mocnego kwasu ze słabą zasadą
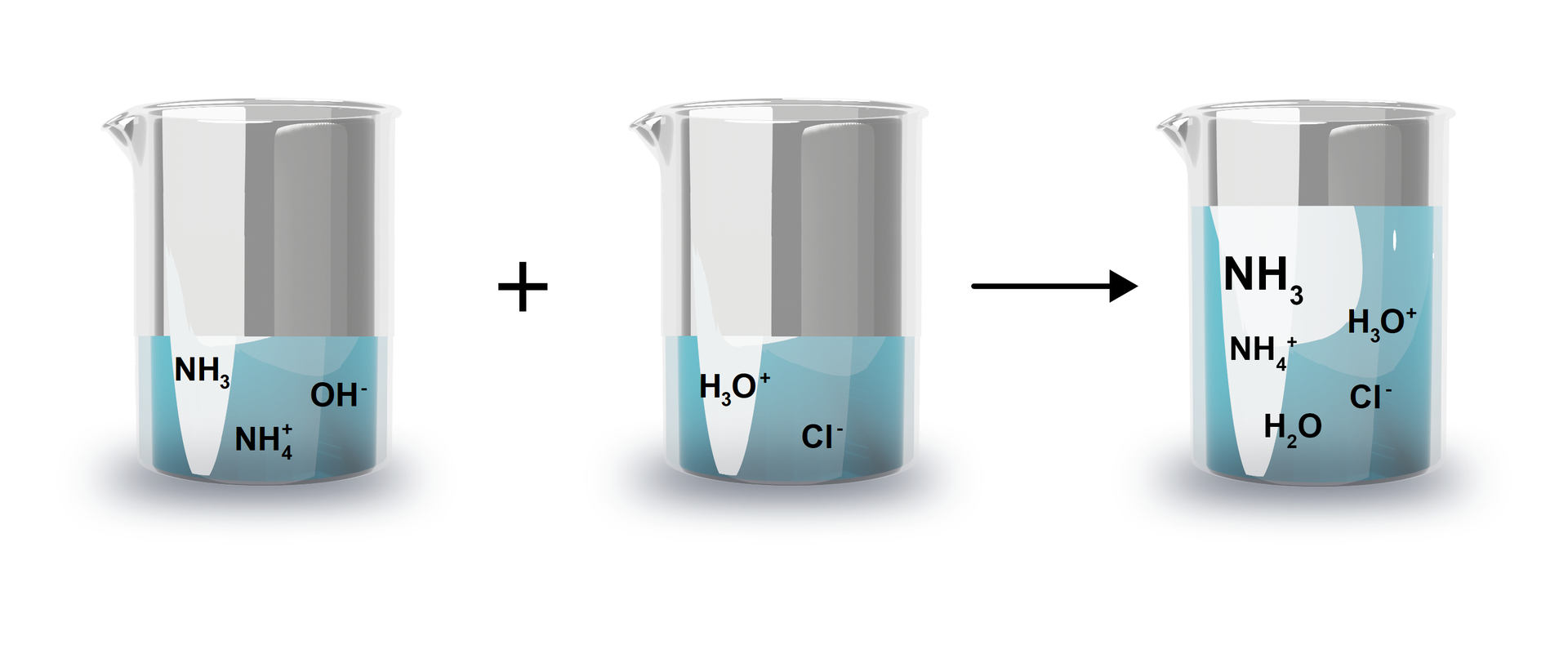
W tym przypadku omówimy reakcję chemiczną, w której zmieszano stechiometrycznie słabą zasadę (amoniak) z mocnym kwasem (kwas chlorowodorowy).
Pełne równanie jonowe wygląda następująco:
Pomijając jony identyczne, występujące po obu stronach równania otrzymujemy:
W powyższej reakcji zasada zostaje zobojętniona, poprzez przyłączenie protonu z cząsteczki kwasu. Odczyn otrzymanego roztworu jest jednak kwasowy, ponieważ obecne w roztworze jony ulegają hydrolizie kationowej:
Reakcje słabego kwasu ze słabą zasadą
Rozważmy teraz reakcję chemiczną zachodzącą pomiędzy stechiometryczną ilością słabego kwasu, np. kwasu octowego oraz słabej zasady, np. amoniaku.
Na podstawie powyższego równania nie można bezpośrednio określić odczynu roztworu otrzymanego przez zmieszanie stechiometrycznych ilości słabego kwasu i słabej zasady. Aby określić odczyn takiego roztworu, należy porównać wartości stałych dysocjacji elektrolitycznej dla substratów użytych do reakcji i w ten sposób określić ich moc. Jeżeli moc słabego kwasu i moc słabej zasady są porównywalne, to . Substrat o większej mocy decyduje o odczynie roztworu. Odczyn w tym przypadku może być lekko kwasowy lub lekko zasadowy.

Podsumowanie
Jak widać, reakcje zobojętniania to nie tylko reakcje mocny kwas – mocna zasada. Reakcje zobojętniania mogą przebiegać także pomiędzy słabym kwasem i mocną zasadą oraz odwrotnie. Reakcja zobojętniania to także reakcja prowadząca do zmiany środowiska, może także zachodzić pomiędzy solą a kwasem, solą a zasadą. Gdy do roztworu kwasu będziemy dodawać zasadę, to nastąpi obniżenie stężenia jonów oksoniowych a wzrost stężenia jonów wodorotlenkowych. W przypadku, gdzie do zasady będziemy dodawać kwasu, obserwujemy sytuację odwrotną, czyli obniżenie stężenia jonów wodorotlenkowych i wzrost stężenia jonów oksoniowych. Reakcje zobojętnienia nie zawsze prowadzą do równego , ale w ich wyniku odczyn roztworu staje się bliższy odczynowi obojętnemu.
W jaki więc sposób poradzisz sobie ze zgagą, która powstaje przez nadmierną ilość soku żołądkowego w organizmie?
W skład soku żołądkowego wchodzi kwas chlorowodorowy (solny), który jest mocnym elektrolitem. Skoro chcemy pozbyć się nadmiaru tego kwasu, to należy użyć takiej substancji, która podniesie pH w żołądku.
Nadmiar kwasu w organizmie człowieka neutralizuje się poprzez spożycie czystej wody, dzięki której kwas jest rozieńczany i podwyższa się przez to pH soku żołądkowego. Innym sposobem jest wypicie szklanki mleka lub szklanki wodnego roztworu sody oczyszczonej. Soda oczyszczona to tak naprawdę wodorowęglan sodu, który reaguje z kwasem chlorowodorowym w następujący sposób:
Zapisz równanie reakcji chemicznej wodorowęglanu sodu z kwasem chlorowodorowym stosując zapis jonowy skrócony:
Jak widać, w wyniku reakcji jonów wodorowęglanowych z jonami oksoniowymi, pochodzącymi od kwasu, powstaje woda oraz tlenek węgla(). W ten sposób podwyższa się soku żołądkowego i neutralizowana jest obecność jonów oksoniowych.
Słownik
substancja chemiczna, która po stopieniu lub po rozpuszczeniu w wodzie przewodzi prąd elektryczny. Elektrolitami mogą być roztwory wodne soli, kwasów i zasad. Rozróżniamy elektrolity mocne i słabe
elektrolit, który w roztworze wodnym jest zdysocjowany całkowicie, np. kwas chlorowodorowy
elektrolit, który w roztworze wodnym zdysocjowany jest tylko częściowo, np. kwas octowy
cecha roztworu, która zależy od wzajemnego stosunku jonów i w roztworze. Odczyn roztworu może być kwasowy (), zasadowy (), i obojętny ()
reakcja chemiczna pomiędzy kwasem a zasadą, która prowadzi do zmiany środowiska reakcji w kierunku odczynu bardziej obojętnego
reakcja wody z jonami pochodzącymi od słabych kwasów lub słabych zasad powstającymi podczas dysocjacji elektrolitycznej soli
Bibliografia
Jones L., Atkins P., Chemia ogólna: cząsteczki, materia, reakcje, Warszawa 2018.