Przeczytaj
Reakcja żelaza z tlenem
Żelazo jest metalem stabilnym na powietrzu. Jednak rozdrobnione ma właściwości piroforycznewłaściwości piroforyczne. Pod wpływem temperatury, zaczyna się utleniać, tworząc odpowiedni tlenek. W wyniku tej reakcji chemicznej powstaje tlenek żelaza() i magnetyt – tlenek żelaza(,).

Reakcje żelaza z fluorowcami
Żelazo reaguje z pierwiastkami grupy układu okresowego – fluorowcami. W wyniku reakcji chemicznej, pomiędzy żelazem a konkretnym fluorowcem powstają odpowiednie sole. W przypadku trzech pierwszych przedstawicieli grupy, żelazo w soli przyjmuje stopień utlenienia:
Gdzie .
Wyjaśnijmy to na przykładzie.
Zapisz w zeszycie równanie reakcji żelaza z fluorem, a współczynniki chemiczne dobierz, korzystając z metody bilansów elektronowego. Zapisz równania procesów utleniania i redukcji. Określ, które z indywiduów pełni funkcję utleniacza, a które reduktora.
Żelazo w odpowiednich warunkach reaguje również z jodem. W wyniku tej reakcji chemicznej, otrzymuje się jednak jodek żelaza().
Reakcje żelaza z kwasami
W zależności od użytego do reakcji chemicznej kwasu, otrzymujemy różne produkty:
kwasy o słabych właściwościach utleniających
Do kwasów o słabych właściwościach utleniających należą m.in.: kwas solny(chlorowodorowy) , kwas bromowodorowy , kwas fosforowy() , rozcieńczony kwas siarkowy() . W przypadku kwasów nieutleniających, w wyniku reakcji chemicznej metalu i kwasu, otrzymuje się sól żelaza() i wodór.
Jednak taka reakcja zachodzi tylko wtedy, gdy metal jest bardziej aktywny od wodoru. Aktywność chemiczną metali prezentuje tzw. szereg aktywności metali:
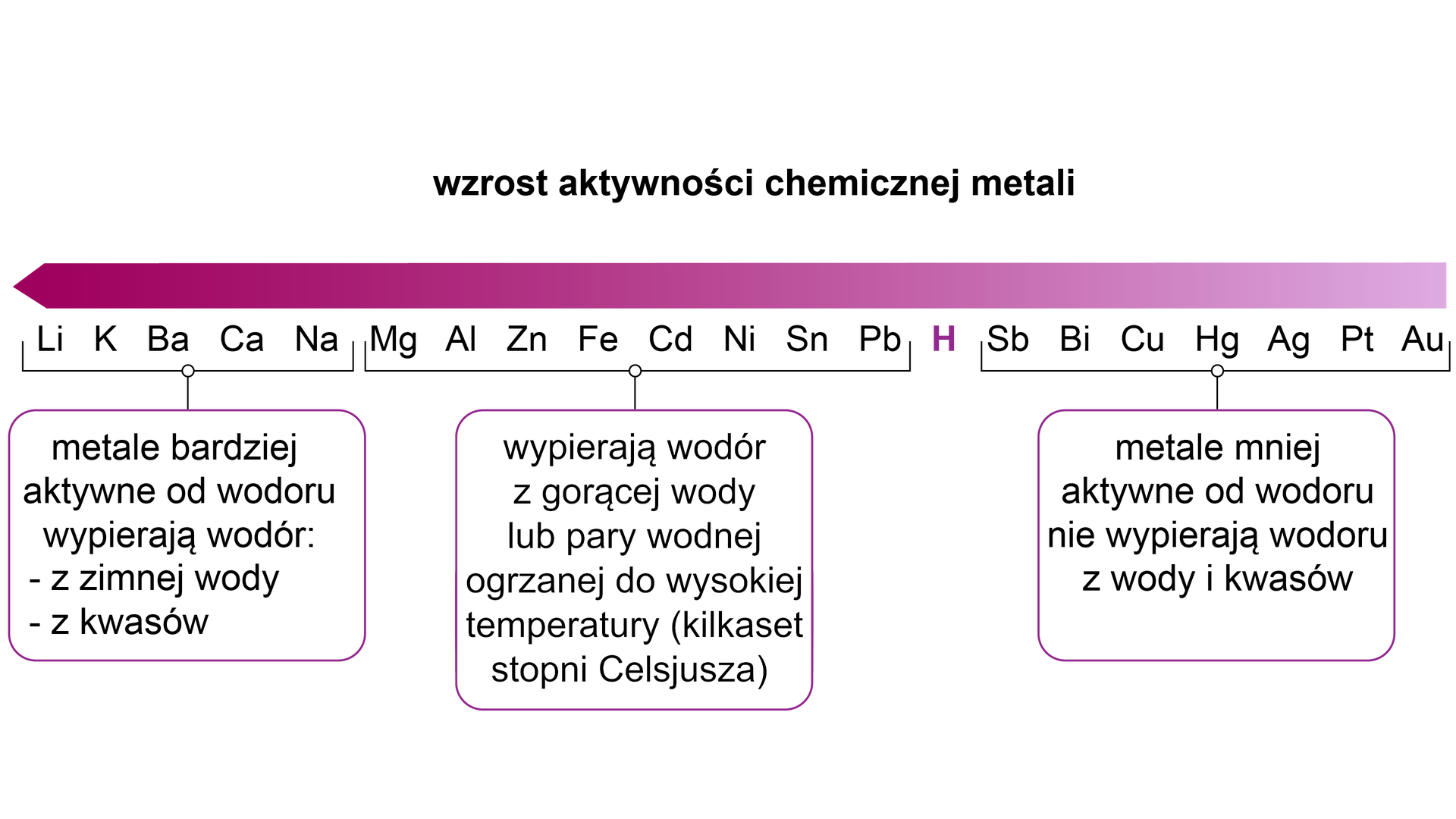
Jak łatwo zauważyć, żelazo znajduje się powyżej wodoru w szeregu aktywności metali. Dlatego też będzie będzie ono wypierać wodór z kwasów. W reakcji żelaza z kwasami nieutleniającymi powstają odpowiednie sole żelaza na stopniu utlenienia.
Wyjaśnijmy to na przykładzie.
Zapisz w zeszycie równanie reakcji żelaza z rozcieńczonym kwasem siarkowym(), a współczynniki chemiczne dobierz, korzystając z metody bilansu elektronowego. Zapisz równania procesów utleniania i redukcji. Określ, które z indywiduów pełni funkcję utleniacza, a które reduktora.
kwasy o silnych właściwościach utlenijących
Do kwasów o silnych właściwościach utleniających zaliczamy: kwas azotowy() stężony i rozcieńczony () i stężony kwas siarkowy() ().
Kwasy o silnych właściwościach utleniających reagują z metalami aktywniejszymi od wodoru (z wyjątkiem metali pasywujących), jak i z metalami szlachetnymi – mniej aktywnymi od wodoru (z wyjątkiem platyny i złota). W wyniku reakcji chemicznej, pomiędzy metalem a kwasem utleniającym powstaje sól i tlenek otrzymany w wyniku redukcji reszty kwasowej.
Żelazo, w wyniku reakcji ze stężonymi kwasami utleniającymi, ulega pasywacji, pokrywając się szczelnie warstewką odpowiedniego tlenku, przez co nie reaguje ze stężonymi kwasami utleniającymi.
W reakcjach chemicznych żelaza z rozcieńczonym kwasem azotowym() powstają sole żelaza na stopniu utlenienia. Wyjaśnijmy to na przykładzie.
Zapisz w zeszycie równanie reakcji żelaza z rozcieńczonym kwasem azotowym(), a współczynniki chemiczne dobierz, korzystając z metody bilansu elektronowego. Zapisz równania procesów utleniania i redukcji. Określ, które z indywiduów pełni funkcję utleniacza, a które reduktora.
Słownik
(gr. piupsilonrhoomicronphiόrhoomicronς od piῦrho „ogień” i phiomicronrhoός „niosący”) właściwość powodująca samozapłon w kontakcie z tlenem z powietrza
w wyniku ich działania może dochodzić do utlenienia metalu i jednoczesnej redukcji nie tylko wodoru, ale również atomu centralnego reszty kwasowej
pokrywanie się powierzchni metalu szczelną warstewką związku chemicznego tego metalu (najczęściej tlenku, ale też węglanu), chroniącą metal przed dalszym niszczeniem
Bibliografia
Atkins P., Jones L., Podstawy chemii fizycznej, Warszawa 2009.
Bielański A., Podstawy Chemii Nieorganicznej, t. 2, Warszawa 2007.
Encyklopedia PWN
Pajdowski L., Chemia ogólna, Warszawa 2002.