Przeczytaj
Fluorowce
Fluorowce to pierwiastki 17. grupy układu okresowego. Należą do nich fluor, chlor, brom, jod oraz otrzymany syntetycznie astat. Substancje te nie występują w przyrodzie w stanie wolnym, ale w postaci różnorodnych związków chemicznych (w stanie związanym). Najczęściej spotyka się związki chloru, np. halit , sylwin oraz związki fluoru, np. fluoryt , apatyt czy kriolit .
Konfiguracje elektronowe wybranych atomów poszczególnych fluorowców zestawiono w poniższej tabeli.
Fluorowiec | Konfiguracja elektronowa w ujęciu powłokowym | Konfiguracja elektronowa podpowłokowa skrócona |
|---|---|---|
Stopnie utlenienia, które mogą przyjmować atomy wybranych fluorowców w związkach chemicznych oraz przykłady odpowiadających im związków chemicznych zestawiono w tabeli.
Stopień utlenienia | ||||
|---|---|---|---|---|
-I | , | |||
I | - | , | , | |
III | - | - | ||
IV | - | , | ||
V | - | , | ||
VII | - | , |
Istnieją również związki fluorowców, w których atomy fluorowca występują na dwóch różnych stopniach utlenienia.
Fluorowce różnią się właściwościami fizycznymi. Wybrane właściwości fizyczne poszczególnych fluorowców zebrano w poniższej tabeli.
Fluorowiec | Stan skupienia w temp. pokojowej | Rozpuszczalność w wodzie | Rozpuszczalność w toulenie | Właściwości fizyczne |
|---|---|---|---|---|
fluor | gaz | dobra | dość dobra | żółtozielony gaz o ostrym zapachu, trujący |
chlor | gaz | dość dobra | dobra | żółtozielony gaz o ostrym zapachu, trujący |
brom | ciecz | dość dobra | dobra | ciemnobrunatna ciecz (z racji niskiej temperatury wrzenia gromadzi się nad nią czerwonobrunatna para) o ostrej, duszącej woni, trująca, wywołująca oparzenia |
jod | ciało stałe | słaba | dobra | szaroczarna substancja krystaliczna o metalicznym połysku, unoszą się nad nim fioletowe pary |
astat | nietrwały pierwiastek promieniotwórczy | |||
W dalszej części lekcji ograniczymy się do omówienia wybranych właściwości fizykochemicznych fluoru, chloru, bromu i jodu. Wiele z właściwości astatu jest bowiem nieznanych, ze względu na krótkie czasy życia jego izotopów (czas połowicznego rozpadu najtrwalszego izotopu astatu (astatu‑210), wynosi niewiele ponad 8 godzin).
Porównanie aktywności fluorowców
Aktywność chemiczna fluorowców spada wraz ze wzrostem liczby atomowej. Im mniejszy jest promień atomowy fluorowca, tym silniej elektrony są przyciągane przez jądro atomowe i tym łatwiej tworzy się anion .
Wspomniany anion występuje w odpowiednich solach fluorowców. Sole te można wykorzystać do doświadczalnego porównania aktywności chemicznej wybranych fluorowców. W reakcjach chemicznych fluorowiec bardziej aktywny wypiera bowiem z roztworu soli fluorowiec mniej aktywny. Zależności te opisano poniżej za pomocą odpowiednich (przykładowych) równań reakcji:
Różnice w aktywności chemicznej fluorowców przekładają się m.in. na różne warunki przebiegu ich reakcji z poszczególnymi substancjami.
Reakcje fluorowców
1. Reakcje z wodorem
Fluor reaguje z wodorem wybuchowo nawet w ciemności i niskiej temperaturze:
Chlor reaguje z wodorem po zainicjowaniu reakcji przez światło:
Brom łączy się z wodorem dopiero po naświetleniu lub po podgrzaniu:
Jod jest najmniej aktywny spośród fluorowców. Reaguje z wodorem dopiero w obecności katalizatora i w wysokiej temperaturze sięgającej 500°C. Bezpośrednia synteza pierwiastków prowadzi do otrzymania jodowodoru:
Otrzymane w wyniku powyższych reakcji fluorowcowodory HX po rozpuszczeniu w wodzie tworzą kwasy beztlenowe. Wśród beztlenowych kwasów fluorowców, tylko kwas fluorowodorowy jest słabym kwasem, pozostałe są kwasami mocnymi. Moc tych kwasów rośnie w grupie wraz ze wzrostem liczby atomowejliczby atomowej fluorowca.
2. Reakcje z wodą
Fluor gwałtownie reaguje z wodą. Powstaje wtedy fluorowodór i wydziela się tlen:
Chlor i brom rozpuszczają się w wodzie tworząc bezbarwną wodę chlorową oraz wodę bromową o brunatnej barwie. Rozpuszczając się w wodzie, chlor i brom wchodzą z nią w reakcje chemiczne, które przebiegają obok procesu rozpuszczania, a w roztworze ustala się równowaga:
W wyniku rozpuszczania chloru i bromu w wodzie, powstają kwasy chlorowodorowy i bromowodorowy oraz kwasy tlenowe: kwas chlorowy(I) i bromowy(I) .
Pod wpływem światła, kwasy i ulegają rozkładowi, w wyniku czego powstaje atomowy tlen:
Atomowy tlen łączy się w cząsteczki . Ponadto atomowy tlen może utleniać substancje, które znajdą się w roztworze chloru, dlatego woda chlorowa używana jest jako środek wybielający i dezynfekujący.
Tlenowe kwasy chloru i bromu
Spośród związków tlenu z fluorowcami na uwagę zasługują kwasy tlenowe, np. kwasy tlenowe chloru i bromu, których nazwy i wzory sumaryczne zestawiono w tabeli poniżej.
Nazwa | Wzór | Nazwa | Wzór |
|---|---|---|---|
kwas chlorowy(I) | kwas bromowy(I) | ||
kwas chlorowy(III) | kwas bromowy(III) | ||
kwas chlorowy(V) | kwas bromowy(V) | ||
kwas chlorowy(VII) | kwas bromowy(VII) |
Mocne i trwałe kwasy to kwas chlorowy(VII) i kwas bromowy(VII). Kwas chlorowy(VII) jest oleistą, łatwo wybuchającą cieczą.
Kwasy tlenowe chloru i bromu, w których pierwiastki te występują na I i III stopniu utlenienia, są nietrwałymi, słabymi kwasami, istniejącymi tylko w roztworach wodnych.
Kwasy tlenowe z chlorem i bromem na V stopniu utlenienia są mocnymi, ale nietrwałymi kwasami. Trwałe są natomiast sole tych kwasów, które podczas ogrzewania ulegają rozkładowi, np. chloran(V) potasu rozkłada się do chloranu(VII) potasu i chlorku potasu:
a ogrzewany w obecności katalizatora (np. ) rozkłada się z utworzeniem tlenu:
Podsumowanie
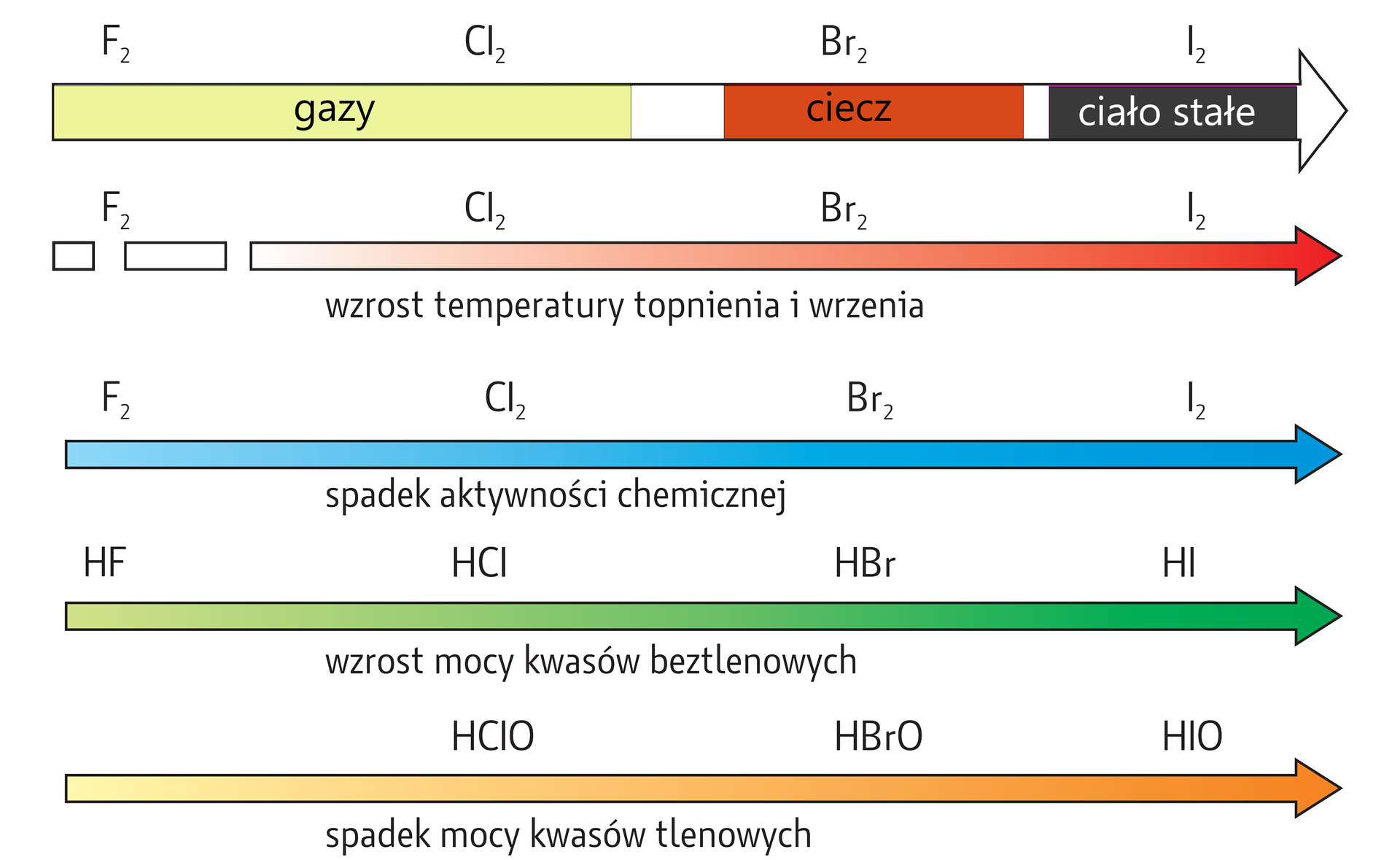
Właściwości fizykochemiczne fluorowców i ich wybranych związków zmieniają się wraz ze wzrostem liczby atomowejliczby atomowej fluorowca w następujący sposób:
Słownik
pojęcie umowne, określające liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomowi pierwiastka chemicznego wchodzącego w skład określonego związku, gdyby cząsteczki tego związku miały budowę jonową
podstawowa wielkość charakteryzująca i definiująca pierwiastek chemiczny, określająca liczbę protonów w jądrze atomu tego pierwiastka
Bibliografia
Bielański A., Podstawy Chemii nieorganicznej, t. 1‑2, Warszawa 2010.
Cox P.A., Chemia nieorganiczna. Krótkie wykłady, Warszawa 2000.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.
Lee J. D., Zwięzła chemia nieorganiczna, tłum. J. Kuryłowicz, Warszawa 1997, wyd. 5.