Przeczytaj
Hydroliza estrów i jej rodzaje
HydrolizaHydroliza jest to reakcja chemiczna, której ulegają między innymi estryestry. Dla tej grupy związków chemicznych wyróżniamy następujące rodzaje hydrolizy:
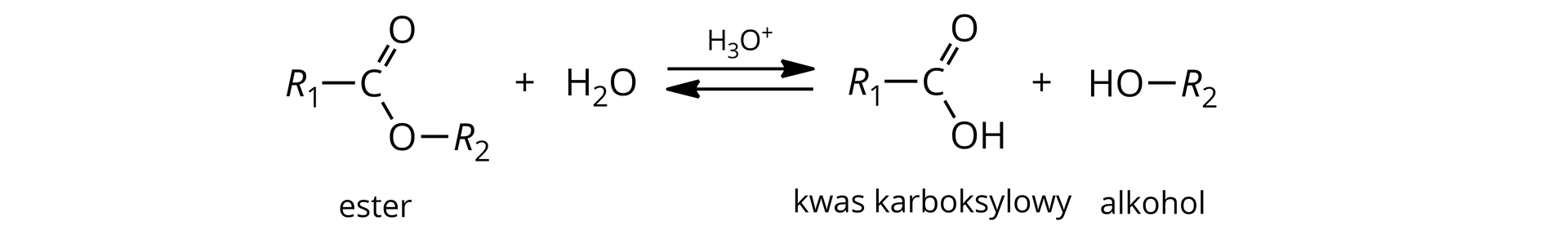
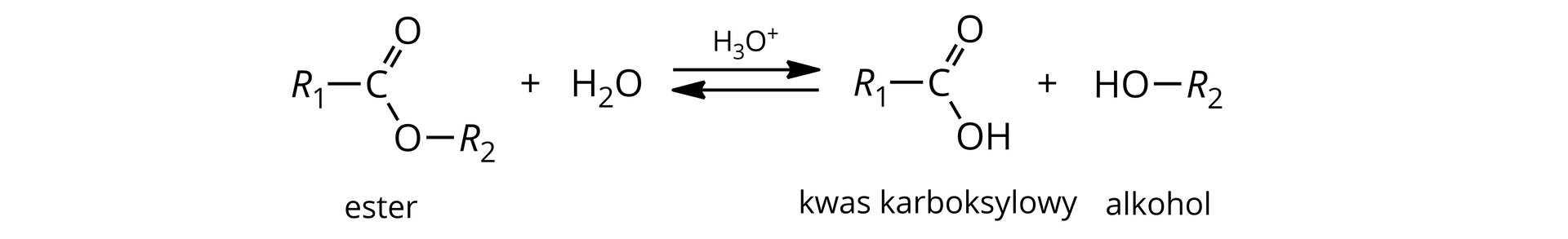
Hydroliza kwasowa – rozpad estru na kwas i alkohol. Hydroliza ta zachodzi pod wypływem wodnego roztworu kwasu. Jest odwróceniem reakcji estryfikacjiestryfikacji, czyli jest reakcją odwracalną.
Zapis ogólny hydrolizy kwasowej estrów:
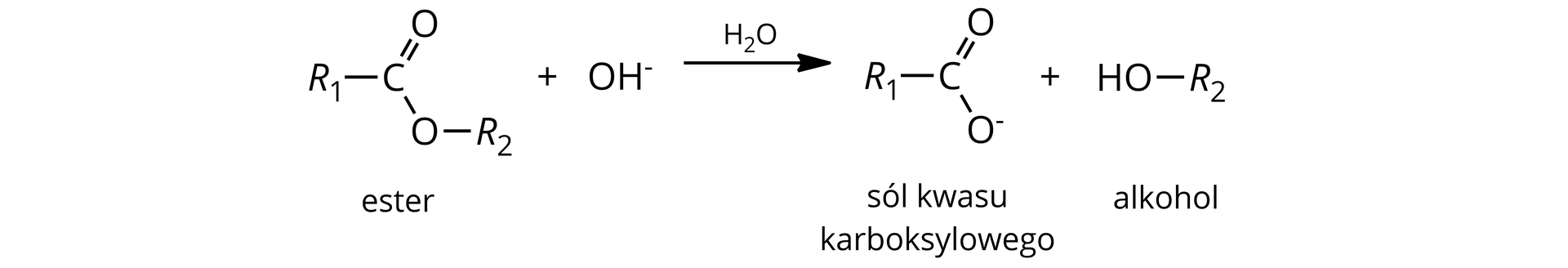
Hydroliza zasadowa – rozpad estru na sól kwasu karboksylowego i alkohol. Zachodzi ona w środowisku zasadowym. Jest to reakcja praktycznie nieodwracalna.
Zapis ogólny równania hydrolizy zasadowej estrów:
Mechanizm hydrolizy kwasowej
Hydroliza estru w środowisku kwasowym jest złożonym procesem. Wynika z podatności na reakcje substytucji nukleofilowej przy atomie węgla ugrupowania estrowego. W celu łatwiejszego zrozumienia poszczególnych etapów, cały mechanizm został rozpisany na etapy. Analiza dotyczy mechanizmu hydrolizy octanu etylu (etanianu etylu):
Równanie reakcji chemicznej
Pomijając mechanizm omówiony powyżej, równanie reakcji chemicznej przyjmuje zapis:
Podsumowanie
Kwasowa hydroliza estrów jest dokładną odwrotnością estryfikacji. Ogólnie hydrolizę kwasową estrów można zapisać:
Modelowo, ogólny mechanizm hydrolizy kwasowej można przedstawić następująco:
Słownik
powstają w wyniku estryfikacji; grupa organicznych związków chemicznych; powstają z kwasów (kwasy karboksylowe lub kwasy nieorganiczne) i alkoholi lub fenoli
reakcja chemiczna, w której powstają estry; przykłady niektórych sposobów otrzymywania estrów:
przez substytucję nukleofilową chlorków lub bezwodników kwasowych alkoholami
przez substytucję nukleofilową kwasów karboksylowych alkoholami (katalizator kwas nieorganiczny)
reakcja zachodząca pomiędzy substancją rozpuszczoną a wodą; ulegają jej związki organiczne i nieorganiczne
grupa funkcyjna zbudowana z atomu węgla, który jest połączony wiązaniem podwójnym z atomem tlenu; atom węgla w grupie karbonylowej ma hybrydyzację (jest ona płaska)
kation utworzony z atomu wodoru, poprzez oderwanie jego jednego elektronu; praktycznie jest to wolny proton (jon wodoru z oderwanym jednym elektronem)
substancja chemiczna wpływająca na obniżenie energii aktywacji; efektem jej zastosowania jest wzrost szybkości reakcji chemicznej; katalizator nie zużywa się w czasie reakcji
wynika z rezonansu chemicznego i jest wynikiem przedstawiania struktury związków chemicznych i innych indywiduów chemicznych za pomocą tzw. struktur granicznych; rzeczywista struktura cząsteczki jest opisywana przez kombinację liniową tych struktur
Bibliografia
Cordes E. H., Mechanism and catalysis for hydrolysis of acetals, ketals, and Ortho Esters, „Chemical Reviews” 2007, t. 74, nr 5, s. 1–44.
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Florian J., Warshel A., Phosphate Ester Hydrolysis in Aqueous Solution: Associative Versus Dissociative Mechanisms, „J. Phys. Chem. B” 1998, t. 102, nr 4, s. 719–734.
Krammer P., Vogel H., Hydrolysis esters in subcritical and supercritical water, „The Journal of Supercritical Fluidsn” 2000, t. 16, nr 3, s. 189–206.
Lukatela G., Krauss N., Theis K., Selmer T., i in., Crystal Structure of Human Arylsulfatase A: The Aldehyde Function and the Metal Ion at the Active Site Suggest a Novel Mechanism for Sulfate Ester Hydrolysis, „Biochemistry” 1998, t. 37, nr 11, s. 3654–3664.
Oxonium, online: https://pubchem.ncbi.nlm.nih.gov/compound/123332, dostęp: 29.04.2021.
The mechanism for the acid catalysed hydrolisis of esters, online: https://www.chemguide.co.uk/physical/catalysis/hydrolyse.html, dostęp: 29.04.2021.
Wyklad 16 I 2019 Żywienie, online: http://bekas.pl/wyklady_pliki/wyklady_18_19/16_i_org.pdf, dostęp: 29.04.2021.