Przeczytaj
Wodorki to dwuskładnikowe związki wodoru z pierwiastkami chemicznymi. W tych analizowanych w szkole może występować wiązanie jonowe, kowalencyjne czy kowalencyjne spolaryzowane. Wodorki jonowe są nazywane wodorkami typu soli. Pozostaje jednak pytanie – jakie pierwiastki je tworzą?
WodorkiWodorki typu soli tworzone są przez pierwiastki i grupy układu okresowego pierwiastków chemicznych (z wyjątkiem berylu, który tworzy wodorek o budowie kowalencyjnej.). Są to substancje krystaliczne, posiadające wysokie temperatury topnienia, które w stanie stopionym przewodzą prąd elektryczny. Wodór w nich występuje na stopniu utlenieniastopniu utlenienia w postaci anionu wodorkowego .
Wodorki litowców
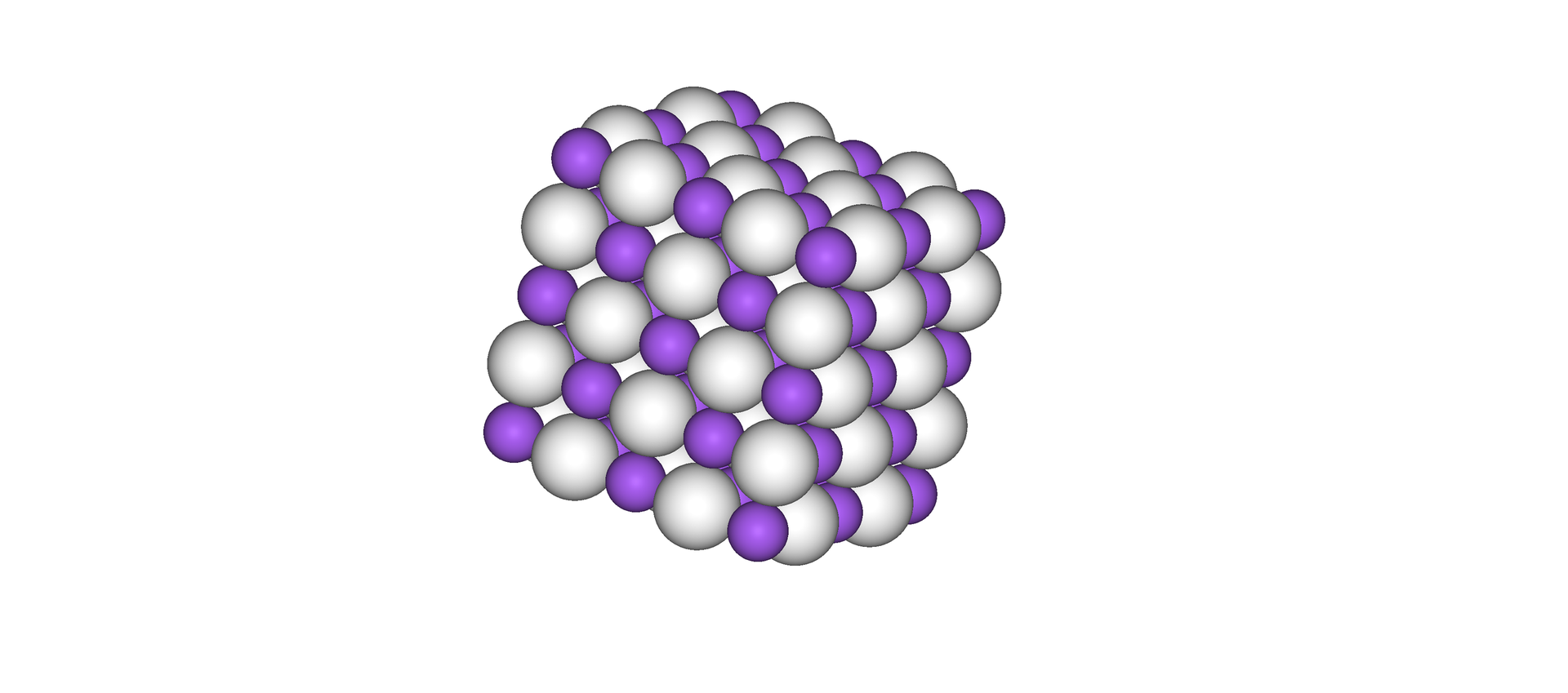
Wodorki te są związkami o budowie jonowej – typu soli, w których metal występuje w postaci kationu, a wodór w postaci anionu. Tworzą one sieci krystalicznesieci krystaliczne typu chlorku sodu.
Wodorki litowców w temperaturze pokojowej są bezbarwnymi ciałami stałymi, wysoce reaktywnymi, dlatego ze względów bezpieczeństwa w celach naukowych dostępne są jedynie w postaci zdyspergowanejzdyspergowanej w oleju mineralnym. Najbardziej trwały jest wodorek litu. Ogólny wzór sumarycznywzór sumaryczny dla wodorków pierwszej grupy układu okresowego to:
gdzie:
– symbol metalu grupy ;
– symbol atomu wodoru.
Powstają one w bezpośredniej reakcji pierwiastków z wodorem w podwyższonej temperaturze.
W reakcji z wodą reagują gwałtownie z wydzieleniem wodoru i utworzeniem wodorotlenku. Przykładem takiego związku jest – wodorek potasu.
Wodorki berylowców
Wszystkie berylowce tworzą wodorki w wyniku ogrzewania ich z gazowym wodorem:
Ogólny wzór sumaryczny dla wodorków drugiej grupy układu okresowego to:
gdzie:
– symbol metalu grupy 2.;
– symbol wodoru.
Beryl tworzy wodorek o wiązaniach kowalencyjnych. Wodorek berylu to substancja bezbarwna, która ulega rozkładowi w temperaturze . Reaguje z wodą powoli tworząc wodorotlenek berylu.
Jego sieć przestrzenną tworzą polimeryczne łańcuchy, beryl w nich jest związany kowalencyjnymi wiązaniami trójcentrowymiwiązaniami trójcentrowymi .
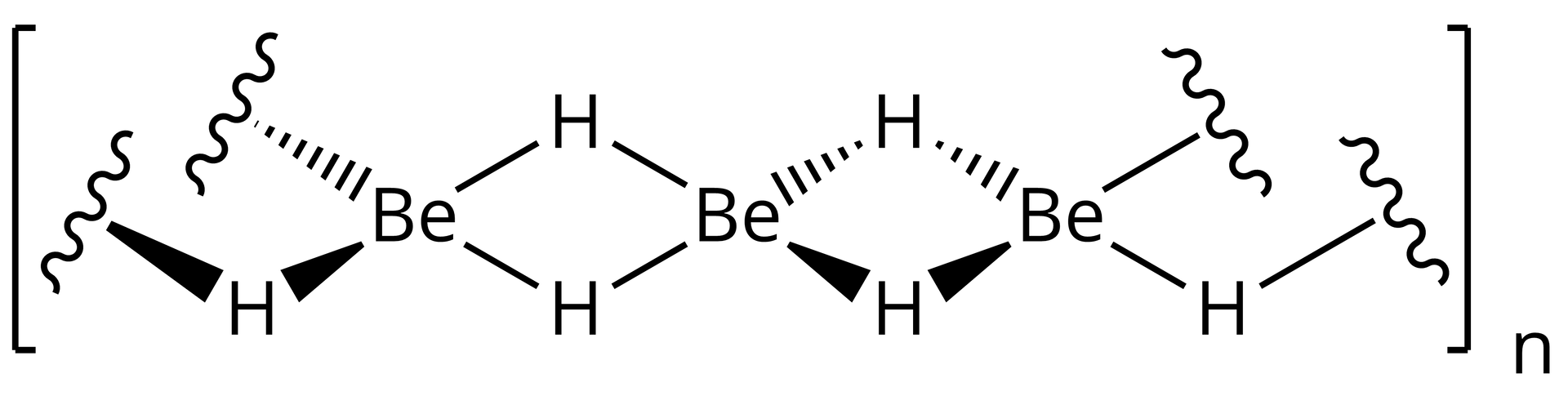
Wodorek berylu można otrzymać w dwóch reakcjach: chlorku berylu z wodorkiem litu oraz dimetyloberylu z glinowodorkiem litu.
Wodorek magnezu można otrzymać w reakcji bezpośredniej pierwiastków, stosując zwiększone ciśnienie wodoru.
Można znaleźć dwie przeciwstawne informacje w literaturze – jedna z nich mówi o budowie jonowej wodorku magnezu, a druga o występowaniu w nim wiązań kowalencyjnych. W praktyce wodorek ten wykazuje strukturę pośrednią w zależności od warunków.
W reakcji z wodą tworzy wodorotlenek magnezu i gazowy wodór.
Pozostałe pierwiastki tej grupy (wapń, stront, bar, rad) tworzą wodorki typowo jonowe. Wodorek wapnia można otrzymać w wyniku bezpośredniej syntezy z pierwiastków, stosując wysoką temperaturę ().
Wodorek wapnia z wodą reaguje gwałtownie, wydzielając wodór i wodorotlenek wapnia.
Pozostałe wodorki reagują z wodą podobnie. W wyniku tych reakcji powstają ich wodorotlenki, zgodnie z poniższymi reakcjami:
Słownik
ładunek jonu, w jaki przekształciłby się atom danego pierwiastka, gdyby wszystkie tworzone przez niego wiązania miały charakter jonowy
związki wodoru z innymi pierwiastkami; ze względu na skład wodorki możemy podzielić na:
wodorki niemetali – związki, w których wodór występuje na stopniu utlenienia;
wodorki metali – związki, w których wodór występuje na stopniu utlenienia
wzór chemiczny, który podaje symbole pierwiastków oraz liczbę ich atomów, tworzących dany związek chemiczny, określa skład jakościowy i ilościowy związku chemicznego
pojęcie matematyczne, które oznacza powtarzające się w przestrzeni upakowanie drobin
wiązanie nietypowe elektrono–deficytowe, atomy je tworzące posiadają zbyt mało elektronów walencyjnych do związania tak dużej liczby wodorów, dlatego tworzone jest przez mostek między atomami np.
oznacza rozproszenie w postaci małych cząsteczek jednej fazy w drugiej (np. oleju w wodzie)
olej otrzymywany jako produkt uboczny destylacji ropy naftowej, stosowany np. jako dodatek do kosmetyków, smar; stanowi mieszaninę płynną różnych węglowodorów
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa .
Bielański A., Podstawy Chemii nieorganicznej, t. , Warszawa .
Encyklopedia PWN
Pac B., Zegar A., Podstawy klasyfikacji związków nieorganicznych w teorii i zadaniach, Kraków .