Przeczytaj
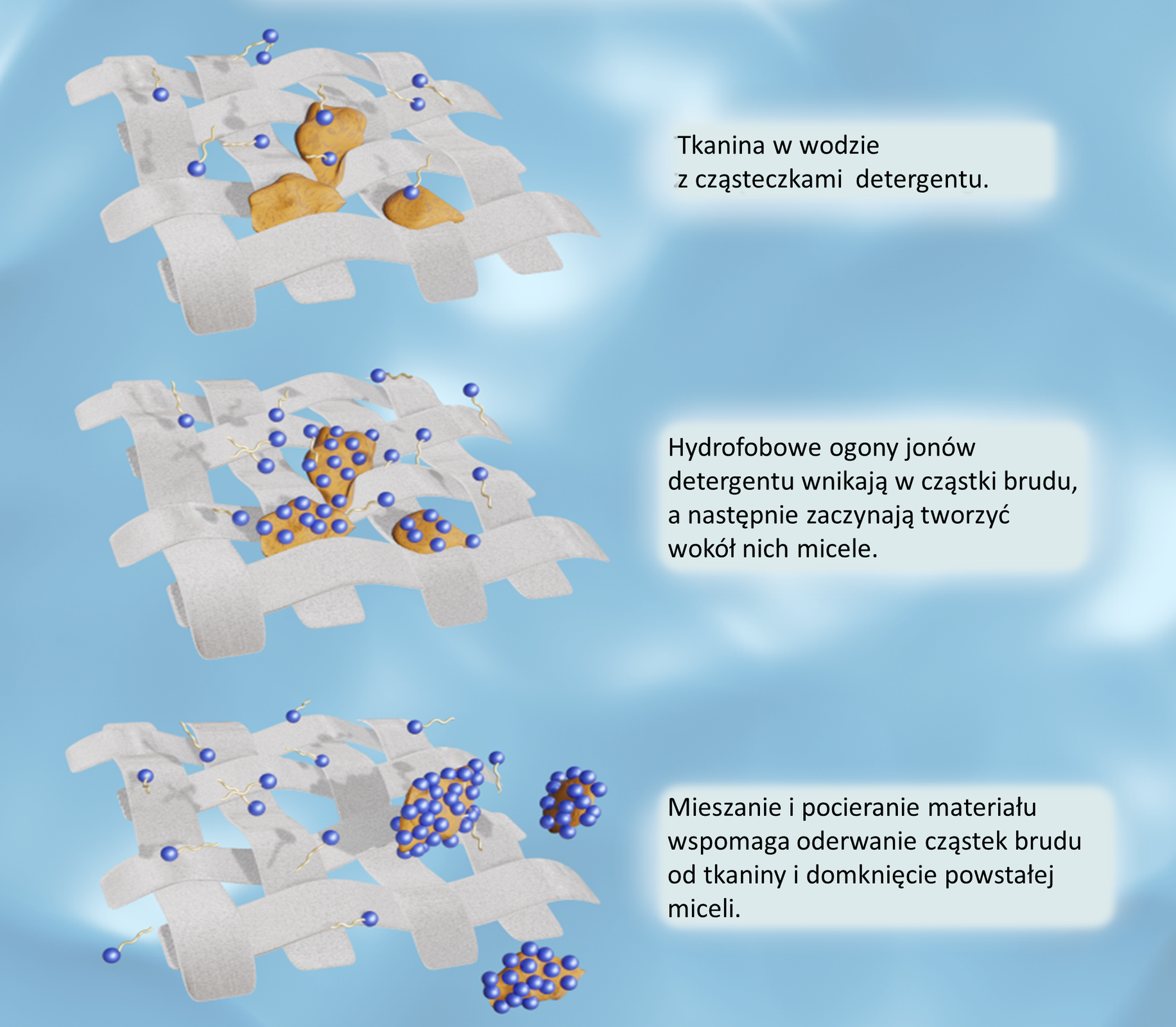
O zdolności mydła do usuwania brudu, na ogół tłuszczu, decyduje jego budowa. Cząsteczka mydła składa się z anionu , zbudowanego z długiego ogona, czyli niepolarnego łańcucha węglowodorowego o charakterze hydrofobowymhydrofobowym, oraz grupy , tzw. głowy, o właściwościach hydrofilowychhydrofilowych.

Mydła
Duże znaczenie przemysłowe mają sole sodowe lub potasowe wyższych kwasów tłuszczowych, zwane mydłamimydłami. Są to np.:
stearynian potasu: ;
palmitynian sodu: ;
oleinian potasu: .
W roztworze wodnym mydła ulegają:
dysocjacji elektrolitycznej, np.:
hydrolizie anionowej, jako sole słabych kwasów i mocnych zasad, np. wodny roztwór stearynianu potasu ma odczyn zasadowy, co potwierdza skrócony jonowy zapis tego procesu:
Proces prania
W czasie procesu prania lub mycia hydrofobowy ogon wnika do bryłki tłuszczutłuszczu (brudu), a hydrofilowa głowa pozostaje na jej powierzchni, umożliwiając zwilżanie przez wodę. Proces prania przedstawiono schematycznie poniżej.
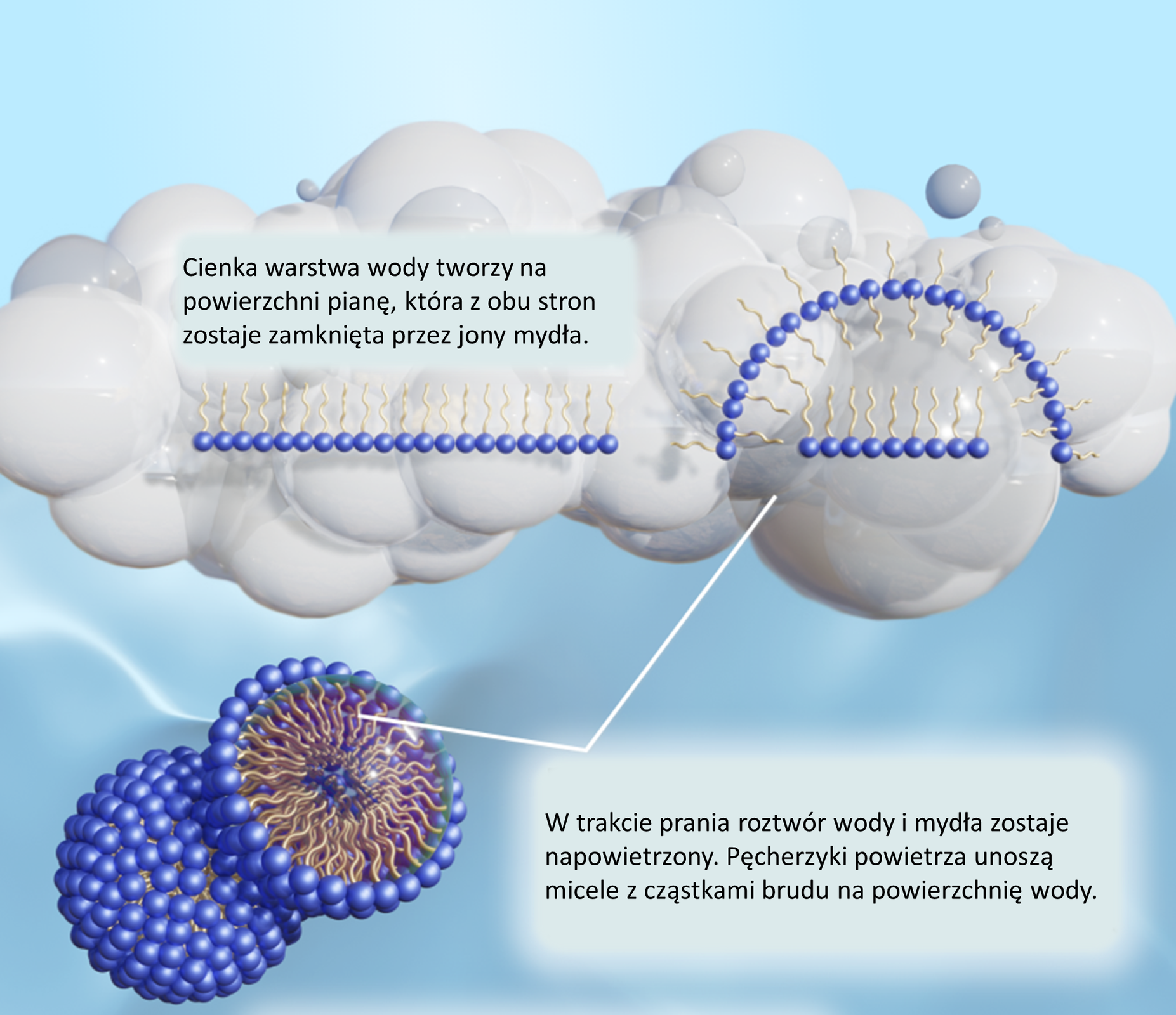
Mydła powodują zmniejszenie napięcia powierzchniowegonapięcia powierzchniowego wody, dzięki czemu mogą łatwo wnikać w pory skóry lub tkanin i usuwać brud. Jako związki, które obniżają napięcie powierzchniowe wody, zaliczamy je do szerszej grupy związków zwanej surfaktantamisurfaktantami (ang. surface active agent), czyli substancjami powierzchniowo czynnymi. Surfaktanty mają wiele praktycznych zastosowań jako:
detergenty – podstawowy składnik wszelkich środków czyszczących;
emulgatory – stosowane w farbach, kosmetykach i przemyśle spożywczym;
środki pianotwórcze.
W wodzie twardej, czyli zawierającej jony i , mydło prawie się nie pieni. Powstają wówczas nierozpuszczalne w wodzie związki, np.:
palmitynian wapnia :
stearynian magnezu :
Słownik
(gr. hydro „woda”, phobos „strach”) właściwość substancji, która polega na niezdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, głównie z wodą bądź grupami polarnymi innych cząsteczek; cecha makroskopowa materiałów obrazuje brak zdolności do zwilżania przez wodę
(gr. hydro „woda”, philia „lubić”) właściwość substancji, która polega na zdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, głównie z wodą bądź grupami polarnymi innych związków; cecha makroskopowa materiałów obrazuje zdolność do zwilżania wodą
związki organiczne, sole nasyconych i nienasyconych kwasów tłuszczowych o wzorach ogólnych, odpowiednio (gdzie n wynosi 11–17, m — wartościowość metalu Me)
energia potrzebna do utworzenia (w procesie izotermicznym) jednostkowego pola powierzchni rozdziału dwóch faz (np. cieczy i jej pary nasyconej)
tłuszcze właściwe, lipidy proste, estry glicerolu z kwasami tłuszczowymi długołańcuchowymi o parzystej liczbie atomów węgla
(ang. surface active agent) powierzchniowo czynne substancje, grupa związków chemicznych, których cząsteczki są zbudowane z dwóch elementów o przeciwnym powinowactwie do wody — z części hydrofobowej (o małym powinowactwie do wody) oraz części hydrofilowej (o dużym powinowactwie do wody)
Bibliografia
Encyklopedia PWN
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum. Poziom podstawowy i rozszerzony, Warszawa - Bielsko‑Biała 2010.