Przeczytaj
Berylowce są miękkimi, srebrzystobiałymi metalamimetalami, które, będąc aktywne chemicznie, występują w przyrodzie wyłącznie w postaci związków chemicznych. Wapń, bar oraz stront, ze względu na dużą reaktywność, przechowuje się w nafcie. W związkach chemicznych berylowce przyjmują stopień utlenienia.
Konfiguracje elektronowe wybranych berylowców
Berylowiec | Konfiguracja elektronowa | Konfiguracja elektronowa (zapis z użyciem rdzenia gazu szlachetnego) | Konfiguracja elektronowa (pełna) |
|---|---|---|---|
Otrzymywanie berylowców
Magnez można otrzymać w wyniku elektrolizyelektrolizy stopionego chlorku magnezu. Wapń i stront otrzymuje się podczas elektrolizy soli, takich jak chlorek wapnia czy chlorek strontu.
Elektroliza stopionego
Elektroliza stopionego
luka do uzupełnienia luka do uzupełnienia luka do uzupełnienia luka do uzupełnienia
luka do uzupełnienia luka do uzupełnienia
Właściwości chemiczne
Berylowce reagują z tlenem. Magnez w reakcji z tlenem tworzy tlenek magnezu, podobnie jak wapń, bar i stront. Natomiast bar i stront mogą tworzyć nadtlenki.
Wśród tlenków berylowców tylko tlenek berylu ma właściwości amfoteryczne, a pozostałe mają charakter zasadowy. Tlenki te w reakcji z kwasami tworzą sole, np.:
Tlenek berylu, jako tlenek amfoterycznyamfoteryczny, reaguje z kwasami i zasadami, nie reaguje natomiast z wodą:
Tlenki berylowców (z wyjątkiem tlenku berylu) reagują z wodą, tym samym tworząc zasady. Większość berylowców (z wyjątkiem berylu i magnezu) tworzy mocne zasady. Wodorotlenki berylowców można otrzymać na różne sposoby, np. w reakcjach:
metali z wodą:
tlenków metali z wodą:
strąceniowych:
Wodorotlenki wapnia i magnezu mają charakter zasadowy. Wodorotlenek berylu ma właściwości amfoteryczne.
Nasycony roztwór wodorotlenku wapnia nazywany jest wodą wapienną i służy do wykrywania tlenku węgla( ). Zawiesina wodorotlenku wapnia w wodzie to mleko wapienne (układ nietrwały). Nasycony roztwór to inaczej woda barytowa. Analizując tablicę rozpuszczalności, można łatwo zauważyć, że rozpuszczalność wodorotlenków berylowców wzrasta wraz ze wzrostem liczby atomowej berylowca.
Na szczególną uwagę zasługują sole berylowców – siarczany() i węglany:
węglany berylowców, poddane prażeniu, tworzą odpowiedni tlenek oraz , np.:
siarczany() berylowców słabo rozpuszczają się w wodzie, a ich rozpuszczalność maleje w miarę wzrostu liczby atomowej berylowca. Dla przykładu, rozpuszczalność siarczanu() baru jest tak niska, że powstawanie tej soli wykorzystuje się jako bardzo czułą reakcję strąceniową, mającą na celu oznaczanie stężenia jonów baru w roztworze:
Berylowce tworzą także związki chemiczne z wodorem, czyli wodorki. Wodorki berylowców to zwykle białe ciała stałe. Wodorki berylu i magnezu są kowalencyjne, a wodorki wapnia, strontu i baru to wodorki typu soli. Wodorki wapnia i magnezu można otrzymać w wyniku bezpośredniej syntezy z pierwiastków w odpowiednich warunkach ciśnienia i temperatury:
Wodorek wapnia łatwo reaguje z wodą:
Reakcja ta służy do otrzymywania wodoru.
Zmiany właściwości berylowców związane ze wzrostem liczby atomowej
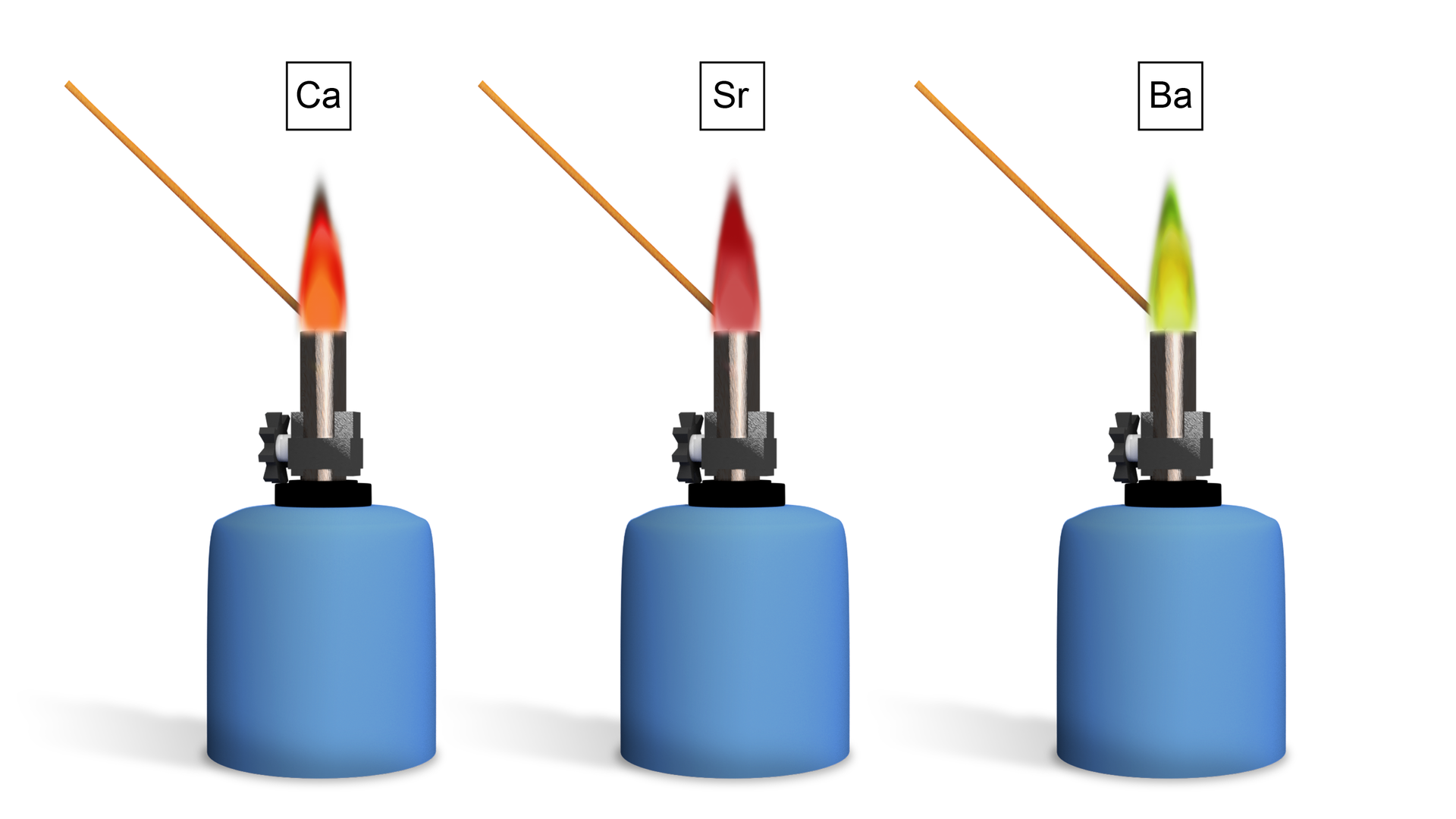
Sole berylowców wprowadzone do płomienia palnika barwią go w charakterystyczny sposób
Podczas wprowadzenia roztworu soli berylowców do płomienia następuje wzbudzenie atomuwzbudzenie atomu metalu, co skutkuje zabarwieniem się płomienia na odpowiedni kolor. Tą metodę wykorzystuje się do analizy kationów.
Słownik
(łac. metallum, gr. métallon „kopalnia”, „kruszec”) substancje odznaczające się dobrym przewodnictwem elektrycznym i cieplnym, charakterystycznym połyskiem, dużą wytrzymałością mechaniczną oraz plastycznością
(gr. ḗlektron „bursztyn”, lýsis „rozłożenie”) podstawowy proces elektrochemiczny polegający na chemicznej przemianie składników elektrolitu (często i materiału elektrod), przebiegającej na elektrodach pod wpływem przepływu prądu elektrycznego
atom, którego elektrony znajdują się na wyższych poziomach energetycznych niż w stanie podstawowym; przeskokowi elektronów na niższe poziomy energetyczne, podczas powracania atomu do stanu podstawowego, towarzyszy emisja kwantów promieniowania elektromagnetycznego (światła, promieniowania rentgenowskiego)
(gr. amphóteros „dwustronny”) właściwość niektórych związków chemicznych i jonów, polegająca na wykazywaniu przez nie zarówno kwasowego, jak i zasadowego charakteru
Bibliografia
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia: Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko–Biała .