Przeczytaj
Charakterystyka metali bloku d
Metale bloku d występują w przyrodzie w postaci minerałów, jak tlenki lub sole, np. chromit – tlenek żelaza i chromu , kobaltyn – siarczek kobaltu i arsenu , garnieryt – chemiczny (zasadowy krzemian magnezu i niklu).
Niektóre z nich – miedź, złoto oraz platyna spotykane są w stanie wolnym w niewielkich ilościach. Wszystkie naturalnie występujące metale bloku d są w temperaturze pokojowej ciałami stałymi – wyjątkiem jest rtęć Hg. Wszystkie wykazują typowe dla metali właściwości, takie jak: przewodnictwo elektryczne, cieplne, ciągliwość, kowalność. Mają połysk metaliczny i są szare, oprócz miedzi i złota, które wyróżniają się barwą. Z wyjątkiem mało aktywnych metali szlachetnychmetali szlachetnych, reagują z tlenem po ogrzaniu. Niektóre z nich pod działaniem powietrza ulegają korozji, np. żelazo. Z kwasami metale te reagują różnie (w zależności od metalu i kwasu). Aktywniejsze wypierają wodór z kwasów, tworząc sole, mniej aktywne reagują tylko z kwasami silnie utleniającymi.

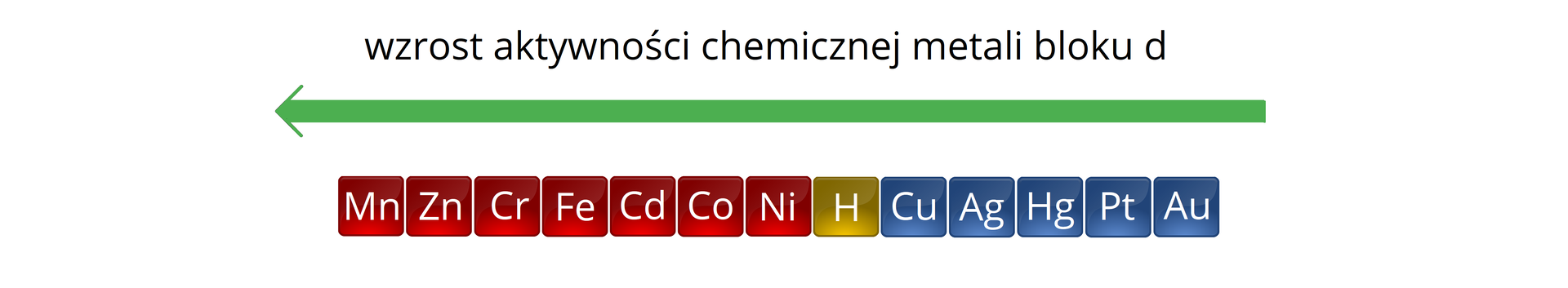
Wybierz z szeregu napięciowego tylko metale przejściowe oraz wodór i utwórz z nich szereg aktywności metali bloku d.
Z wymienionych poniżej pierwiastków wybierz wszystkie metale bloku d.
- kobalt
- nikiel
- żelazo
- ołów
- rtęć
- cynk
- sód
- wodór
- argon
- krzem
- bor
Atomy i cząsteczki wykazują właściwości paramagnetyczne, gdy posiadają chociaż jeden niesparowany elektron. Substancje te ulegają namagnesowaniu w polu magnetycznym. W niektórych substancjach niesparowane elektrony atomów, sąsiadujących ze sobą w polu magnetycznym, mogą zmieniać orientację na zgodną i tworzą się wtedy obszary, tzw. domeny, w których wszystkie atomy posiadają zgodny spinspin. Co najważniejsze, spiny te pozostają uporządkowane po usunięciu pola magnetycznego i efekt magnetyczny jest trwały. Efekt ten nazywany jest ferromagnetyzmemferromagnetyzmem.
To właśnie do bloku d należą 3 pierwiastki, które mają właściwości ferromagnetyczne - nikiel, żelazo i kobalt. Pierwiastki te stosowane są do wytwarzania magnesów trwałych oraz przy produkcji taśm i dysków magnetycznych.
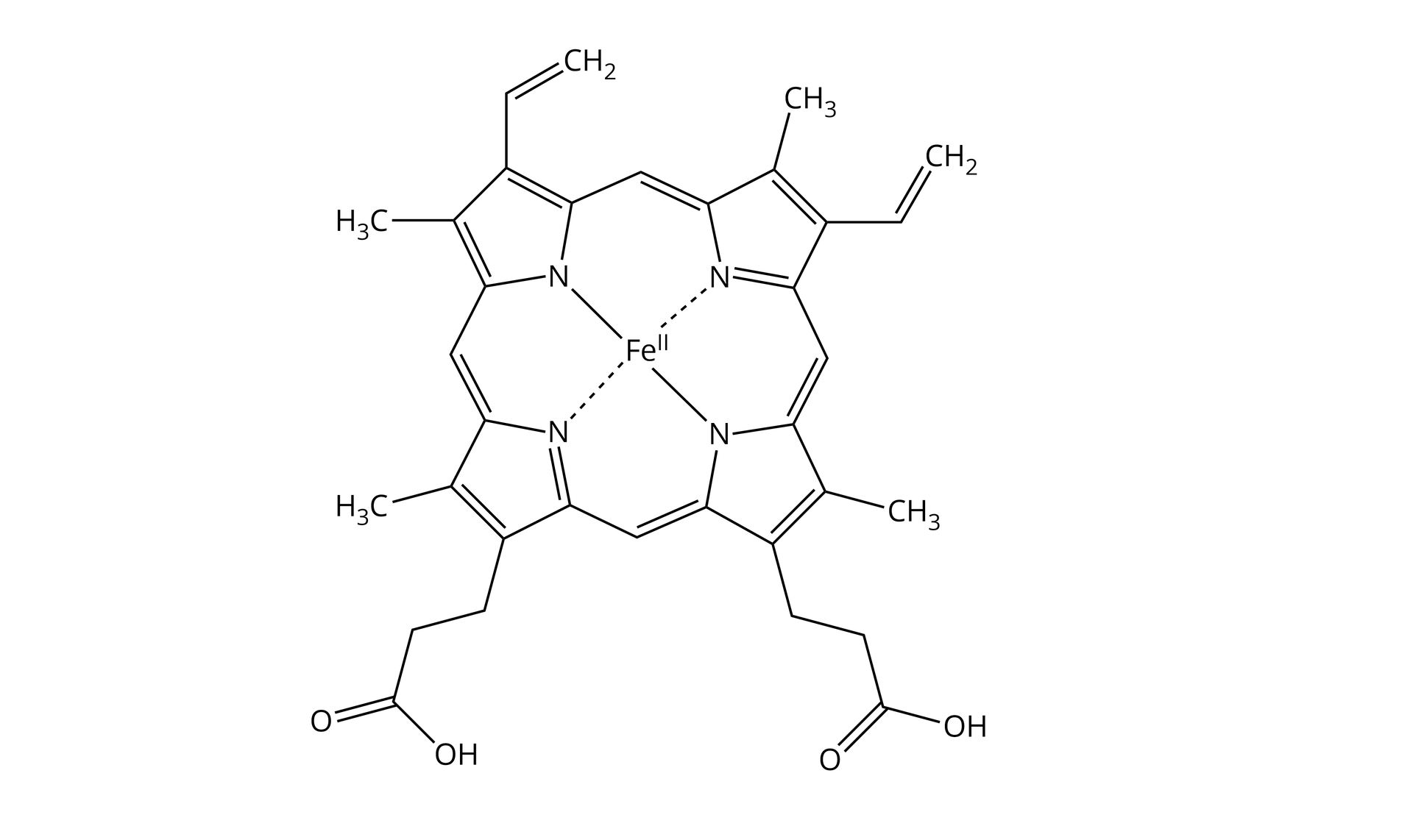
Jony metali bloku d mogą tworzyć związki kompleksowe (nazywane także związkami koordynacyjnymi). Kompleks metalu z bloku d składa się z atomu lub jonu centralnego oraz związanych z nim kilku cząsteczek lub jonów, tzw. ligandów. Ligandy wiążą się z atomem centralnym wiązaniem donorowo‑akceptorowym, w którym ligand jest donorem pary elektronowej. Liczba wiązań utworzonych między atomem lub jonem centralnym a ligandami nosi nazwę liczby koordynacyjnej.
Kompleksowymi związkami metali z bloku d są hemoglobina i witamina B12.
Słownik
(łac. ferrum „żelazo”, magneticus „magnetyczny”) zespół zjawisk związanych z równoległym uporządkowaniem momentów magnet., atomów lub jonów
zwyczajowa nazwa odpornych chemicznie metali, tj. iryd i platyna, srebro i złoto
cecha elektronu, dzięki której emituje on własne pole magnetyczne
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004, s. 969‑1011.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002, s. 280‑360.
Kałuża B., Kamińska F., Chemia. Podręcznik. Część 1. Zakres rozszerzony, Warszawa 2013, s. 362‑292.