Przeczytaj
Węglowodory
Na świecie znanych jest już ponad 10 000 000 związków organicznych. Najprostszymi z nich są węglowodory, których skład jakościowy jest bardzo prosty. Cząsteczki węglowodorów zbudowane są wyłącznie z atomów węgla i wodoru. Dzięki prostej budowie oraz dzięki temu, że atomy węgla łączą się ze sobą bezpośrednio, mogą tworzyć tysiące różnych związków. Łańcuchy te mogą być proste (bez rozgałęzień), rozgałęzione lub mogą zamykać się w pierścienie. Istnieje więc wiele różnych grup (rodzin) węglowodorów.
Pomiędzy atomami węgla może również występować krotność wiązaniakrotność wiązania. Pod tym stwierdzeniem będziemy rozumieć wiązania pojedyncze, podwójne, potrójne, a nawet ich wielokrotność. Należy pamiętać, że w węglowodorach wiązania pojedyncze są wiązaniem typu sigma, natomiast wiązania podwójne i potrójne są wiązaniami typu sigma i pi ( 1 sigma 1 pi, 1 sigma 2 pi).
Poniżej przedstawiono kilkanaście różnych wzorów strukturalnych węglowodorów.
Przyporządkuj podane węglowodory do odpowiednich grup, przeciągając ich nazwy w przypisane pola.
antracen, oktyn, cyklookten, benzen, cyklopropan, metan, heksan, cyklopropen, etyn, buten, cyklobutan, cykloheksa-1,3-dien, eten, dekan, buta-1,3-dien, cykloheksen, propyn, penta-1,2-dien, okten, cyklopentan
| alkany | |
|---|---|
| alkeny | |
| alkeny | |
| cykloalkany | |
| cykloalkeny | |
| aromatyczne |
Liczba opisanych dotąd związków organicznych przekroczyła już 10 mln i rocznie zwiększa się o ok. 100‑200 tysięcy. Ta ich mnogość wynika ze zdolności atomów węgla do tworzenia wiązań zarówno między własnymi atomami, jak i atomami większości innych pierwiastków chemicznych. Prowadzi to do powstawania cząsteczek o dowolnie dużej liczbie atomów, powiązanych ze sobą w łańcuchy i/lub pierścienie, różniące się między sobą (w przypadku takiego samego składu ilościowego i jakościowego) dodatkowo kolejnością wiązań oraz geometrycznym i/lub przestrzennym ułożeniem atomów w cząsteczce. To powoduje, że mimo anachronizmu podziału na chemię organiczną i nieorganiczną – nadal jest on stosowany.
Podział węglowodorów
Węglowodory są związkami organicznymi, w których – jak wskazuje nazwa – występują atomy węgla i wodoru. Atomy węgla są czterowartościowe i są wysycone atomami wodoru.
Węglowodory możemy podzielić w zależności od:
sposobu połączenia się ze sobą atomów węgla (budowa szkieletu, topologię łańcucha). Wówczas dzielimy je na łańcuchowe i pierścieniowe. Węglowodory łańcuchowe nazywany również alifatycznymialifatycznymi, a węglowodory pierścieniowe cyklicznymicyklicznymi.
od typu i liczby wiązań między atomami węgla w cząsteczce (krotność wiązań), wśród węglowodorów łańcuchowych wyróżniamy węglowodory nasycone (alkanyalkany) i nienasycone (alkenyalkeny i alkinyalkiny). Zaś wśród węglowodorów pierścieniowych możemy wyróżnić węglowodory cykloalifatyczne (np. cykloalkany, cykloalkeny) oraz aromatycznearomatyczne (pierścieniowe z układem aromatycznym).
Węglowodory nasycone to te, które w swoich cząsteczkach posiadają jedynie wiązania pojedyncze.
Węglowodory nienasycone to z kolei te, które w swoich cząsteczkach posiadają wiązania wielokrotne. Może być jedno wiązanie lub kilka.
Węglowodory platońskie
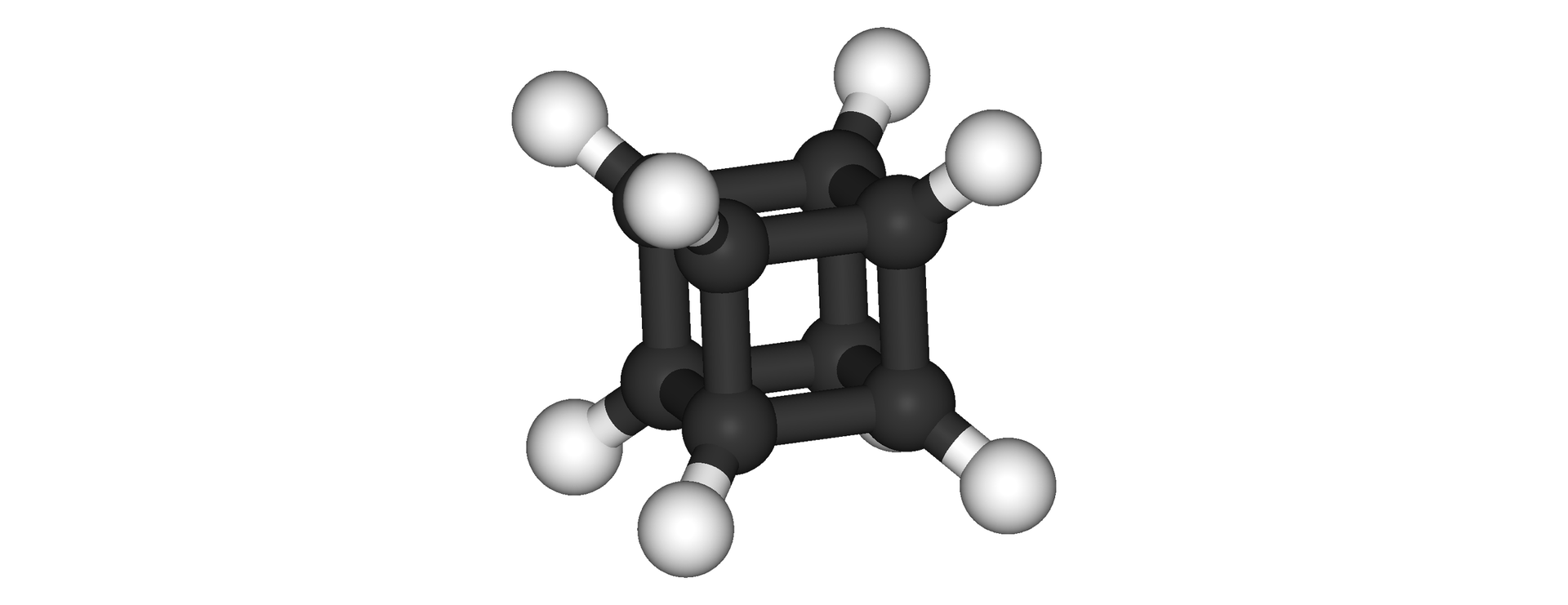
Jednym z rodzajów są wielościany foremneforemne, zwane inaczej bryłami platońskimi. Cieszyły się zainteresowaniem wielu myślicieli i filozofów, w tym także Platona i jego ucznia Teajtetosa. Są to: tetraedr, heksaedr, oktaedr, dodekaedr, ikosaedr.
Właśnie w oparciu o te bryły próbowano syntetyzować związki chemiczne, których wierzchołkami są rozmieszczone atomy węgla - węglowodory platońskiewęglowodory platońskie. Stało się to możliwe m. in. z uwagi na rozwój metod syntezy cząsteczek organicznych, fizykochemicznych metod badania struktury cząsteczek, jak również metod teoretycznych, które pozwalają na ocenę możliwości istnienia trwałych, hipotetycznych cząsteczek. Najbardziej znanym węglowodorem platońskim jest kuban, a innymi: tetraedran (dokładniej jego pochodne) i dodekaedran.
Słownik
(łac. parum affinis „mało powinowaty”) – nasycone związki organiczne zbudowane z węgla i wodoru o wzorze ogólnym Indeks dolny +2, Indeks dolny koniec+2, posiadają w swojej strukturze wyłącznie wiązania pojedyncze
nienasycone związki organiczne zbudowane z węgla i wodoru o wzorze ogólnym , posiadają w swojej strukturze wiązanie podwójne
nienasycone związki organiczne zbudowane z węgla i wodoru o wzorze ogólnym CIndeks dolny nnHIndeks dolny 2n‑2, Indeks dolny koniec2n‑2, posiadają w swojej strukturze wiązanie potrójne
pojęcie, które ma na celu określić, czy występujące w cząsteczce związku chemicznego wiązanie jest pojedyncze, podwójne czy potrójne
(węglowodory łańcuchowe) węglowodory o atomach węgla połączonych w otwarte łańcuchy (proste lub rozgałęzione)
(węglowodory pierścieniowe) węglowodory o atomach węgla połączonych w pierścienie (jeden lub więcej)
(areny) węglowodory cykliczne (pierścieniowe) z układem aromatycznym; w tych węglowodorach obecne są sprzężone wiązania wielokrotne (naprzemiennie pojedyncze i podwójne)
bryła przestrzenna będąca wielościanem, w którym wszystkie ściany są przystającymi wielokątami foremnymi, a we wszystkich jego wierzchołkach zbiega się jednakowa liczba ścian
węglowodory, które posiadają wiązania pojedyncze; ich szkielet oparty jest na niektórych wielościanach platońskich (tetraedr, heksaedr, dodekaedr)
Bibliografia
Atkins P., Jones L. Chemia ogólna. Cząsteczki, materia, reakcje, Warszawa 2004.
Mastalerz P., Podręcznik chemii organicznej, 1998.
McMurry J., Chemia organiczna, tom 1‑2, Warszawa 2000.
Morrison R. T., Boyd R. N., Chemia organiczna, tom 1‑2, Warszawa 1997.