Przeczytaj
Czy litowce reagują z tlenem?
Litowce bardzo łatwo wchodzą w reakcje z pierwiastkami chętnymi do przyjmowania elektronów, czyli niemetalami, w tym oczywiście z tlenem. Czy można to łatwo wytłumaczyć, analizując budowę atomów tych pierwiastków, a w szczególności powłoki walencyjnej? Weźmy pod uwagę konfiguracje elektronowe atomów w stanie podstawowym:
Elektron walencyjny litu, sodu i pozostałych litowców leży na podpowłoce (gdzie oznacza numer okresu). Oddanie jednego elektronu przez atom litowca prowadzi do uzyskania trwałej konfiguracji elektronowej gazu szlachetnego, poprzedzającego litowiec w układzie okresowym. Proces ten jest więc korzystny energetycznie. W wyniku oddania elektronu tworzą się kationy litowców, w których występują one na formalnym stopniu utlenienia.
Wszystkie litowce są tak bardzo aktywne, że w obecności powietrza szybko pokrywają się cienkimi warstwami tlenków i wodorotlenków. Litowce, wystawione na działanie powietrza, mogą reagować wybuchowo. To wszystko sprawia, że przechowuje się je w warunkach niedostępności powietrza. Naprzykład sód i potas przechowuje się w nafcie, a lit w naczyniach wypełnionych gazem biernym (np. argonem).
Tlenki | Nadtlenki | Ponadtlenki |
|---|---|---|
np. | np. | np. |
Reakcje spalania litowców
W reakcjach z tlenem tylko lit tworzy tlenkitlenki.
Pozostałe litowce tworzą mieszaninę tlenków , nadtlenkównadtlenków i ponadtlenkówponadtlenków . W danych warunkach jeden z tych związków z tlenem jest dominujący. Wraz ze wzrostem liczby atomowej rośnie tendencja tworzenia nadtlenków i ponadtlenków. Na przykład:
Aktywność litowców rośnie wraz ze wzrostem masy atomowej. Potas jest bardziej aktywny niż sód. Rubid i cez są tak aktywne, że w powietrzu mogą ulec samozapłonowi, dlatego przechowuje się je w zatopionych szklanych ampułkach.
Reakcje tlenków litowców
Schemat doświadczenia – reakcja tlenku sodu lub potasu z wodą w obecności fenoloftaleiny
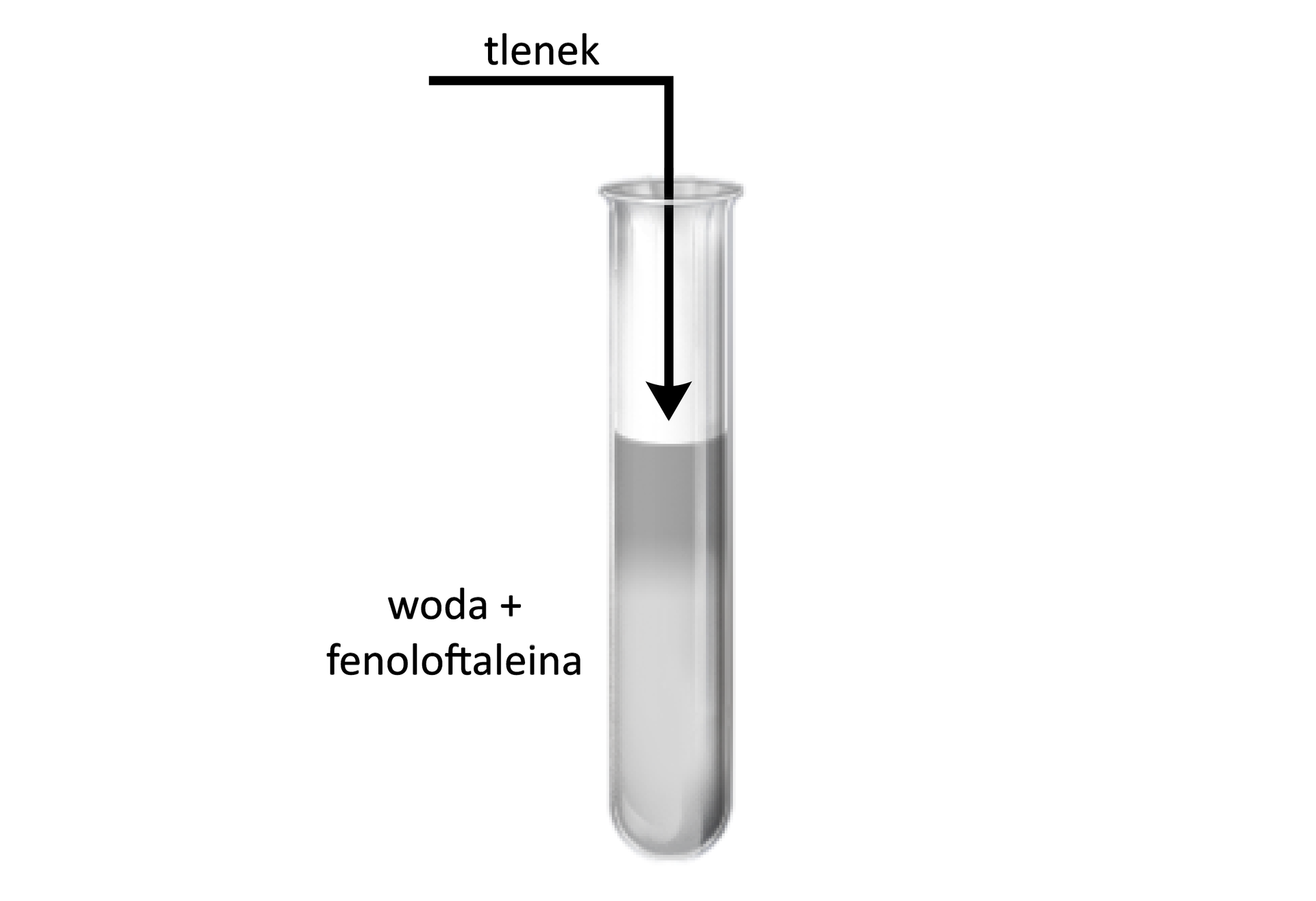
Obserwacje:
Pojawia się malinowa barwa roztworu z fenoloftaleiną.
Wnioski:
Zabarwienie roztworu fenoloftaleiny świadczy o obecności jonów w produktach reakcji. Oznacza to, że w reakcji tlenków litowców z wodą powstają wodorotlenki, np.:
Słownik
związki tlenu z innymi pierwiastkami, w których atom tlenu występuje na stopniu utlenienia
związki chemiczne, zawierające grupę nadtlenkową , w której tlen występuje na stopniu utlenienia
związki tlenu, w których tlen występuje w postaci anionu
polega na gwałtownym łączeniu się tlenu z różnymi substancjami. Wszystkim reakcjom spalania w tlenie towarzyszy wydzielenie się ciepła i światła, jednak aby zapoczątkować spalanie, konieczne jest dostarczenie energii
Bibliografia
Atkins P., Jones L., Chemia ogólna, Warszawa 2004.
Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1, Warszawa 2002, s. 210‑240.
Trzebiatowski W., Chemia nieorganiczna, Warszawa 1977, s. 363‑388.




