Przeczytaj
Teoria kompleksu aktywnego
Dziedzina chemii, jaką jest teoria kompleksu aktywnego, to kinetyka chemiczna. Jest to duży dział chemii fizycznej, zajmujący się analizowaniem przebiegu reakcji chemicznych, ich szybkościszybkości i zachodzących mechanizmówmechanizmów. Z punktu widzenia teoretycznego, ma fundamentalne znaczenie w badaniu przebiegu reakcji chemicznych i ich mechanizmów. Natomiast z praktycznego punktu widzenia jest nieodzowny do projektowania przebiegu reakcji chemicznych na skalę laboratoryjną i przemysłową. Zagadnieniem tłumaczącym, w jaki sposób zachodzi reakcja chemiczna, jest teoria zderzeń. Mówi ona, iż indywidua chemiczne mogą reagować ze sobą, jeśli ulegną zderzeniu z odpowiednio wysoką energią (równą lub wyższą od energii aktywacji dla tego procesu). Takie zderzenie nazywa się zderzeniem efektywnymzderzeniem efektywnym, a energia, jaką mają wówczas substraty, nazywa się energią aktywacjienergią aktywacji. W trakcie zderzenia efektywnego powstaje kompleks aktywnykompleks aktywny , który jest stanem przejściowym pomiędzy substratami a produktem.
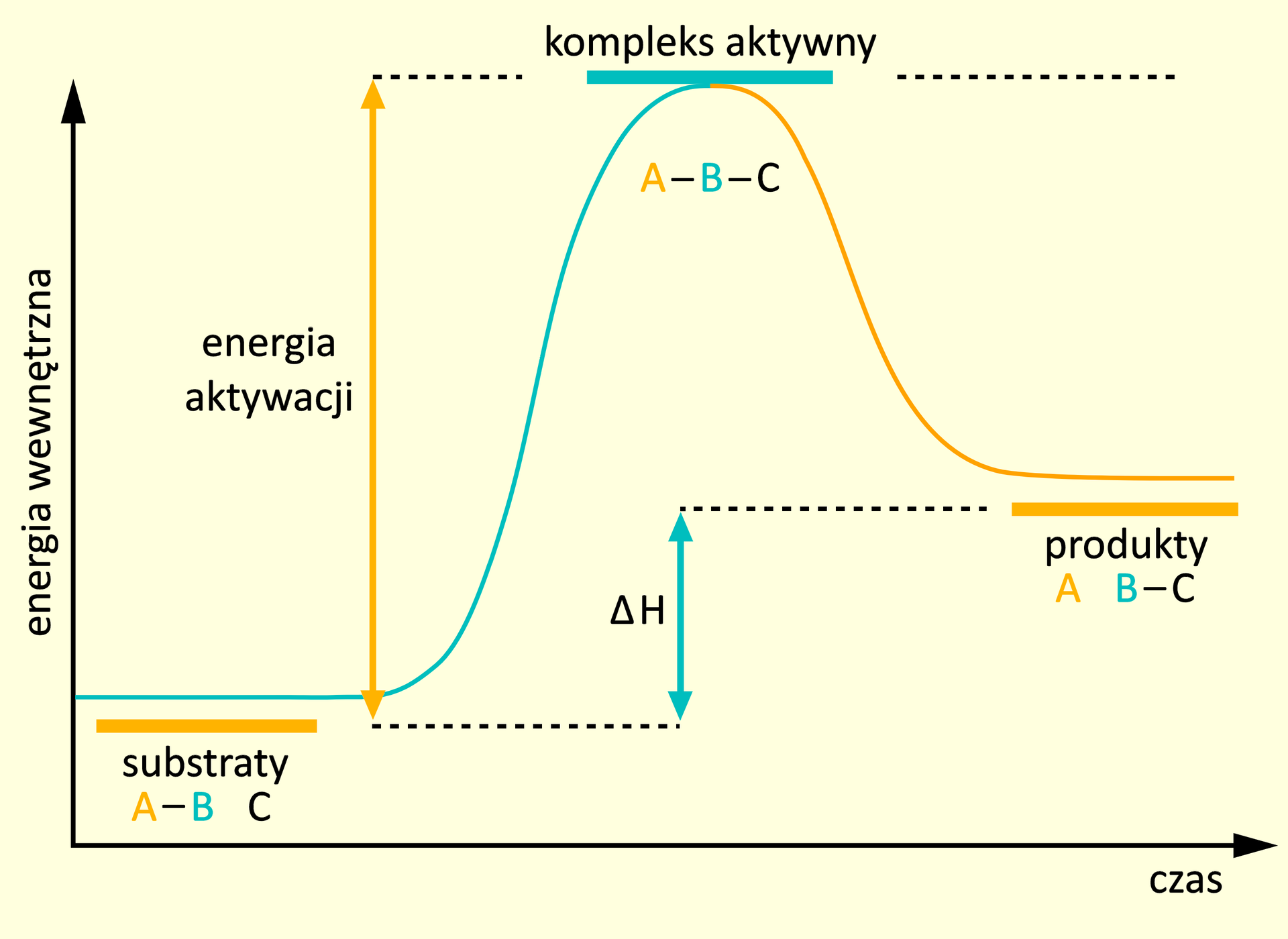
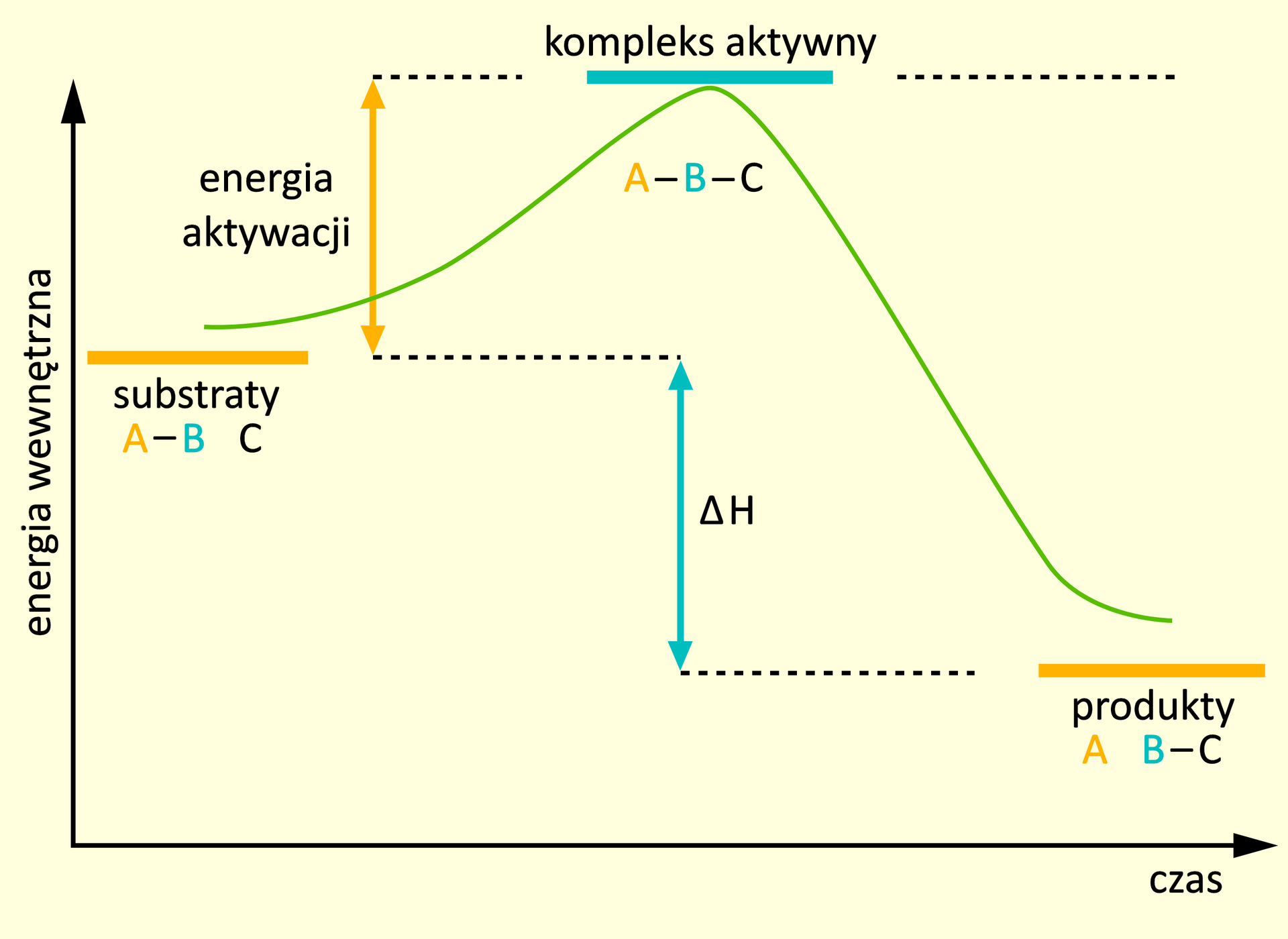
Zmiany energii wewnętrznej w czasie dla reakcji endotermicznej i egzotermicznej przedstawia poniższa galeria wykresów.
Utworzenie kompleksu aktywnego decyduje o powodzeniu danej reakcji chemicznej. Ten stan przejściowy charakteryzuje się częściowymi zmianami wiązań i przegrupowaniami. Zrywanie wiązań w substratach i tworzenie nowych w produktach odbywa się równocześnie. Energia kompleksu aktywnego jest wyższa od sumy energii swobodnych substratów. Zatem szybkość reakcji chemicznej może być wyrażona jako iloczyn stałej szybkości rozpadu kompleksu aktywnego i jego stężenia. Osiągnięcie poziomu energii aktywacji przez substraty jest konieczne do ich przereagowania, a pokonanie „bariery energetycznej”, wynikającej z energii aktywacji, jest możliwe poprzez:
zwiększenie stężeń substratów;
rozdrobnienie substratów;
zmianę ciśnienia (dla gazów);
mieszanie;
użycie odpowiedniego rozpuszczalnika;
zastosowanie wyższej temperatury;
dodanie katalizatorakatalizatora.
Należy jednak pamiętać, że do utworzenia kompleksu aktywnego odpowiednio wysoka energia nie wystarczy. Potrzebne jest również zderzenie względem siebie indywiduów chemicznych o odpowiedniej orientacji. Stan przejściowy, jakim jest kompleks aktywny, nie oznacza stuprocentowej pewności, co do utworzenia produktów. Jest bowiem możliwe, że ulegnie on rozpadowi na powrót do substratów.
Teoria kompleksu aktywnego pozwala zrozumieć istotę energii aktywacji. Jej postulaty związane są z postulatami teorii zderzeń, uzupełnionych nowymi informacjami.
1. W wyniku zderzenia efektywnego drobin może zostać utworzony kompleks aktywny, który jest nietrwałym stanem, zbudowanym z jąder i elektronów, zderzających się drobin substratów.
Wszystkie zderzenia efektywne przebiegają przez stan pośredni, trwający około 10Indeks górny -13-13 sekundy. Przykładowo, dla reakcji:
powstaje kompleks aktywny w postaci :
Dla reakcji otrzymywania jodowodoru (HI) schemat reakcji, przechodzący przez stadium pośrednie‑kompleks aktywny, wygląda następująco:
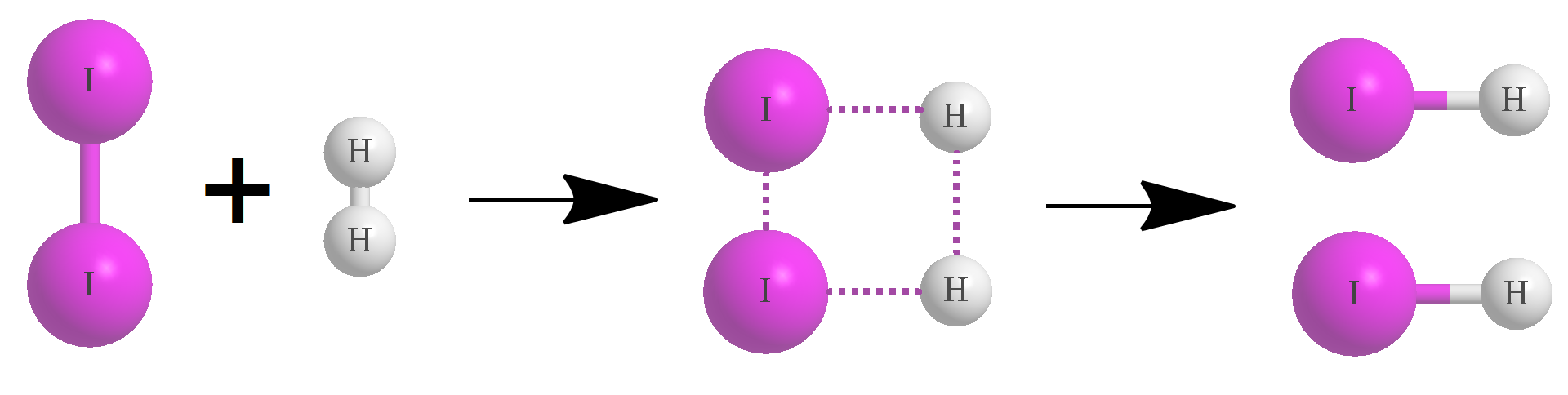
Reakcja syntezy jodowodoru:
cząsteczki przed zderzeniem;
kompleks aktywny;
cząsteczki produktu (kreski przerywane oznaczają tworzenie się nowych wiązań – te wiązania nie są trwałe, jednolite kreski oznaczają wiązania trwałe).
W momencie tworzenia kompleksu aktywnego, nie następuje całkowite rozerwanie wiązań w cząsteczkach substratów. W kompleksie aktywnym nadal istnieją stare wiązania (które są osłabione) i nowe wiązania (które nie są jeszcze trwałe).
2. Szybkość reakcji jest zależna od stężenia kompleksu aktywnego oraz szybkości, z jaką rozpada się na produkty.
Zgodnie z teorią kompleksu aktywnego i teorią zderzeń, szybkość reakcji zależy od czynników, tj.:
temperatury;
stężenia reagentów;
stosowania rozpuszczalników;
katalizatorów/inhibitorówinhibitorów:
mieszania;
rozdrabniania;
ciśnienia (dla gazów).
Katalizator jest substancją, która ułatwia przeprowadzenie reakcji chemicznej. Łączy się z substratami i tworzy zmodyfikowany kompleks aktywny, do którego utworzenia jest potrzebna znacznie mniejsza energia niż tworzenie kompleksu aktywnego między samymi substratami. Zatem katalizator obniża energię aktywacji danej reakcji chemicznej.
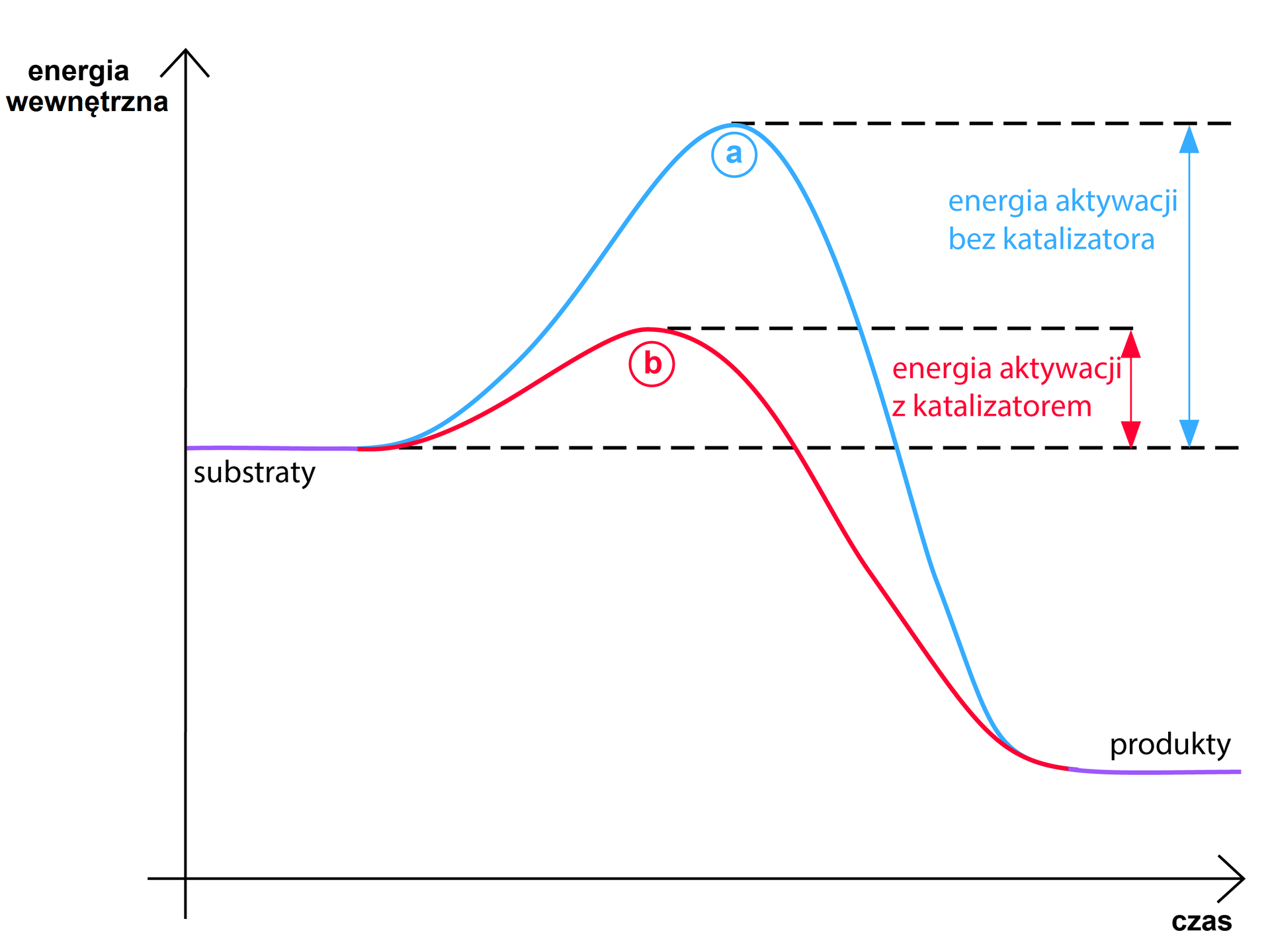
Po zakończeniu reakcji, katalizator całkowicie się odtwarza, a więc jego ilość jest taka sama zarówno na początku, jak i po zakończeniu reakcji. Zjawisko przyspieszenia reakcji chemicznej przez katalizator nazywa się katalizą. Czasami działanie katalizatora skutkuje ciągiem kilku reakcji z jego udziałem, wówczas energia aktywacji ulega zmianie na dwie lub więcej mniejszych energii aktywacji.
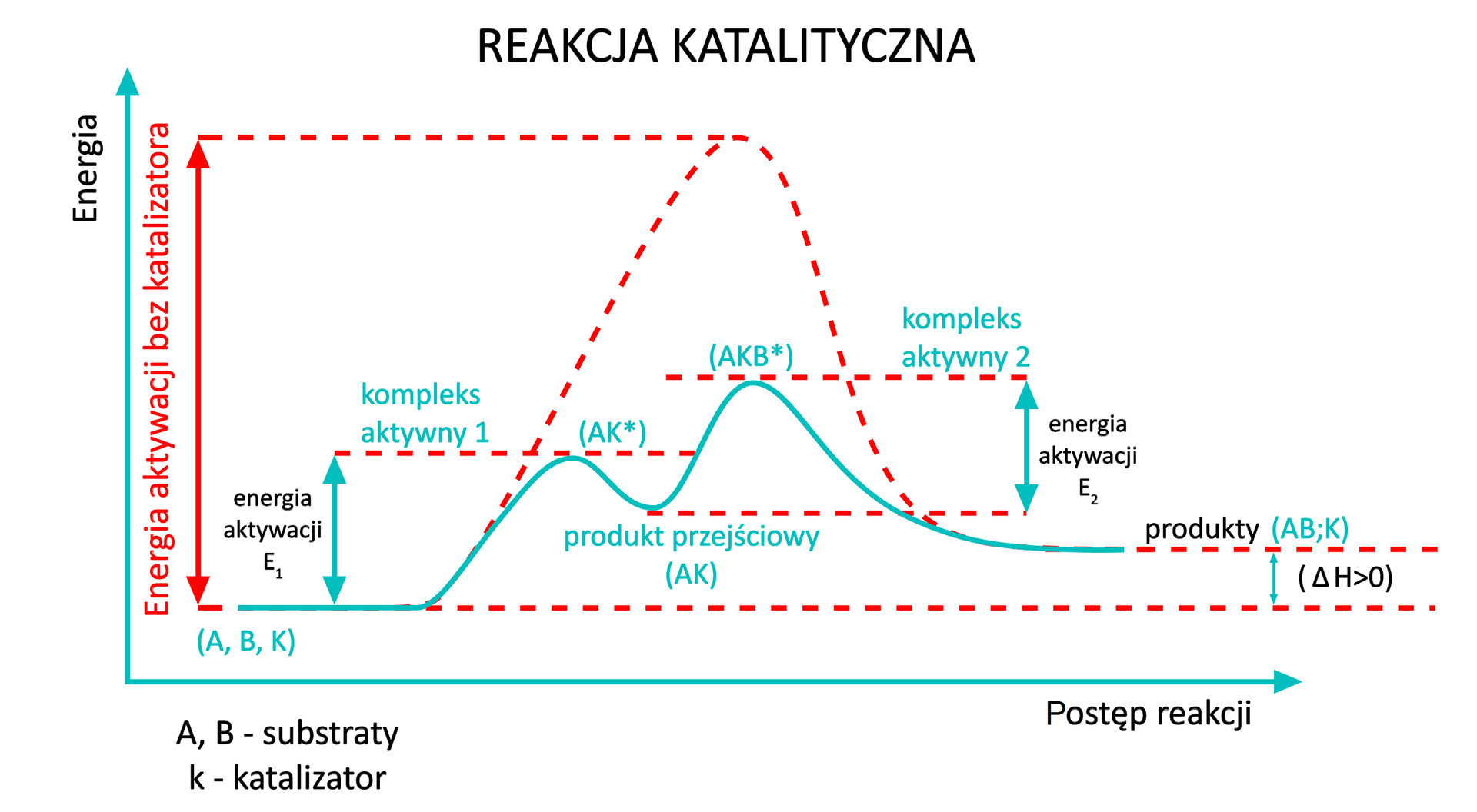
Przeciwieństwem katalizatorów są inhibitory. Stosuje się je do reakcji przebiegających zbyt gwałtownie, aby zwolnić ich przebieg i uzyskać nad nimi kontrolę. Zarówno katalizatory, jak i inhibitory mogą być homogeniczne, czyli będące w takiej samej fazie, co substraty, oraz heterogeniczne, które są w innej fazie niż substraty.
Inhibitory znajdują zastosowanie w wielu gałęziach przemysłu. Istnieją takie, których funkcje wykorzystuje się do zahamowania korozji. Nieco odmiennymi inhibitorami są inhibitory wolnowiążąceinhibitory wolnowiążące, które znajdują zastosowanie w przemyśle spożywczym, rolnictwie oraz medycynie. Ciekawym przykładem ich zastosowania są reakcje katalizowane przez tyrozynazę, które powodują brązowienie owoców, warzyw i napojów. Inhibitory pozwalają zachować dłuższą świeżość i tym samym jakość dla tych produktów.
Słownik
(gr. katálysis „rozwiązanie”) jest to substancja chemiczna, której dodatek do reakcji powoduje przyśpieszenie reakcji chemicznej. Po zakończeniu reakcji, jest w całości odzyskiwana. Wyróżniamy katalizatory homogeniczne, czyli będące w takiej samej fazie, co substraty, oraz heterogeniczne, które są w innej fazie niż substraty
(łac. inhibere „zatrzymywać”) jest to substancja chemiczna, której dodatek do reakcji powoduje spowolnienie lub zatrzymanie reakcji chemicznej. Po zakończeniu reakcji, jest w całości odzyskiwana. Wyróżniamy inhibitory homogeniczne, czyli będące w takiej samej fazie, co substraty, oraz heterogeniczne, które są w innej fazie niż substraty
(łac. inhibere „zatrzymywać”) rodzaj inhibitora cechującego się niższym powinowactwem do substratu lub kompleksu aktywnego, przez co równowaga wiązania enzymu z inhibitorem osiągana jest z mniejszą szybkością niż w procesie dyfuzji; charakteryzuje go wzrost siły hamującej w czasie.
energia, która wynika z ruchów i oddziaływań cząsteczek oraz zawartych w nich elektronów i jąder
reakcja chemiczna, która przebiega z wydzieleniem energii z układu reakcyjnego do otoczenia
reakcja chemiczna, która przebiega z pochłanianiem energii z otoczenia do układu reakcyjnego
zderzenie następujące z dostatecznie dużą energią i właściwą orientacją przestrzenną, aby mógł powstać kompleks aktywny
najmniejsza ilość energii, jaką muszą pobrać cząsteczki substratów do utworzenia kompleksu aktywnego
układ jąder i elektronów powstający wskutek zderzenia cząsteczek substratów, stanowiący stan przejściowy, przez który przebiega reakcja chemiczna na drodze od substratów do produktów i podczas którego reakcja osiąga maksymalną energię
opis dokładnego przebiegu reakcji chemicznej, wskazujący na produkty pośrednie powstające w trakcie reakcji
wyraża się jako zmianę stężenia molowego substratów lub produktów w jednostce czasu. Nie jest to wielkość stała, ponieważ zmienia się w czasie przebiegu reakcji; największa jest na początku reakcji, a najmniejsza pod koniec reakcji
Bibliografia
Bełtowska‑Brzezinska M., Podstawy kinetyki chemicznej – skrypt do wykładów, Poznań 2009.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.
Pawełczak M., Hurek J., Inhibicja enzymatyczna wolnowiążąca, „Chemik” 2014, t. 68, nr 4, s. 377–384.
Energia w reakcjach chemicznych, online: http://www.mlyniec.gda.pl/~chemia/ogolna/reakcje/reakcje_energia.html, dostęp: 10.05.2022.
Kinetyka i równowaga reakcji chemicznej, online: http://analizalekow.wum.edu.pl/sites/analizalekow.wum.edu.pl/files/wyklad_3_kinetyka_i_rownowaga.pdf, dostęp: 10.05.2022.