Przeczytaj
Czym są wskaźniki pH?
Do określenia pH najczęściej używane są indykatoryindykatory (wskaźniki) pH. Głównie to słabe kwasy lub słabe zasady organiczne, które w wyniku zmiany stężeń jonów i zmieniają swoją formę, co w konsekwencji skutkuje zmianą zabarwienia roztworu. Przykładowo, w przypadku wskaźnika pH, będącego słabym kwasem organicznym, może ustalać się następująca równowaga:
Gdzie:
– wskaźnik w postaci kwasu;
– sprzężona z nim zasada.
Forma nadaje inną barwę roztworowi niż forma . Stąd, w wyniku zajścia przedstawionej reakcji, zmienia się barwa roztworu.
Jakie są najpopularniejsze wskaźniki?
Wskaźnik uniwersalny jest to mieszanina różnych wskaźników, która zmienia barwę w skali pH od do . Nasączone wskaźnikiem uniwersalnym papierki nazywane są uniwersalnymi papierkami wskaźnikowymi.

Fenoloftaleina jest to wskaźnik dla roztworów o odczynie zasadowym. Przyjmuje intensywne zabarwienie koloru malinowego w roztworach zasadowych w pH od do . Powyżej tego pH jej malinowe zabarwienie stopniowo zanika. W środowisku kwasowym lub obojętnym jest bezbarwna. W przypadku bardzo niskiego pH (poniżej ) przyjmuje pomarańczowe zabarwienie.

Oranż metylowy jest to wskaźnik dla roztworów o odczynie mocno kwasowym.

Naturalne wskaźniki pH
Wskaźnikami pochodzenia naturalnego są np.: sok z czerwonej kapusty, wywar z buraka, borówki, napar z czarnej herbaty czy kwiat kalafioru fioletowego. Nie są one jednak powszechnie używane, ze względu na swoją krótką trwałość.
Za zmianę barwy wywaru z czerwonej kapusty odpowiadają antocyjany. Są to związki organiczne o złożonej budowie.
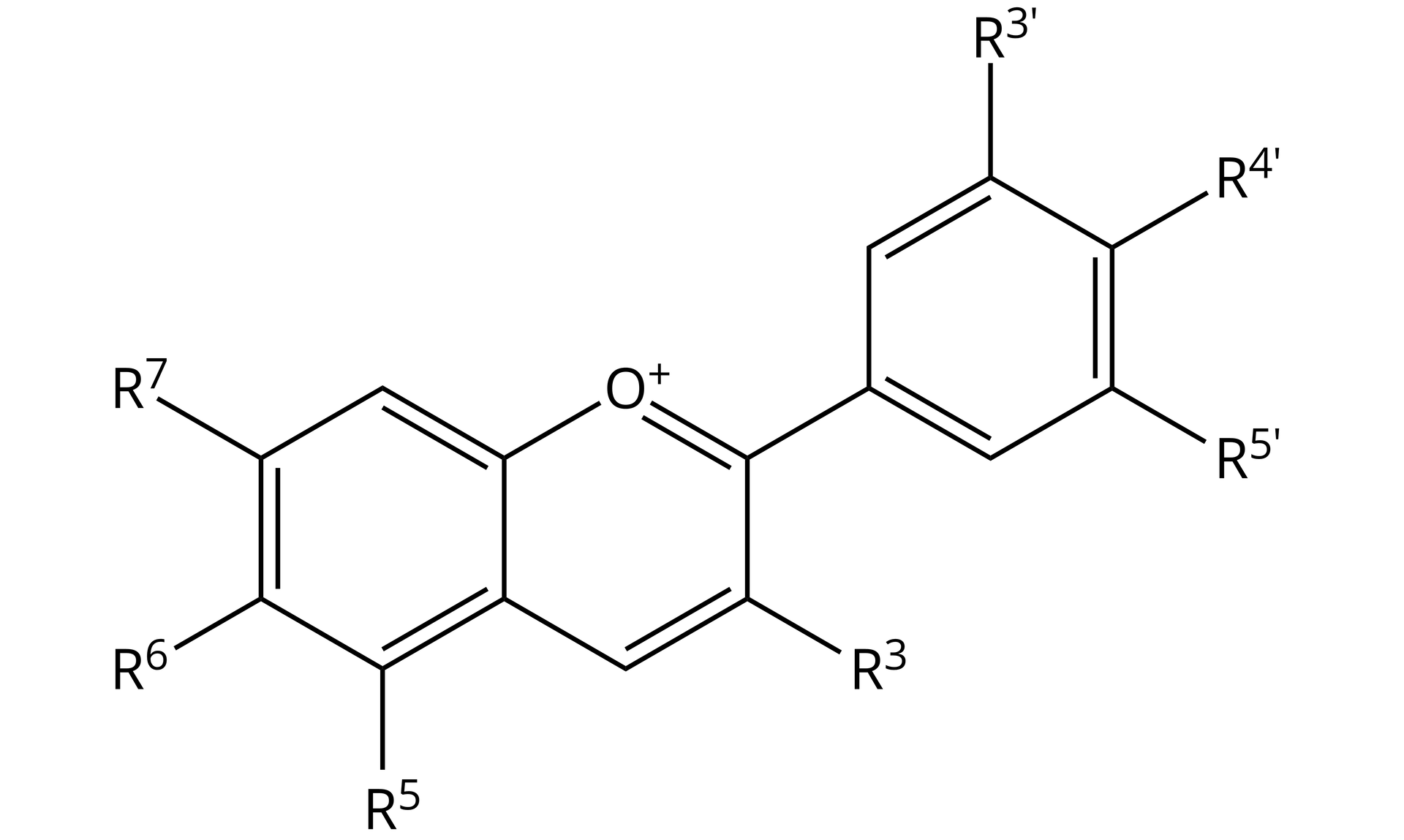
W trakcie zmiany pH, w antocyjanach zachodzą złożone reakcje chemiczne. Ze względu na złożoną budowę cząsteczek antocyjanów, wywar z czerwonej kapusty jest wskaźnikiem działającym w szerokim zakresie pH. Jednakże powyżej pewnej wartości zachodzi reakcja, która dezaktywuje wskaźnik i nie pozwala na jego dalsze działanie.
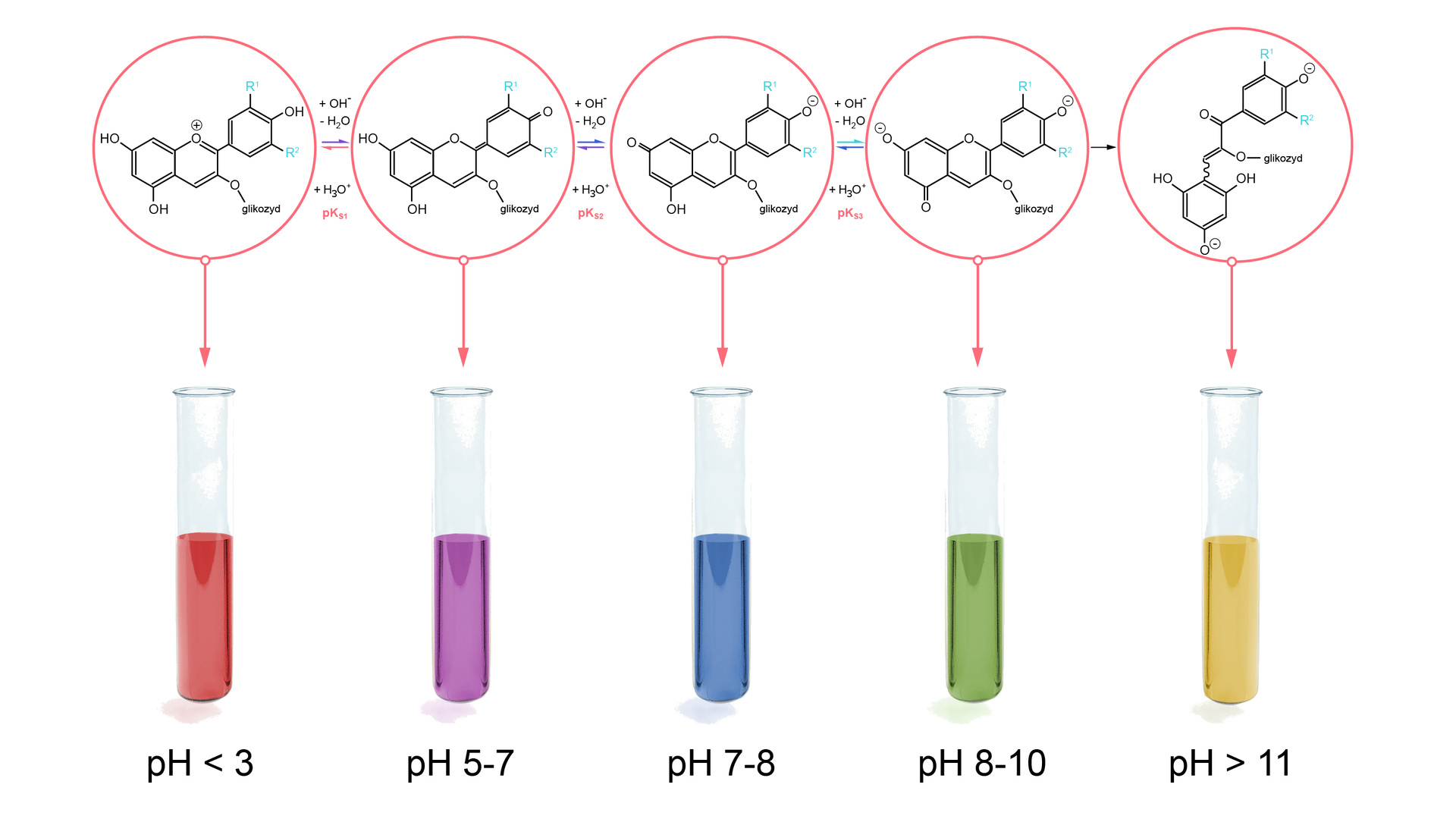
Inne metody oznaczania pH
Powyższe wskaźniki nie są dostatecznie precyzyjne, aby określić pH z dużą dokładnością. W celu określenia pH z dużą dokładnością, używa się pH‑metru lub metod analitycznych. Urządzenie, jakim jest pH‑metrpH‑metr, pozwala na precyzyjne określenie pH roztworu. Składa się on z elektrody oraz miernika. W rzeczywistości jest to pomiar siły elektromotorycznej (SEM)siły elektromotorycznej (SEM), na podstawie której określany jest potencjał elektrochemiczny. Metody elektrochemiczne należą do jednych z najbardziej precyzyjnych metod pomiarowych. W trakcie pomiaru układ musi być termostatowanytermostatowany. Oznacza to, że temperatura podczas pomiaru jest stała. Miernik sam przelicza SEM na pH na podstawie wzoru:
Gdzie:
– zmierzona SEM ogniwa;
– potencjał elektrody wzorcowej;
– stała gazowa;
– temperatura ;
– stała Faradaya.
W laboratorium chemicznym wykonywano analizę ilościowąanalizę ilościową pewnej substancji. W tym celu przygotowano zestaw do analizy, składający się z: biurety, pipety jednomiarowej, naciągarki oraz kilku kolb Erlenmeyera. Po zakończeniu oznaczania na stole laboratoryjnym pozostały trzy nieopisane kolby z bezbarwnymi roztworami, a po wskaźniku uniwersalnym pusta butelka. Do dyspozycji uczniowie mieli: pH‑metr, alkoholowy roztwór fenoloftaleiny oraz wodny roztwór oranżu metylowego, statyw oraz probówki.
Z każdej kolby pobrano po znajdującego się w nich roztworu, a każdy z pobranych roztworów umieszczono w osobnych probówkach. Do każdej z nich dodano po kilka kropel alkoholowego roztworu fenoloftaleiny oraz zapisano obserwacje. Powtórzono procedurę dla wodnego roztworu oranżu metylowego. Następnie zawartość każdej kolby została zbadana przy pomocy pH‑metru. Wyniki eksperymentu zanotowano.
Wiedząc, że w czasie analizy wykonywane było miareczkowanie alkacymetrycznemiareczkowanie alkacymetryczne, postaraj się określić zawartość poszczególnych kolb.
Kolba | Fenoloftaleina | Oranż metylowy | pH‑metr |
brak zmian | brak zmian | ||
kolor zmienia się na | brak zmian | ||
brak zmian | kolor zmienia się na |
Słownik
chem. substancja, która w określonych warunkach wykazuje wyraźną zmianę właściwości, najczęściej zmianę lub pojawienie się zabarwienia, fluorescencji, chemoluminescencji i in., co pozwala na stwierdzenie odczynu badanego roztworu albo obecności określonego jonu lub cząsteczki
przyrząd służący do wyznaczania wartości pH
utrzymywanie układu w stałej temperaturze
pojawia się w procesie zamiany innego rodzaju energii w energię elektryczną (np. energii chemicznej w ogniwach galwanicznych)
sposób postępowania w analizie miareczkowej, polegający na dodawaniu (małymi porcjami) mianowanego roztworu do roztworu substancji oznaczanej
podczas tego typu miareczkowania mianowane roztwory kwasu lub zasady wprowadza się do analizowanej próbki w takiej ilości, aby osiągnąć moment, w którym liczba moli dodanego odczynnika jest stechiometrycznie równoważna liczbie moli oznaczanego składnika w roztworze miareczkowanym
dział analizy chemicznej, obejmujący metody określania składu ilościowego substancji
Bibliografia
Encyklopedia PWN
Bayer E., Komplexbildung und Blütenfarben, Angew. Chem. 1966, t. 78, s. 18‑19, 834‑841.
Minczewski J., Marczenko Z., Chemia analityczna. T.2. Chemiczne metody analizy ilościowej, Warszawa 2011, wyd. 10.