Przeczytaj
Podczas rozpuszczania w wodzie, część elektrolitów ulega całkowitemu rozpadowi na jony, a część jest zdysocjowana tylko w niewielkim stopniu. Naukowcy zaobserwowali to pośrednio wykonując proste doświadczenia. Zauważyli, m.in. że roztwory elektrolitów:
w zróżnicowany sposób zabarwiają wskaźniki ,
cechują się różnymi wartości , które wskazywane są przez pehametr,
odmiennie przewodzą prąd powodując intensywniejsze albo słabsze świecenie żarówki.
Mocne i słabe elektrolity
Wyniki te stanowiły podstawę do klasyfikacji elektrolitów na mocneelektrolitów na mocne i słabei słabe. Elektrolity mocne to te, które cechuje praktycznie całkowita dysocjacja. Z kolei elektrolity słabe charakteryzuje obecność w roztworze zarówno jonów, jak i dużej ilości cząsteczek niezdysocjowanych.
Świat nauki oprócz jakościowych wyników, wymaga precyzyjnych ilościowych danych pomiarowych umożliwiających obiektywne porównywanie mocy elektrolitówmocy elektrolitów. W tym celu zostały zaproponowane dwa parametry m.in. stała dysocjacji ()stała dysocjacji () oraz stopień dysocjacji ()stopień dysocjacji (), uzyskane w wyniku prowadzonych doświadczeń w określonych warunkach termicznych.
Porównanie dwóch parametrów: stopnia i stałej dysocjacji w układzie mocny i słaby elektrolit
Na rysunku znajdują się dwie zlewki, w których znajdują się roztwory kwasu chlorowodorowego i kwasu fluorowodorowego o stężeniach . W pierwszej zlewce możesz zauważyć, że znajdujący się w niej kwas chlorowodorowy całkowicie zdysocjował na jony – jest to tzw. elektrolit mocny. W drugiej zlewce znajdujący się w niej kwas fluorowodorowy zdysocjował częściowo – w roztworze obecne są jony i cząsteczki niezdysocjowane – jest to słaby elektrolit.
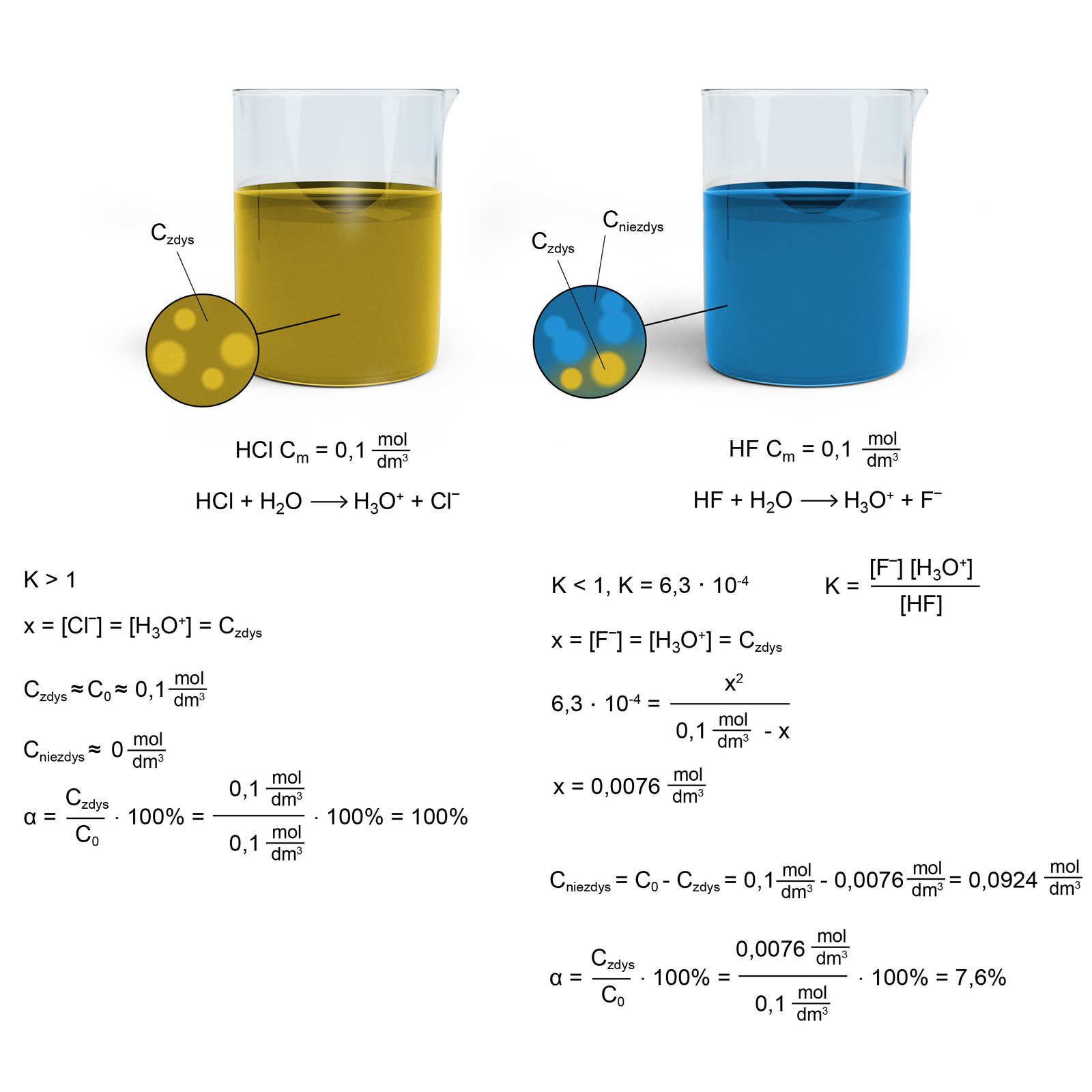
Objaśnienia:
– stężenie początkowe - – stężenie drobin zdysocjowanych (jonów)
– stężenie drobin niezdysocjowanych
– stopień dysocjacji
– stała dysocjacji
W przypadku mocnego elektrolitu, którego stopień dysocjacji jest bliski liczba niezdysocjowanych drobin jest niezauważalnie mała, dlatego stężenie jest bliskie .
W przypadku słabego elektrolitu, którego stopień dysocjacji jest mniejszy od , stężenie niezdysocjowanych drobin wynosi:
W związku z niskim stopniem dysocjacji wartość stężenia równowagowego jonów oksoniowych jest bliska :
Analiza rysunku w połączeniu ze wzorami na stopień i stałą dysocjacji wskazuje, że:
Stopień dysocjacji () lepiej charakteryzuje mocne elektrolity, gdyż dotyczy stężenia drobin zdysocjowanych (których jest więcej w mocnych elektrolitach) do stężenia początkowego elektrolitu.
Stopień dysocjacji () zależy od stężenia początkowego elektrolitu i zmienia się wraz z jego zmianą (rośnie, gdy stężenie początkowe maleje i vice versa).
Stała dysocjacji () lepiej charakteryzuje elektrolity słabe, gdyż dotyczy stosunku stężenia drobin zdysocjowanych () do stężenia drobin niezdysocjowanych, których stężenie w słabych elektrolitach z założenia jest równe stężeniu początkowemu elektrolitu ().
Stała dysocjacji () nie zależy od stężenia początkowego elektrolitu, dlatego jest lepszym wskaźnikiem do oceny mocy elektrolitów, głównie słabych.
Z uwagi na powyższe wnioski, zwłaszcza punkt , w dalszych rozważaniach dotyczących mocy elektrolitów skoncentrowano się głównie na wartościach dotyczących stałej dysocjacji.
Zapewne zastanawiasz się, gdzie możesz odnaleźć wartości stałych dysocjacji i jak są one oznaczane?
Znajdują się one np. w tablicach fizykochemicznych i oznaczane są one literą . Często w indeksie dolnym przy literze pojawiają się dodatkowe oznaczenia, np. , , , , ... Co one oznaczają? Stała dysocjacji może dotyczyć roztworów kwasów (ang. acids) stąd pojawia się litera „a” w indeksie przy , bądź roztworów zasad (ang. bases) stąd litera „b” w indeksie . Z kolei cyfry pojawiające się po literach wskazują na etap dysocjacji, jeżeli mamy do czynienia z elektrolitem dysocjującym wielostopniowo, np. oznacza wartość stałej dysocjacji kwasowej dla pierwszego etapu dysocjacji, a oznacza wartość stałej dysocjacji kwasowej dla drugiego etapu dysocjacji.
Wartości stałych dysocjacji
Poniżej przedstawiono wartości stałych dysocjacji dla wybranych elektrolitów w temperaturze (lub w innej, co zaznaczono przy wartościach stałych w tabeli). Jak widać stała dysocjacji zależy od warunków termicznych, dlatego ważne jest zaznaczenie temperatury pomiaru. Umożliwia to śledzenie zmian wartości stałej dysocjacji danego elektrolitu w różnych warunkach termicznych, bądź porównanie wartości stałej dysocjacji danego elektrolitu z innym elektrolitem przy założeniu tych samych warunków termicznych, w celu określenia, który z nich jest mocniejszy.
Kwas nieorganiczny | Stała dysocjacji lub |
|---|---|
Kwas organiczny | Stała dysocjacji |
|---|---|
() | |
() |
Zasada | Stała dysocjacji |
|---|---|
Indeks górny /Źródło: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010. J. Sawicka, A. Janich–Kilian, W. Cejner–Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001/ Indeks górny koniec/Źródło: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010. J. Sawicka, A. Janich–Kilian, W. Cejner–Mania, G. Urbańczyk, Tablice chemiczne, Gdańsk 2001/
Kwas nieorganiczny | |||
|---|---|---|---|
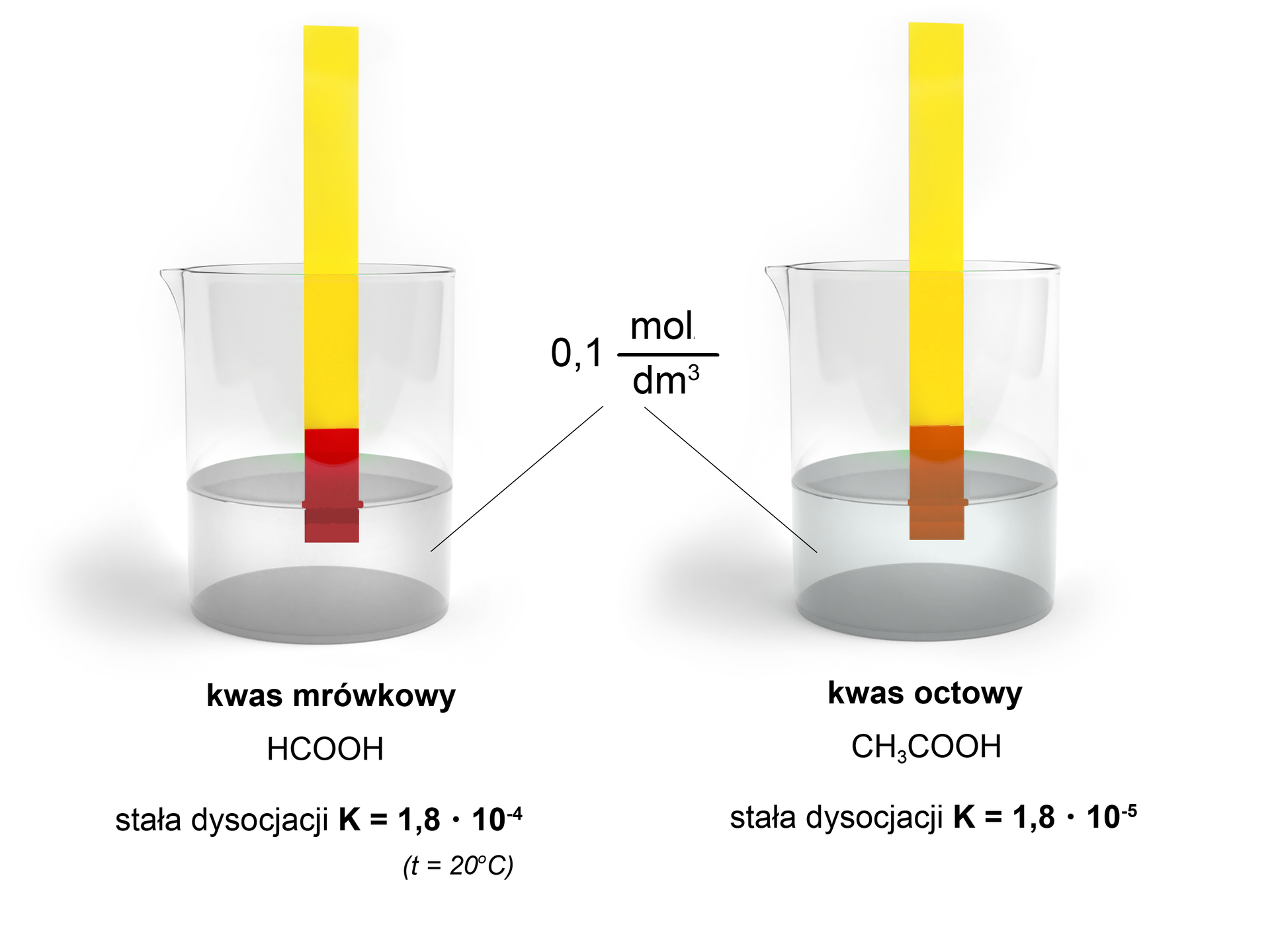
Wniosek: Kwas mrówkowy jest kwasem mocniejszym od kwasu octowego.
Umiejętność określania, który elektrolit jest mocniejszy, a który słabszy jest przydatna w planowaniu bądź interpretowaniu wyników doświadczeń. Elektrolit mocniejszy wypiera elektrolit słabszy z roztworu, powodując, że dana reakcja zachodzi.
Słownik
część materii o budowie cząsteczkowej bądź jonowej
roztwory wodne substancji ulegających dysocjacji elektrolitycznej, czyli rozpadowi na jony. Są to wodne roztwory kwasów, wodorotlenków i soli, które przewodzą prąd elektryczny
roztwór, który charakteryzuje niecałkowita dysocjacja zawartych w nim cząsteczek lub struktur jonowych. W roztworze występują zarówno drobiny zdysocjowane (jony), jak i drobiny niezdysocjowane
roztwór, który cechuje praktycznie całkowita dysocjacja zawartych w nim drobin
parametr określający, jaka część ogólnej liczby rozpuszczonych drobin elektrolitu uległa rozpadowi na jony
parametr określający stosunek iloczynu stężeń jonów do stężenia drobin niezdysocjowanych w danej temperaturze
Bibliografia
Atkins P., Jones L., Chemia ogólna. Cząstki, materia, reakcje, Wydawnictwo Naukowe PWN, Warszawa, 2018.
Encyklopedia PWN
online: https://pl.wikipedia.org/wiki/PH-metr (dostęp: 12.08.2021).
online: https://www.mt.com/dam/Analytical/pH-LabMeters/me-pdf/five/30266890_Operating_Instructions_pH_Bench_F20_FP20_PL.pdf (dostęp: 12.08.2021).