Przeczytaj
Chrom – charakterystyka
Chrom jest pierwiastkiem chemicznym, należącym do metali bloku . Posiada 6 elektronów walencyjnych i charakteryzuje się następującą konfiguracją elektronową, zapisaną z użyciem rdzenia gazu szlachetnego: . Jego liczba masowa i atomowa wynoszą odpowiednio 51,9961 i 24, dlatego też liczba jego protonów i elektronów równa jest 24. Charakteryzuje się temperaturami wrzenia i topnienia równymi odpowiednio 2572°C oraz 1857°C. Gęstość chromu w warunkach normalnych wynosi 7,14 . Charakterystyczne stopnie utlenienia chromu to +VI, +III, +II. Chrom posiada 25 izotopów znajdujących się w zakresie od do , z których jego naturalne izotopy to , , , a najliczniej występującym izotopem tego pierwiastka jest ( 83,789%).

Występowanie w przyrodzie
Chrom występuje w przyrodzie wyłącznie w postaci związków chemicznych. Poniżej przedstawiono zdjęcia przykładowych minerałów, których składnikiem jest chrom.
Odkrywcy nazwali jedną z rud chromu krokoitem (), z greckiego krokoeis (szafranowy), który wyglądem przypomina szafran.

Otrzymywanie chromu
Metoda aluminotermiczna
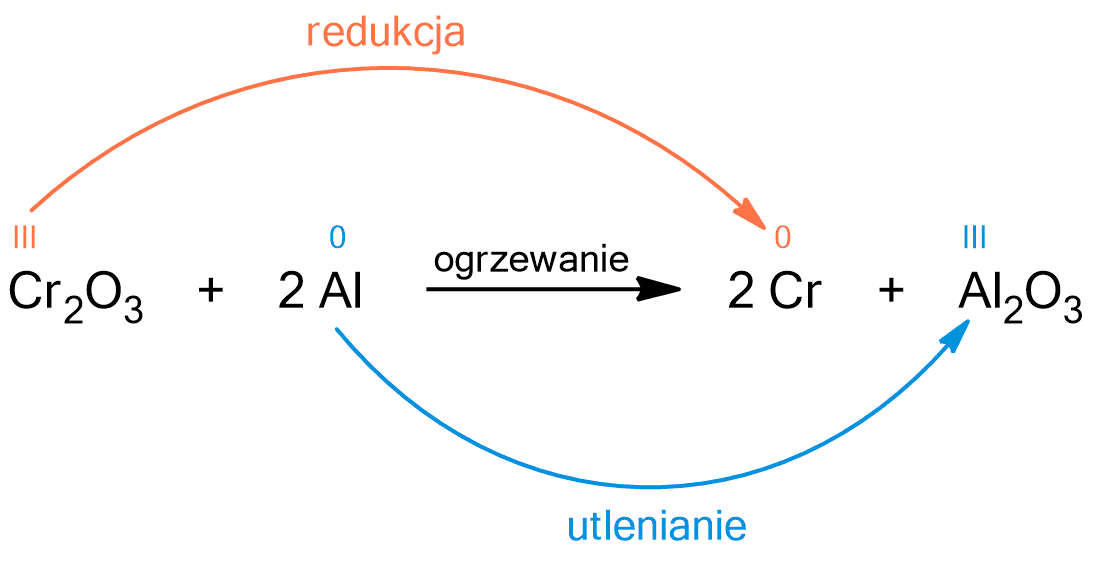
Metoda ta polega na reakcji redukcji tlenku chromu(III) z wykorzystaniem sproszkowanego glinu. Poniższa reakcja, w ostatnim etapie, jest również wykorzystywana w metodzie przemysłowej.

Metoda przemysłowa
Metoda ta polega na przerobieniu rudy chromitowej w tlenek chromu(III), a następnie zredukowaniu go przy pomocy glinu. Poniżej zostały przedstawione równania reakcji, które zachodzą podczas stosowania tej metody.
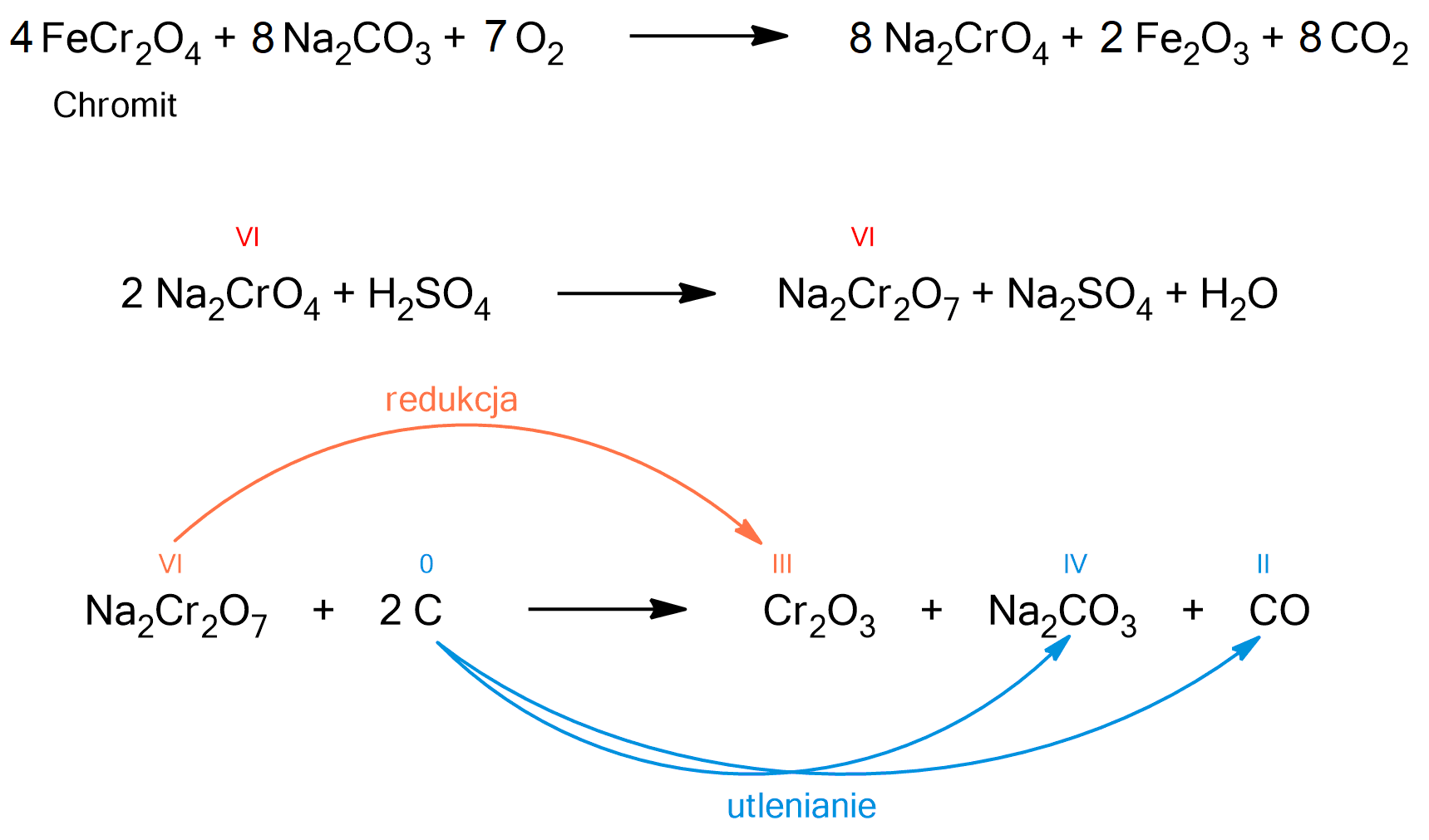
Powyższa reakcja jest reakcją utlenianiautleniania - redukcjiredukcji. Atom chromu w dichromianie(VI) sodu ulega redukcji, ponieważ zmniejsza swój stopień utlenianiastopień utleniania z VI na III. Atom węgla ulega utlenieniu, ponieważ zwiększa swój stopień utlenienia z 0 na II i IV.
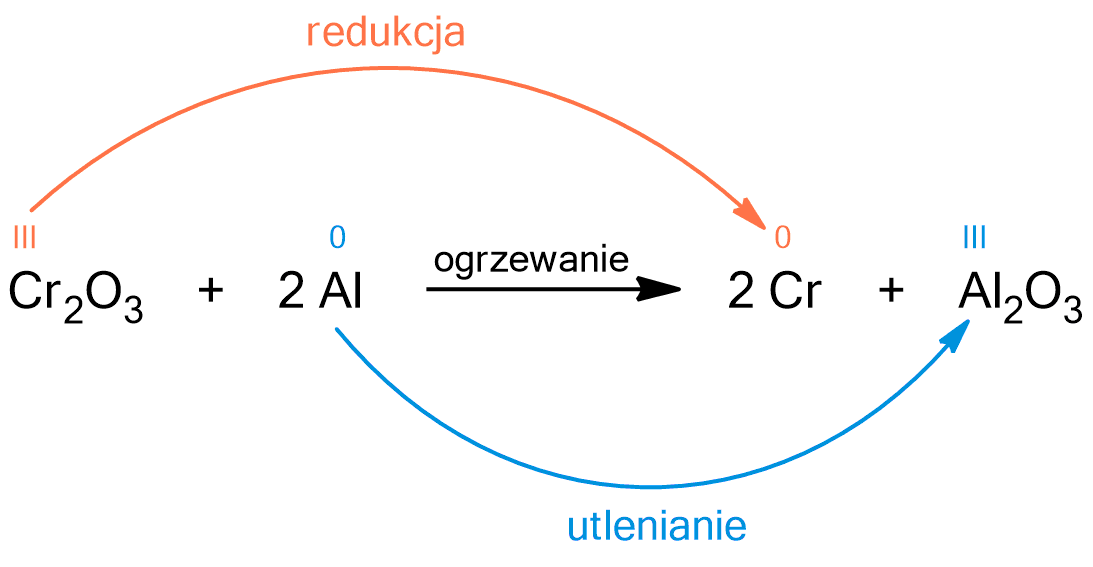
Powyższa reakcja jest reakcją utleniania – redukcji. Atom chromu w tlenku chromu(III) ulega redukcji, ponieważ zmniejsza swój stopień utleniania z III na 0. Atom glinu ulega utlenieniu, ponieważ zwiększa swój stopień utlenienia z 0 na III. Jest to przykład procesu aluminotermicznego.
Metoda elektrolitycznaelektrolityczna
Czysty chrom można otrzymać w wyniku elektrolizy wodnych roztworów soli chromu(III) w obecności kwasu siarkowego(VI). Ta metoda jest wykorzystywana w galwanotechnicegalwanotechnice.
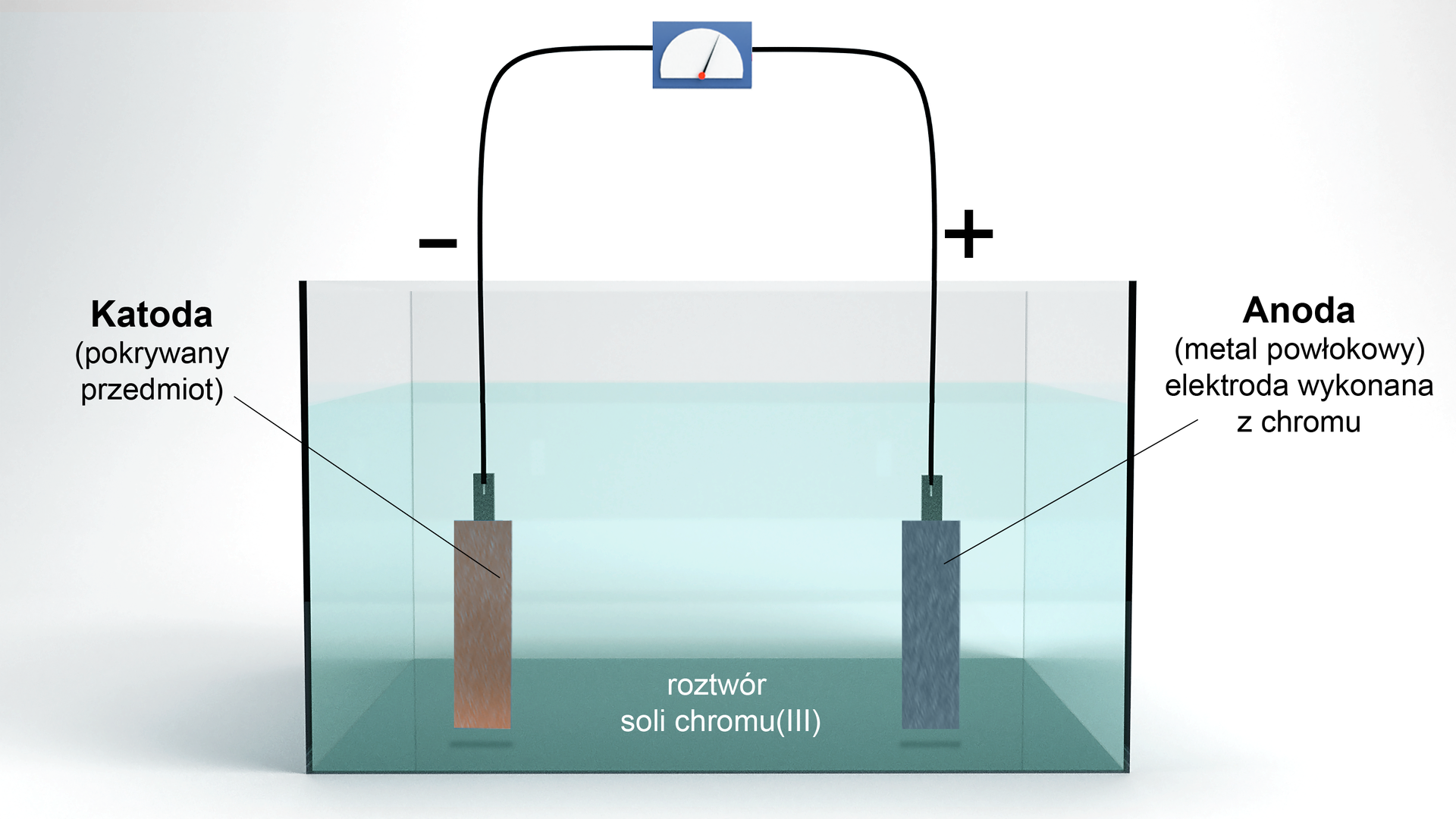
Na katodzie dochodzi do redukcji jonów obecnych w roztworze:
Powstający, metaliczny cgrom osadza się na przedmiocie galwanizowanym. Z kolei na anodzie dochodzi do reakcji przeciwnej:
Dzięki temu ubywające z roztworu, na skutek redukcji na katodzie jony , są w roztworze uzupełniane.
Metoda – otrzymywanie tzw. żelazochromu
Często wytwarza się stopstop żelaza z chromem (żelazochrom; ferrochrom), który jest wykorzystywany do produkcji m.in. stali nierdzewnej. Stal nierdzewna to stop żelaza, w którego składzie znajduje się ≥ 10,5% chromu i ≤ 1,2% węgla, który, ze względu na swoje wyjątkowe właściwości, takie jak m.in.: odporność na korozję, wygląd estetyczny, żaroodporność i inne, znalazł szerokie zastosowanie.

W celu uzyskania żelazochromu, chromit ulega reakcji redukcji z wykorzystaniem węgla, co zostało przedstawione w poniższym równaniu reakcji.
Podsumowanie
Metaliczny chrom jest pożądany, ponieważ znajduje liczne zastosowania m.in. w galwanotechnice, gdzie przedmioty wykonane z metali, ulegających szybkiej korozji, pokrywa się warstwą trwalszego metalu - np. właśnie chromu. Chrom występuje w przyrodzie w postaci minerałów, dlatego konieczne stało się opracowanie metod otrzymywania metalicznego chromu. Wśród tych metod możemy wyróżnić:
przeróbkę rud chromu, a następnie reakcje redukcji związków chromu;
metodę aluminotermiczną;
elektrolizę.
Warto podkreślić, że stopy żelaza z dodatkiem chromu są wykorzystywane masowo, stąd opracowano sposób otrzymywania takich stopów, tj. reakcja rud chromu z węglem.
Słownik
mieszanina substancji, składająca się z dwóch lub więcej pierwiastków chemicznych, z których jeden występuje w przeważającej ilości i jest metalem
reakcja podczas, której atom, jon lub cząsteczka reduktora traci elektrony. Podczas tego procesu stopień utlenienia atomu wzrasta
reakcja, podczas której atom, jon lub cząsteczka utleniacza zyskuje elektrony. Podczas tego procesu stopień utlenienia atomu maleje
pojęcie umowne, określające liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomowi pierwiastka chemicznego, wchodzącego w skład określonego związku, gdyby cząsteczki tego związku miały budowę jonową
metoda polegająca na pokrywaniu przedmiotów warstwą metalu w wyniku elektrolizy, w celu ozdobienia lub ochrony przedmiotu, np. przed korozją
(gr. ѐlektron „bursztyn”; gr. lýsis „rozpuszczenie”, „rozluźnienie”) przemiany, które zachodzą na elektrodach w sposób wymuszony pod wpływem przyłożenia zewnętrznego źródła prądu
(gr. ánodos „droga w górę”) elektroda, na której zachodzi reakcja utleniania; w elektrolizie anoda jest naładowana dodatnio
(gr. káthodos „schodzenie”) elektroda, na której zachodzi reakcja redukcji; w elektrolizie katoda jest naładowana ujemnie
Bibliografia
Bielański A., Chemia ogólna i nieorganiczna, Warszawa 1977.
Bárta M., Pierwiastki chemiczne wokół nas, Warszawa 2013.
Czerwiński A.,Czerwińska A.,Jelińska – Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik dla Liceum ogólnokształcącego, Liceum profilowanego, Technikum, Warszawa 2002.
Litwin, M., Styka – Wlazło S., Szymońska J., To jest chemia 1. Chemia ogólna i nieorganiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2018.
Sękowski S., Galwanotechnika domowa, Warszawa 1987.


