Przeczytaj
Jak zmienia się energia podczas reakcji chemicznych?
Aby reakcja chemiczna mogła zajść, cząsteczki substratów (A i B) muszą się ze sobą zderzyć. Energia kinetycznaEnergia kinetyczna, związana z ruchem cząsteczek, zaczyna się przekształcać w energię potencjalną,energię potencjalną, która wzrasta do maksymalnej wartości i prowadzi do utworzenia nietrwałego, przejściowego kompleksu aktywnegokompleksu aktywnego (ABIndeks górny **). Posiada on wyższą energię niż suma energii substratów czy suma energii produktów. Zanim substraty przekształcą się w produkty, muszą mieć energię odpowiadającą kompleksowi aktywnemu, bez względu na to, czy jest to reakcja endoreakcja endo-, czy egzoenergetyczna. Różnica między energią potencjalnej substratów a energią potencjalną kompleksu aktywnego polega na energii aktywacjienergii aktywacji (EIndeks dolny aa) reakcji. Podczas rozpadu kompleksu aktywnego wydziela się energia, która przekształca się w energię kinetyczną cząsteczek produktów (C i D). Warunkiem zajścia reakcji chemicznej jest pokonanie bariery energetycznej. Jej wysokość jest równa energii aktywacji. Różnica energii potencjalnej substratów i produktów równa jest efektowi energetycznemu reakcji. Przebieg opisanej reakcji chemicznej – reakcji egzoenergetycznejreakcji egzoenergetycznej – można przedstawić na wykresie zmian energii reakcji, co zostało przedstawione poniżej:
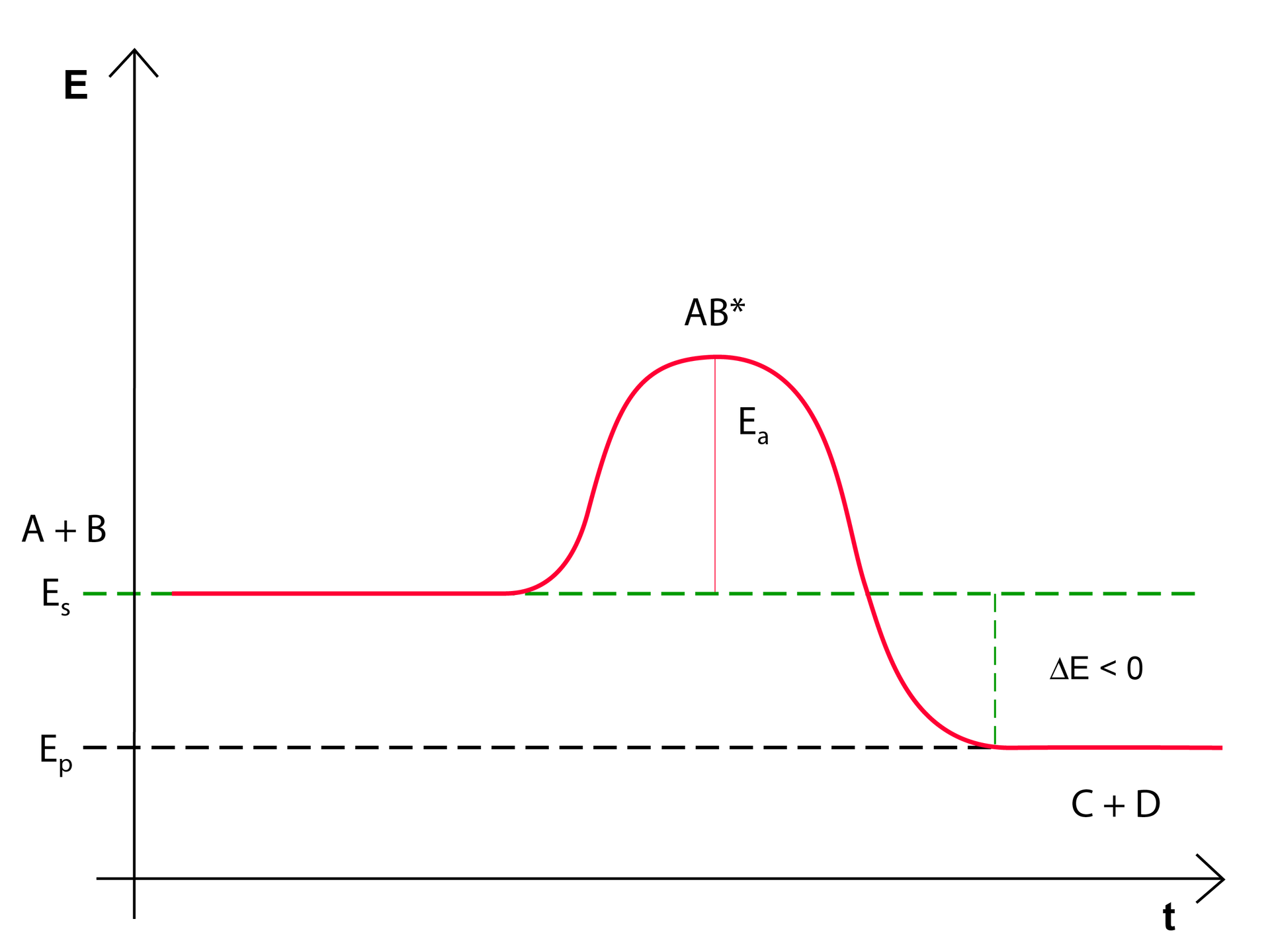
deltaE to energia, która została wydzielona przez układ, zaś EIndeks dolny aa to energia aktywacji, czyli energia potrzebna substratom do przejścia w kompleks aktywny, który jest zdolny do przemiany w produkty. Jeżeli układ wydziela energię do otoczenia, to po reakcji będzie mieć niższą energię niż przed reakcją. Jest to reakcja egzoenergetyczna, czyli reakcja o dodatnim bilansie energetycznym. Energia potencjalna produktów jest mniejsza niż energia potencjalna substratów.
W przypadku reakcji endoenergetycznych, aby reakcja mogła zostać zapoczątkowana, układ pobiera dodatkową energię z otoczenia. Energia aktywacji (EIndeks dolny aa) jest zwykle większa niż całkowita energia reakcji egzoenergetycznej. Poziom energii produktów jest większy niż poziom energii substratów. Poniżej przedstawiono wykres zmian energii układu dla reakcji endoenergetycznej:
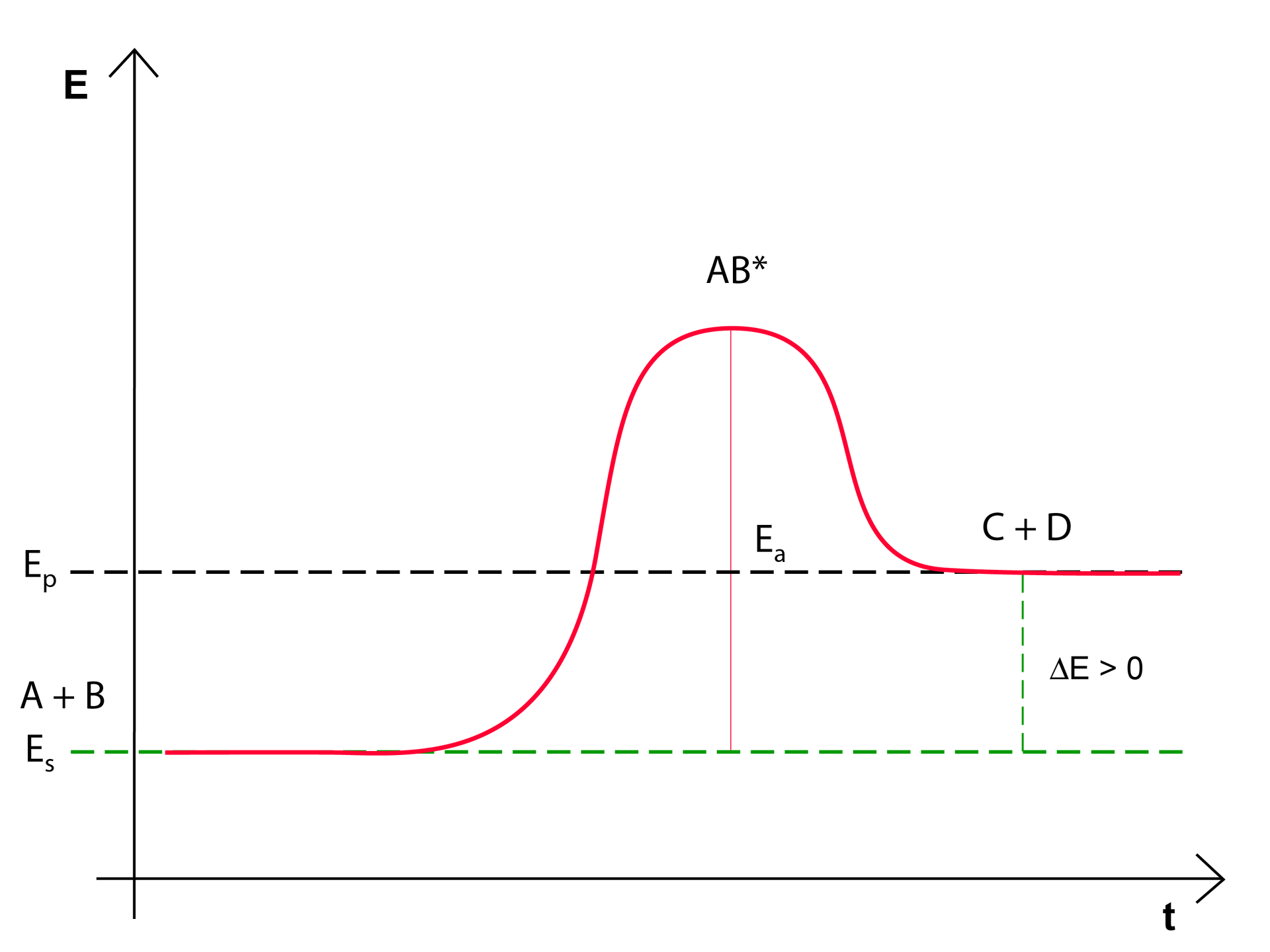
W tym wypadku deltaE jest energią, która została pochłonięta przez układ, a EIndeks dolny aa jest energią aktywacji, potrzebną substratom do przejścia w kompleks aktywny, zdolny do przemiany w produkty. Tym razem, jeśli układ pobierze dodatkową energię z otoczenia, to po reakcji będzie mieć większą energię niż przed nią. Reakcje endoenergetyczne to reakcje o ujemnym bilansie energetycznym. Energia potencjalna produktów jest większa niż energia potencjalna substratów.
Co się zmieni jeśli do reakcji dodamy katalizator?
KatalizatorKatalizator to substancja, która dodana nawet w małych ilościach do reakcji chemicznej zwiększa jej szybkość. Co ważne, katalizator nie jest substratem i nie występuje w równaniu stechiometrycznym. Obniża energię aktywacji, ułatwiając przebieg reakcji. Szybkość zależy od wielkości energii aktywacji. Im wyższa energia aktywacji, tym reakcja zachodzi wolniej. Wykres zmian energii układu przykładowej katalitycznej reakcji egzoenergetycznej został przedstawiony poniżej:
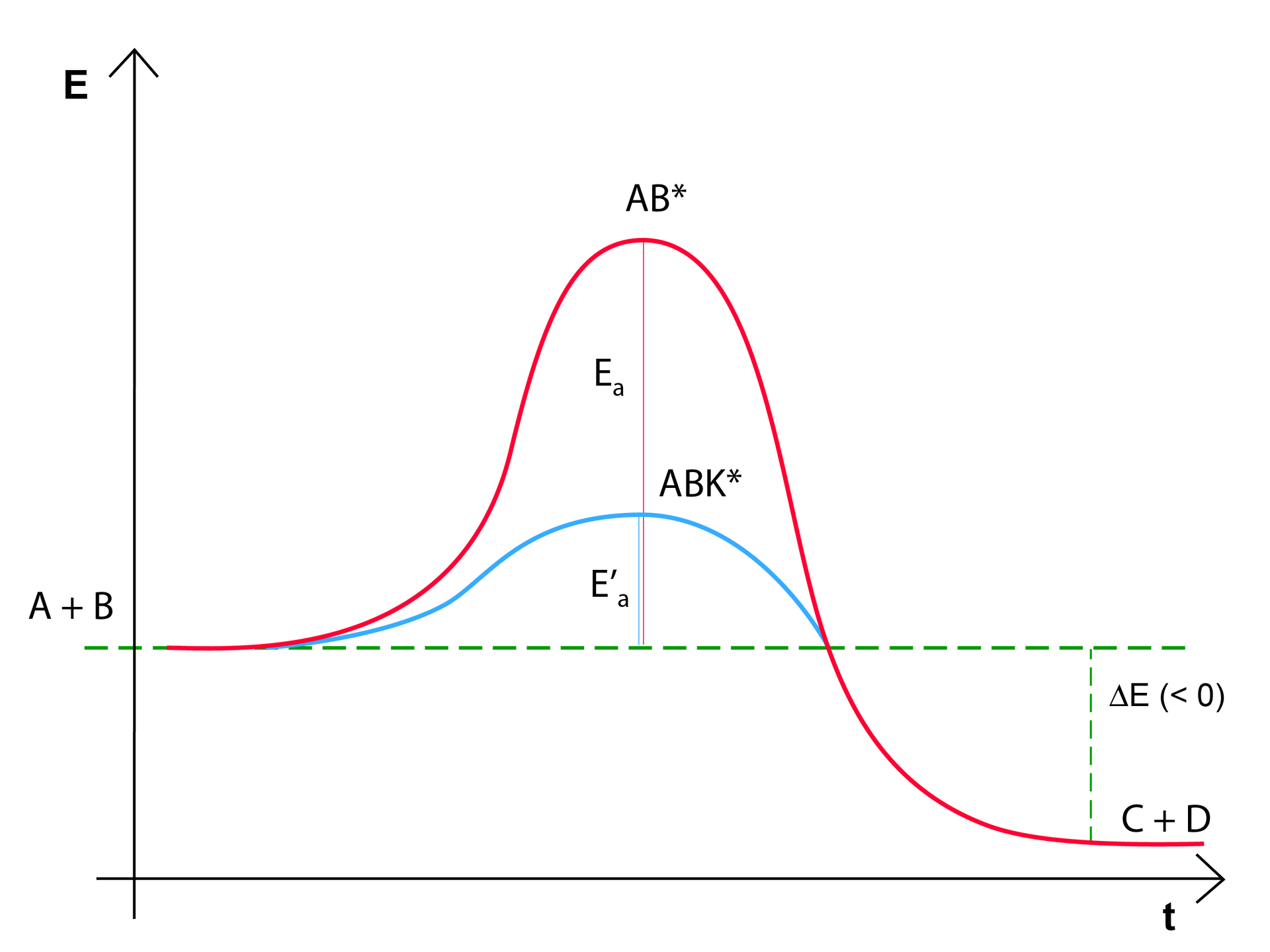
Na wykresie została przedstawiona zmiana energii podczas reakcji chemicznej z udziałem katalizatora. Energia aktywacji reakcji z udziałem katalizatora jest dużo niższa od energii aktywacji reakcji bez udziału katalizatora. Aby zaszła reakcja chemiczna, dwie cząsteczki substratu muszą posiadać sumarycznie większą energię kinetyczną niż wartość energii aktywacji. Im mniejsza energia aktywacji, tym więcej cząsteczek może się ze sobą zderzyć, ponieważ więcej cząsteczek może pokonać barierę energetyczną. Dzięki temu reakcja zachodzi szybciej.
Słownik
(łac. katalysis „rozkład”) substancja, która zwiększa szybkość reakcji chemicznej i najczęściej pozostaje w stanie niezmienionym po zakończeniu reakcji
(łac. complexus „objęcie, połączenie”) stan przejściowy, przez który przebiega reakcja chemiczna; prowadzi do utworzenia produktów
(gr. enérgeia „działanie”, łac. activus „czynny”) minimalna energia, którą muszą mieć indywidua chemiczne, aby mogła zajść między nimi reakcja chemiczna
część energii układu, zależna od rozmieszczenia elementów układu i ich położenia
część energii układu, zależna od jego prędkości
reakcja chemiczna, która przebiega z wydzieleniem energii do otoczenia
reakcja chemiczna, która przebiega z pochłanianiem energii z otoczenia
Bibliografia
Atkins P., Jones L., Chemia fizyczna, Warszawa 2015.
Atkins P., Jones L., Chemical Principles: The Quest for Insight, New York 2009, wyd. 5.
Encyklopedia PWN