Przeczytaj
Co to jest kwas i zasada?
Kwasy to grupa związków o podobnych właściwościach, takich jak kwaśny smak, zdolność do roztwarzania wybranych metali czy charakterystyczna barwa ich roztworów w obecności wskaźników. Analogiczną grupę stanowią substancje będące „przeciwnikami” kwasów, czyli zasady. Połączenie kwasów i zasad powoduje zanik ich cech. Reakcję pomiędzy kwasem a zasadą nazywa się zobojętnianiem.
Teoria kwasów i zasad Brønsteda‑Lowry’ego
Istnieje wiele teorii kwasów i zasad, które różnią się sposobem definiowania obu pojęć. Jedną z najpopularniejszych jest teoria kwasów i zasad ogłoszona w 1923 r. niezależnie przez duńskiego chemika Johannesa Brønsteda i brytyjskiego Martina Lowry’ego. Z uwagi na bardziej dokładne opracowanie tej teorii przez pierwszego z nich często nazywa się ją tylko nazwiskiem Brønsteda.
Według tej teorii kwasem jest każdy związek lub jon zdolny do oddania jonu wodoru. Zasadą jest związek lub jon zdolny do przyjęcia jonu wodoru. Oznaczając kwas jako HA a zasadę jako B można zapisać równania obrazujące transfer jonu wodoru:
gdzie:
– kwas (donor jonu wodoru)
– jon wodoru
– zasada (akceptor jonu wodoru)
gdzie:
– jon wodoru
– zasada
– kwas (donor jonu wodoru)
Każdy kwas oddając jon wodoru staje się zasadą, a każda zasada przyjmując ten jon staje się kwasem.
W roztworach najczęściej dochodzi jednak do reakcji pomiędzy kwasem , a niesprzężoną z nią zasadą . Równanie wtedy przyjmuje postać:
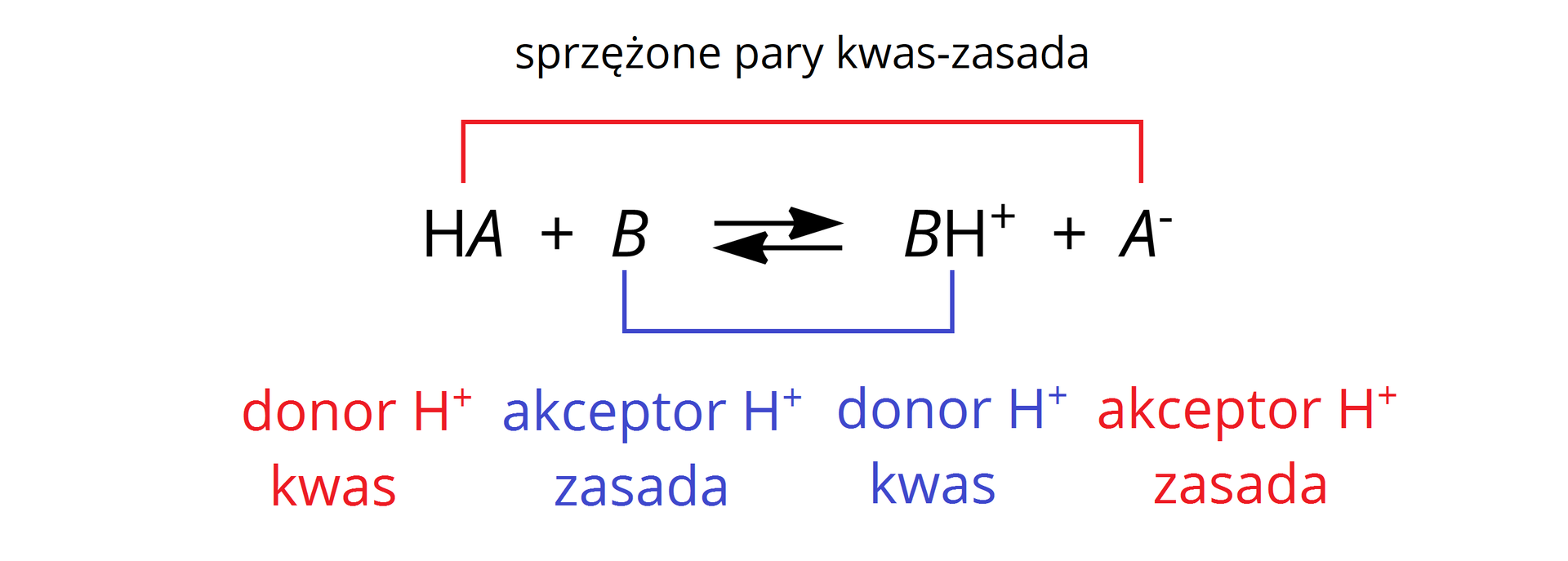
Takie reakcje pomiędzy kwasem i zasadą Brønsteda nazywamy reakcjami protolitycznymi.
W roztworach może dochodzić również do reakcji kwasów lub zasad z rozpuszczalnikiem, np. wodą:
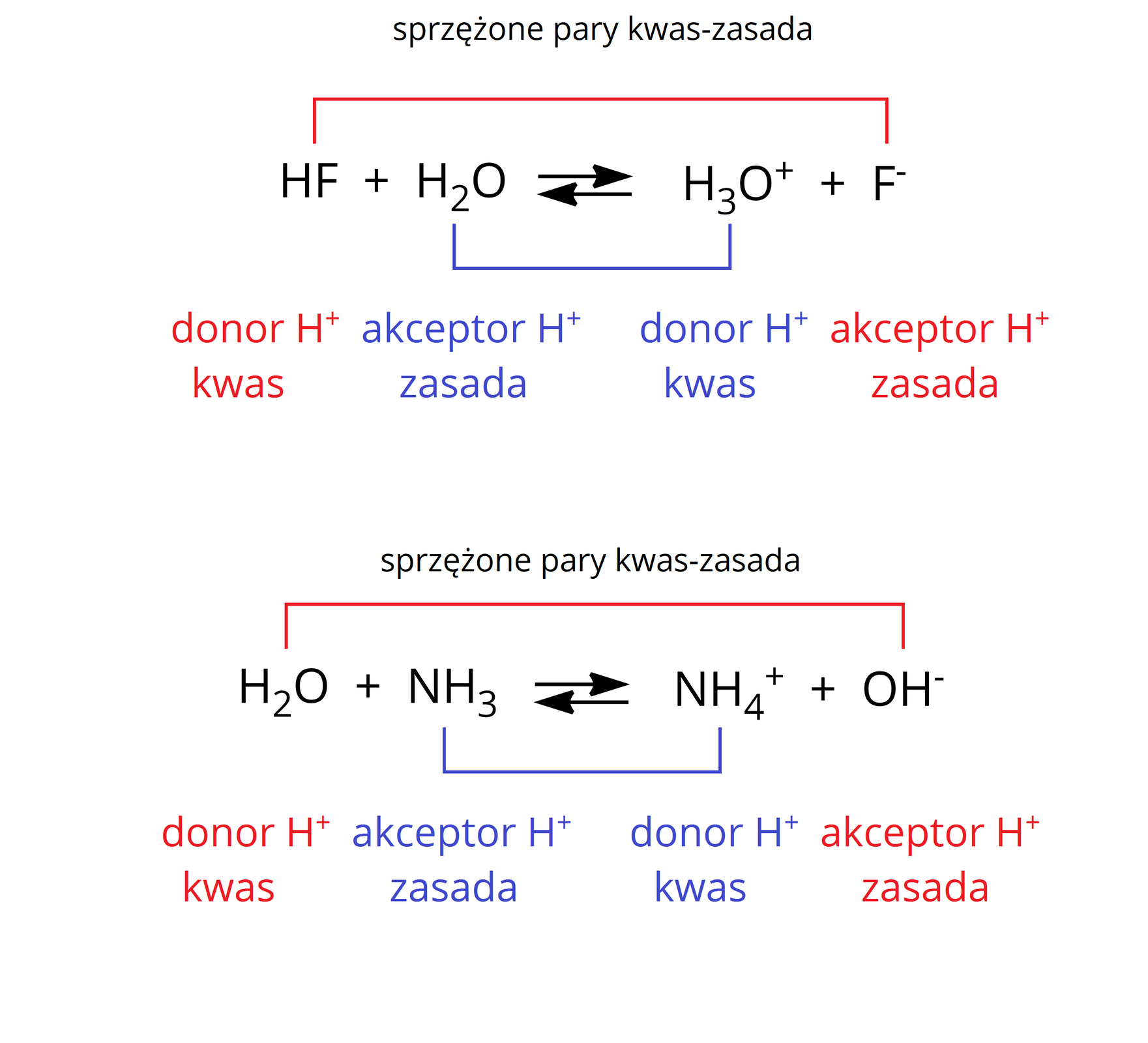
W pierwszym równaniu woda pełni funkcję zasadyzasady, a w drugim kwasukwasu. Woda może więc pełnić zarówno funkcję kwasu, jak i zasady. Substancje mogące pełnić obie te funkcje nazywamy amfiprotycznymiamfiprotycznymi.
Napisz równanie reakcji protolitycznej zachodzącej pomiędzy kwasem Brønsteda a zasadą Brønsteda:
Zmieszano wodny roztwór amoniaku z kwasem bromowodorowym. Napisz równanie reakcji zachodzącej pomiędzy cząsteczkami i . Zaznacz sprzężone pary kwas‑zasada.
Przeprowadzono reakcję jonu wodorowęglanowego z wodą, w której woda pełni rolę zasady. Zapisz równanie reakcji oraz wzory dwóch sprzężonych par kwas‑zasada dla tego równania.
Autodysocjacja (autoprotoliza)
Autodysocjacja (autoprotoliza)Autodysocjacja (autoprotoliza) to proces, w którym dwie cząsteczki związku chemicznego reagują ze sobą tworząc jony. Najpopularniejszym przykładem tego procesu jest autodysocjacja wody:
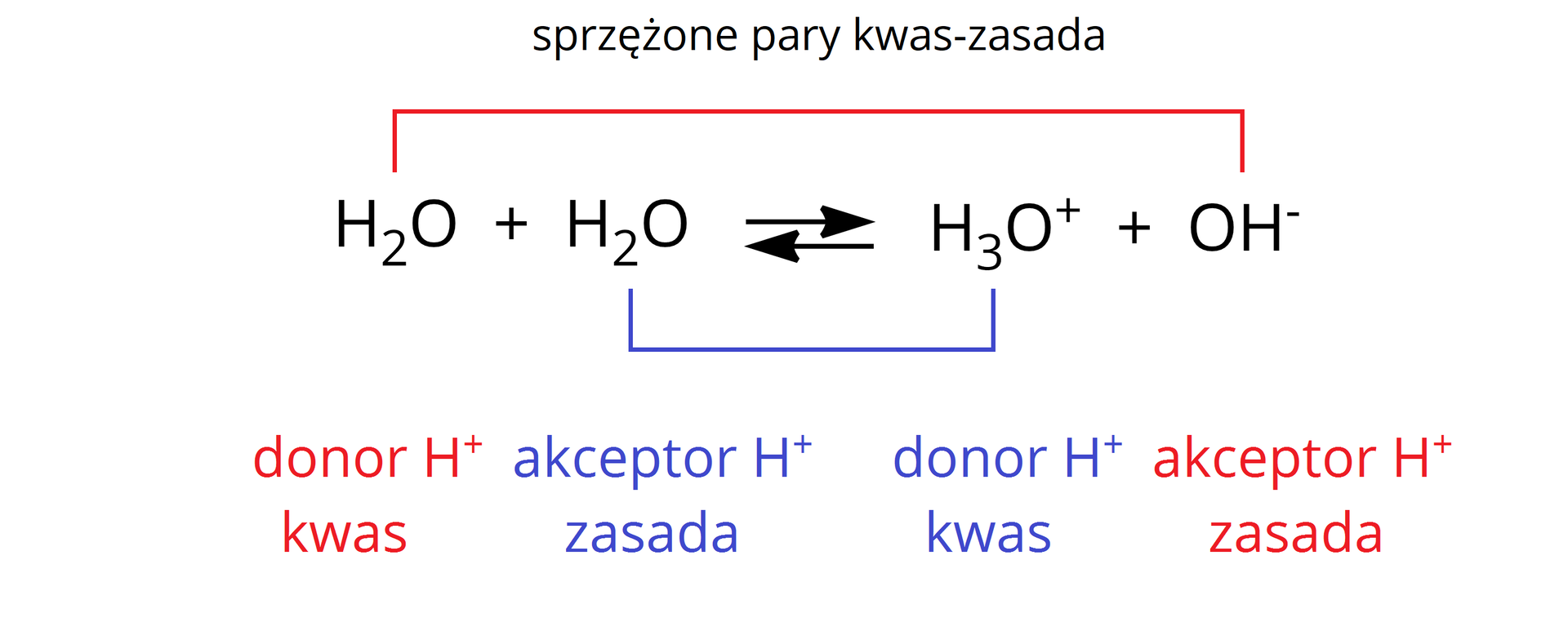
Proces audodysocjacji wody zachodzi w bardzo niewielkim stopniu. Stężenie jonów oksoniowych oraz wodorotlenkowych w wodzie destylowanej w temperaturze 25°C wynosi zaledwie
Zapisz równanie procesu autodysocjacji dla amoniaku.
Bezwodny kwas siarkowy(VI), podobnie jak cząsteczki wody, wykazuje zdolność do ulegania procesowi autoprotolizy (autodysocjacji):
Wartość stałej równowagi tego procesu w warunkach pokojowych wynosi ok. 3·10Indeks górny -4-4.
Dla procesu autoprotolizy kwasu siarkowego(VI) napisz wzory kwasów i zasad tworzących w tej reakcji sprzężone pary Brønsteda. Uzupełnij poniższą tabelę.
Uzupełnij poniższe zdania.
Słownik
proces dysocjacji związku chemicznego w rozpuszczalniku, którym jest ten związek
jedna z teorii definiujących kwasy i zasady i opisujących reakcję między nimi
związek chemiczny lub jon zdolny do oddania jonu wodoru/donor jonu wodoru
związek chemiczny lub jon zdolny do przyjęcia jonu wodoru/akceptor jonu wodoru
substancja mogąca być zarówno kwasem jak i zasadą w teorii Brønsteda-Lowry’ego