Przeczytaj
Budowa aminokwasów
AminokwasyAminokwasy to związki organiczne występujące powszechnie we wszystkich organizmach żywych. Spośród ponad 300 poznanych aminokwasów wyróżnia się 20
alfa‑aminokwasów będących składnikami białek i peptydów. Pozostałe występują w stanie wolnym w tzw. puli aminokwasowej, różnej dla poszczególnych tkanek i organizmów.
W komórkach spotyka się często tzw. aminokwasy niebiałkowe, czyli takie, które nie wchodzą w skład białek, a są homologami, izomerami lub pochodnymi aminokwasów białkowych.
Cząsteczka alfa‑aminokwasu zawiera grupę karboksylową (–COOH) oraz grupę aminową (–NHIndeks dolny 22) przyłączone do tego samego atomu węgla.
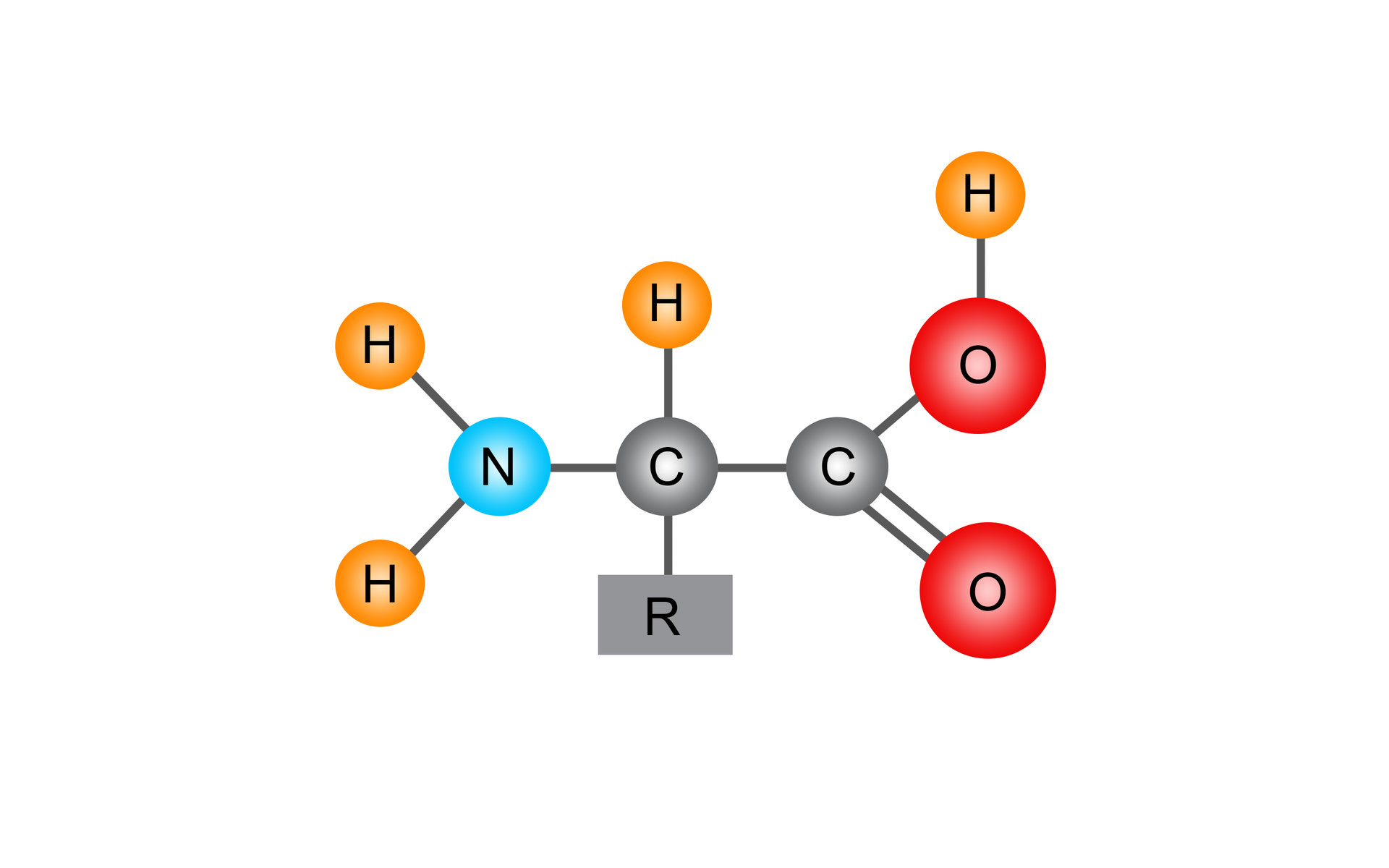
Aminokwasy to pochodne węglowodorów zbudowane ze związanych kowalencyjnie z atomem węgla: grupy aminowej (–NH2), grupy karboksylowej (–COOH), atomu wodoru oraz specyficznego łańcucha bocznego (R).
Właściwości fizykochemiczne
Grupy związane z węglem CIndeks dolny alfa Indeks dolny koniecalfa rozmieszczone są wokół niego podobnie do wierzchołków tetraedrutetraedru. Większość alfa‑aminokwasów ma przy tym węglu cztery różne grupy, jedynie glicyna wykazuje inną budowę – zamiast łańcucha bocznego zawiera drugi atom wodoru. Asymetria atomu węgla (C) powoduje tworzenie się substancji optycznie czynnych – enancjomerów L i D. W białkachbiałkach występują wyłącznie L‑aminokwasy.
Cząsteczki aminokwasów obecne w białku, zwane resztami aminokwasowymi, różnią się rodzajem podstawnika R (tzw. łańcucha bocznego), który warunkuje ich właściwości fizyczne i chemiczne. Zależnie od nich i od budowy łańcucha bocznego aminokwasy można dzielić na różne kategorie, np. na polarnepolarne i niepolarne, alifatycznealifatyczne i aromatycznearomatyczne oraz kwasowekwasowe i zasadowezasadowe.

Obecność w cząsteczce zasadowej grupy aminowej i kwasowej grupy karboksylowej warunkuje charakter amfoterycznyamfoteryczny aminokwasów, które w roztworach o odczynie kwasowym zachowują się jak zasadyzasady, natomiast w roztworach o odczynie zasadowym – jak kwasykwasy.
Aminokwasy mogą występować w postaci jonów obojnaczychjonów obojnaczych. Oznacza to, że jeden ich koniec ma ładunek dodatni, a drugi ujemny. Z grupy karboksylowej (–COOH) uwalnia się proton (HIndeks górny ++), zmieniając ją w jon –COOIndeks górny --, podczas gdy grupa aminowa
(–NHIndeks dolny 22), przyjmując proton, przekształca się w jon –NHIndeks dolny 33Indeks górny ++. Protony mogą więc być dołączane do grupy aminowej i odłączane od grupy karboksylowej. Wartość pH roztworu, w którym możliwie największa ilość danego aminokwasu występuje w postaci jonu obojnaczego, nazywa się punktem izoelektrycznym (pI).

Podział aminokwasów
Aminokwasy można podzielić według właściwości ich łańcuchów bocznych (R), mających wpływ na przestrzenną strukturę białek.
- Nazwa kategorii: [bold]Aminokwasy[/l]{color=#CC6600}
- Nazwa kategorii: podział ze względu[br]na polarność{color=#660000}
- Nazwa kategorii: polarne{color=#CC3333}
- Nazwa kategorii: niepolarne{color=#FF9966} Koniec elementów należących do kategorii podział ze względu[br]na polarność{color=#660000}
- Nazwa kategorii: podział ze względu na[br]właściwości łańcucha[br]bocznego{color=#990066}
- Nazwa kategorii: kwasowe{color=#CC3366}
- Nazwa kategorii: zasadowe{color=#CC6666} Koniec elementów należących do kategorii podział ze względu na[br]właściwości łańcucha[br]bocznego{color=#990066}
- Nazwa kategorii: podział ze względu na[br]strukturę łańcucha[br]bocznego {color=#FF6600}
- Nazwa kategorii: alifatyczne{color=#CC8800}
- Nazwa kategorii: aromatyczne{color=#FFCC33} Koniec elementów należących do kategorii podział ze względu na[br]strukturę łańcucha[br]bocznego {color=#FF6600}
- Elementy należące do kategorii [bold]Aminokwasy[/l]
- Elementy należące do kategorii podział ze względu[br]na polarność
- Elementy należące do kategorii podział ze względu na[br]właściwości łańcucha[br]bocznego
- Elementy należące do kategorii podział ze względu na[br]strukturę łańcucha[br]bocznego
Aminokwasy polarne i niepolarne
Aminokwasy polarne
Aminokwasy mające polarne łańcuchy boczne są hydrofilowehydrofilowe.

Aminokwasy niepolarne
Aminokwasy z niepolarnymi łańcuchami bocznymi są mniej lub bardziej hydrofobowehydrofobowe.
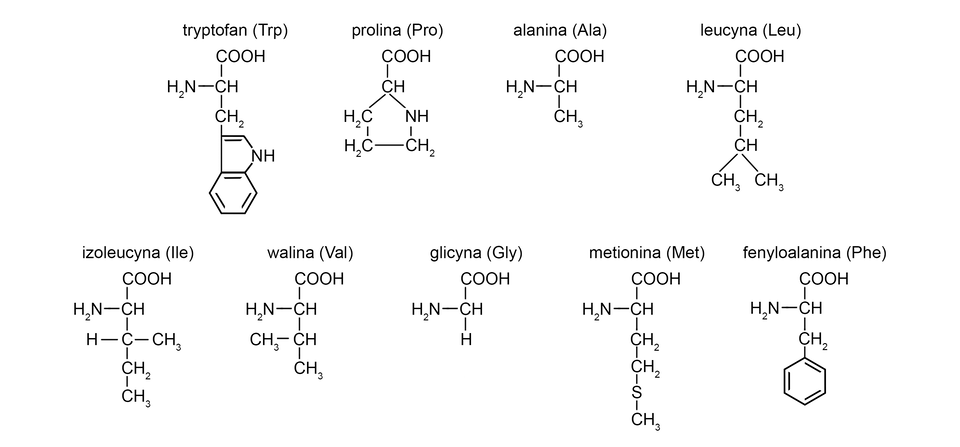
Aminokwasy alifatyczne i aromatyczne
Aminokwasy alifatyczne
Aminokwasy alifatyczne, inaczej łańcuchowe, mają podstawnik, w którym atomy węgla tworzą prosty (liniowy) lub rozgałęziony łańcuch. Są to: walina, cysteina, melatonina, glicyna, alanina, izoleucyna, leucyna.
Aminokwasy aromatyczne
Do aminokwasów aromatycznych należą te aminokwasy, których łańcuchy boczne zawierają pierścień aromatyczny: fenyloalanina, tyrozyna, tryptofan oraz prolina.
Aminokwasy kwasowe i zasadowe
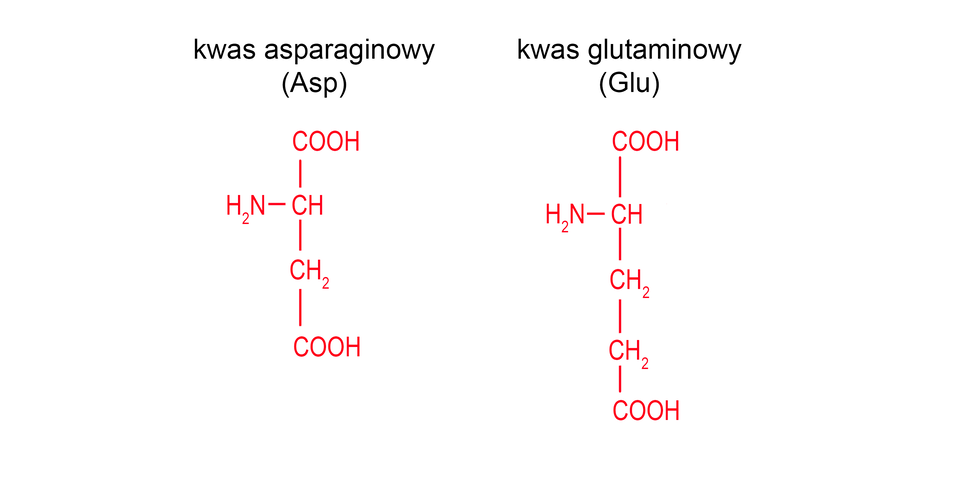
Aminokwasy kwasowe
W łańcuchach bocznych tych aminokwasów znajduje się dodatkowa grupa karboksylowa. Aminokwasy kwasowe występują w komórkach w postaci zjonizowanej, dlatego mają ładunek ujemny.
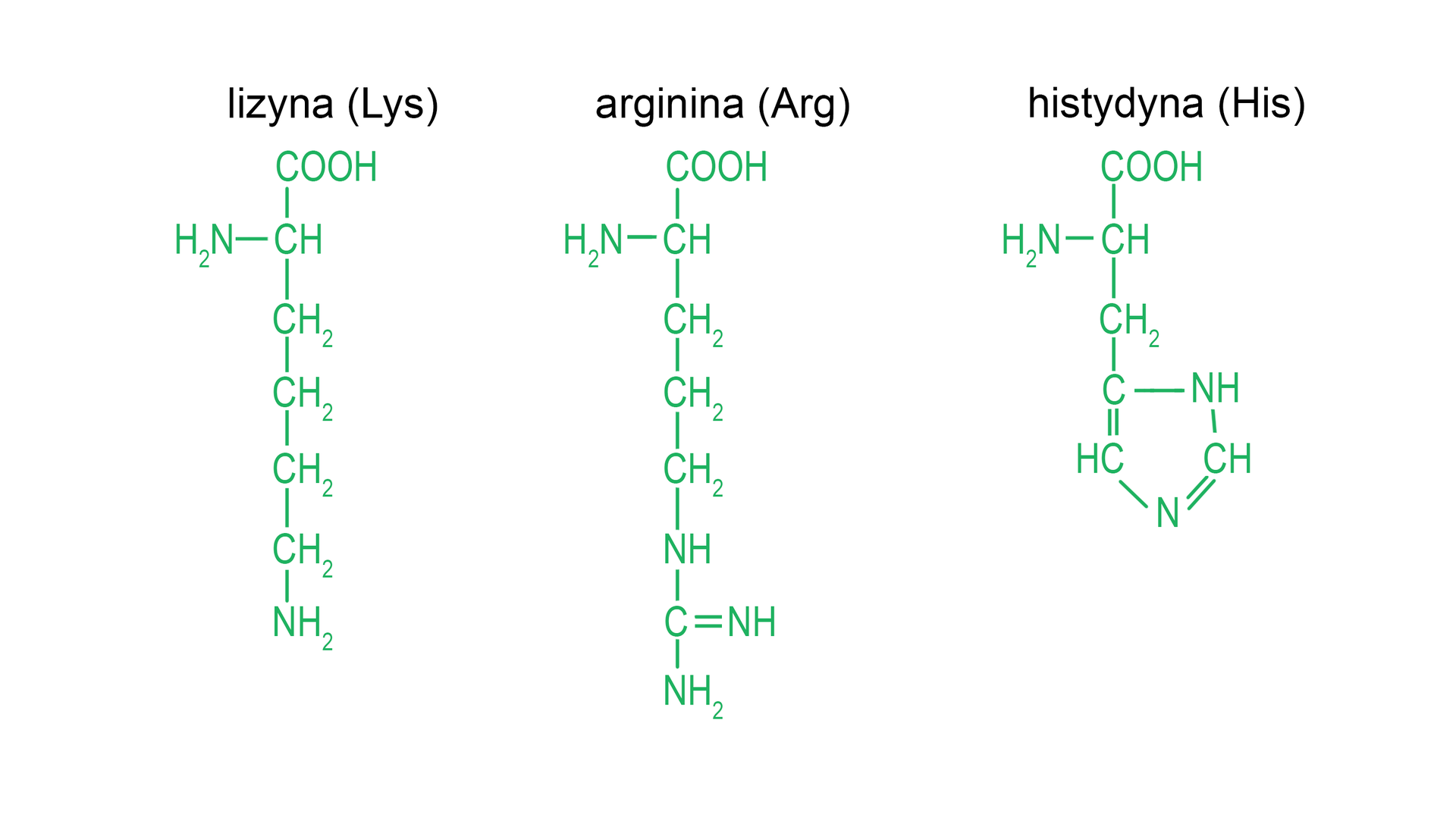
Aminokwasy zasadowe
Mają w swoich łańcuchach bocznych dodatkowe grupy aminowe. Mogą przyjmować dodatkowe atomy wodoru, przez co stają się cząsteczkami naładowanymi dodatnio.
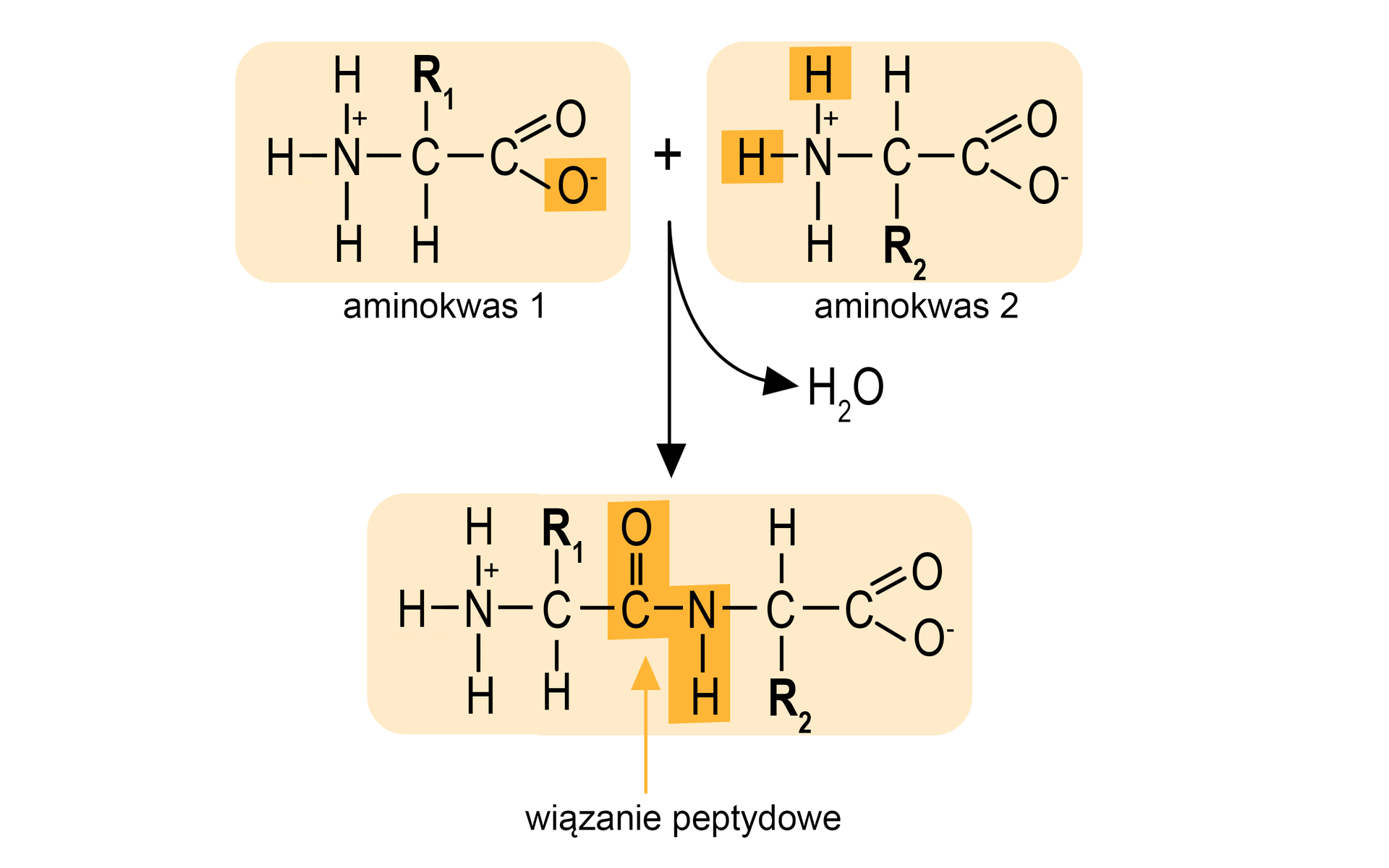
Tworzenie wiązań peptydowych
Poszczególne aminokwasy łączą się wiązaniami peptydowymi pomiędzy grupą karboksylową jednej cząsteczki a grupą aminową drugiej. Wynikiem połączenia się dwóch aminokwasów jest dipeptyd. Przyłączenie kolejnego aminokwasu tworzy tripeptyd, a następnego - tetrapeptyd. W ten sposób powstają oligopeptydy, czyli krótkie łańcuchy zbudowane z dwóch do kilkunastu reszt aminokwasowych. Te utworzone z większej liczby aminokwasów nazywa się polipeptydami. Łańcuchy aminokwasów o masie cząsteczkowej powyżej 10 tys. daltonów (czyli zbudowane z co najmniej 90. aminokwasów) zaliczane są do białek. Na jednym końcu każdego łańcucha znajduje się wolna grupa aminowa, a na drugim wolna grupa karboksylowa.
Słownik
budowa związku organicznego, w którym atomy węgla są połączone ze sobą w otwarte proste (liniowe) lub rozgałęzione łańcuchy
właściwość polegająca na tym, że związek chemiczny w roztworach o odczynie kwasowym wykazuje właściwości zasadowe, natomiast w roztworach o odczynie zasadowym właściwości kwasowe
związki organiczne powszechnie występujące w organizmach żywych, zawierające w cząsteczce co najmniej jedną grupę karboksylową (–COOH) i co najmniej jedną grupę aminową (–NHIndeks dolny 22)
charakterystyczna cecha niektórych cyklicznych związków organicznych o sprzężonym układzie wiązań podwójnych (układ naprzemiennie położonych wiązań pojedynczych i podwójnych pomiędzy atomami węgla) i płaskiej budowie cząsteczki
syntetyzowane na rybosomach związki organiczne o charakterze polimerów, zbudowane z aminokwasów połączonych ze sobą wiązaniami peptydowymi i tworzących I‑rzędową strukturę przestrzenną; struktury przestrzenne wyższych rzędów stabilizowane są wiązaniami wodorowymi, jonowymi i mostkami disiarczkowymi; pełnią w organizmach różnorodne funkcje: strukturalne, enzymatyczne, regulacyjne i transportowe
właściwość substancji polegająca na zdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, głównie z wodą, bądź grupami polarnymi innych związków chemicznych
właściwość substancji polegająca na niezdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, głównie z wodą, bądź grupami polarnymi innych cząsteczek
jon dwubiegunowy, amfijon; jon obdarzony zarówno ładunkiem ujemnym, jak i dodatnim; tworzy się wskutek wewnątrzcząsteczkowej wędrówki protonu; w roztworach kwasowych przechodzi w kation, a w zasadowych – w anion
związek chemiczny mogący dysocjować w roztworze wodnym z odszczepieniem jonu wodoru (HIndeks górny ++)
(gr. péptō ‘trawię’); związki organiczne zbudowane z dwóch lub więcej cząsteczek aminokwasów, połączonych wiązaniem peptydowym
właściwość cząsteczki posiadającej wiązania kowalencyjne polegająca na nierównomiernym rozłożeniu w niej ładunku elektronowego, wywołana różną elektroujemnością atomów tworzących tę cząsteczkę
czworościan foremny
związek chemiczny zwiększający stężenie jonów wodorotlenkowych (OHIndeks górny --) w roztworze; jest zdolny do przyłączania jonów wodorowych (HIndeks górny ++)