Przeczytaj
Jak zapewne pamiętasz ze szkoły podstawowej, tlen cząsteczkowy () stanowi około objętościowych atmosfery Ziemi. Sam tlen jest też najbardziej rozpowszechnionym pierwiastkiem w skorupie ziemskiej.
- O; Wartość: 46.1; Udział procentowy: 46,1%
- Si; Wartość: 28.2; Udział procentowy: 28,2%
- Al; Wartość: 8.23; Udział procentowy: 8,2%
- Fe; Wartość: 5.63; Udział procentowy: 5,6%
- Ca; Wartość: 4.15; Udział procentowy: 4,2%
- Na; Wartość: 2.36; Udział procentowy: 2,4%
- Mg; Wartość: 2.33; Udział procentowy: 2,3%
- K; Wartość: 2.09; Udział procentowy: 2,1%
- H; Wartość: 0.14; Udział procentowy: 0,1%
- inne; Wartość: 0.77; Udział procentowy: 0,8%
Przyjrzyj się układowi okresowemu. Jakie informacje o tlenie i jego atomach możesz wywnioskować na podstawie jego położenia w tym układzie?

Tlen jest niemetalem. Liczba atomowa atomu tlenu wynosi , co oznacza, że atom tego pierwiastka posiada protonów w jądrze atomowym oraz elektronów na powłokach elektronowych. Ponieważ tlen leży w okresie układu okresowego, to w stanie podstawowym elektrony w atomie tlenu poruszają się w obrębie dwóch powłok elektronowych, oznaczanych symbolami K i L. Ponieważ pierwiastek ten jest ulokowany w grupie układu okresowego, to powłoka K jest zapełniona elektronami, nazywanymi elektronami walencyjnymi.
W powietrzu występuje kilka stabilnych izotopów tlenu: tlen- oraz śladowe ilości tlenu- i tlenu-. Pozostałe izotopy tlenu (, , , , , ) są wytwarzane sztucznie i mają właściwości promieniotwórcze.
Alchemiczny duch świata
Kiedyś uznawano, że tlen został odkryty przez Carla Sheelego przed , ale swego odkrycia nie opublikował on aż do roku. W tym czasie za odkrywcę tlenu uznawany był Joseph Priestley, który ogłosił swoje odkrycie dwa lata wcześniej.
Prawdopodobnie jednak tlen został odkryty już wieku przez polskiego alchemika Michała Sędziwoja, który nazywał go „pokarmem żywota” i „duchem świata”. Sędziwój wiedział, że „pokarm żywota, ukryty w powietrzu” jest niezbędny do życia i że przedostaje się z powietrza do krwi. Otrzymał tlen w drodze rozkładu termicznego azotanu() potasu.
Stan skupienia
Oczywiste jest, że w warunkach normalnych jest bezbarwnym, bezwonnym gazem. Dowód możemy znaleźć dosłownie w powietrzu – jest ono bezbarwne, a gdyby wchodzący w skład tej mieszaniny gazowy tlen posiadał jakąś barwę, zapewne bylibyśmy w stanie ją zauważyć. Zadajmy sobie teraz istotne pytanie:
Skoro tlen jest gazem, czy istnieją warunki, w których jest cieczą lub ciałem stałym?
Poniżej przedstawiono diagram fazowydiagram fazowy tlenu – wykres przedstawiający warunki (ciśnienie i temperaturę), w których badana substancja występuje w danym stanie skupienia. PK to tzw. punkt krytyczny – punkt końcowy krzywej współistnienia cieczy i pary. PT to punkt potrójny, opisuje warunki, w których substancja współistnieje w trzech stanach skupienia (stałym, ciekłym i gazowym). Na podstawie wykresu odczytaj temperatury wrzenia i krzepnięcia tlenu w warunkach ciśnienia normalnego ().
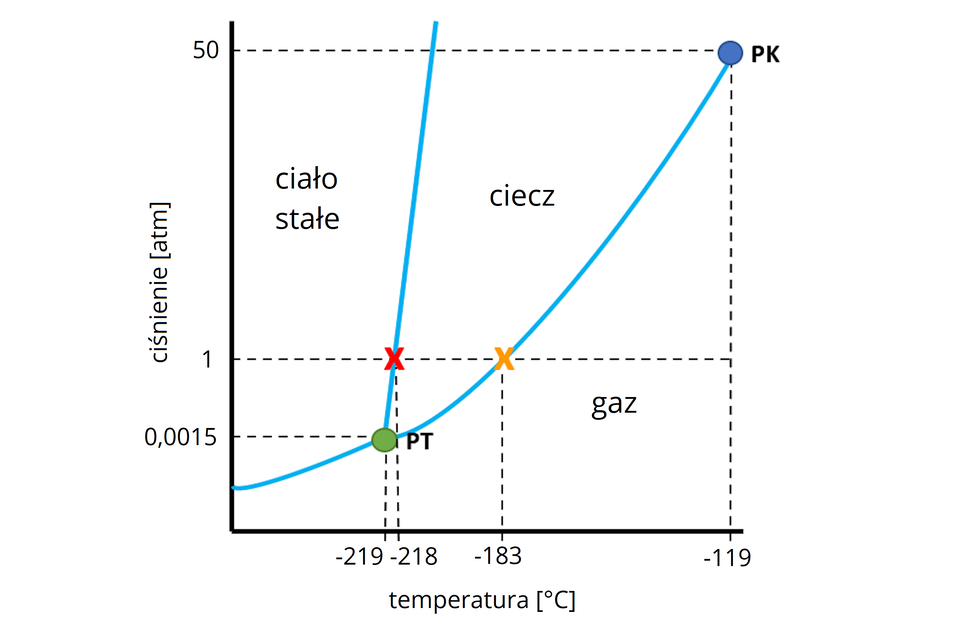
Tlen cząsteczkowy może istnieć we wszystkich trzech stanach skupienia. Aby przeprowadzić gazowy tlen w inny stan skupienia, należy zapewnić odpowiednie warunki. Temperatura wrzenia tlenu pod ciśnieniem wynosi około , a krzepnięcia .
Co ciekawe, ciekły tlen po raz pierwszy otrzymali profesorowie Uniwersytetu Jagiellońskiego, Zygmunt Wróblewski i Karol Olszewski, w roku.
Cechą charakterystyczną tlenu, jak i pozostałych tlenowców, jest zdolność do występowania w różnych postaciach molekularnych (odmianach alotropowychodmianach alotropowych). Tlen w postaci gazowej może występować jako cząsteczki dwuatomowe lub jako ozon . W latach dziewięćdziesiątych dokonano odkrycia czteroatomowego tlenu , zwanego czerwonym tlenem.
Kolory tlenu i chemia błyskawicy
Ciekły i stały tlen są bladoniebieskie. Jednak w ekstremalnie niskich temperaturach i odpowiednich warunkach ciśnienia, można otrzymać czysty tlen w kolorze różowym, pomarańczowym, czy nawet czerwonym do czarnego. Wzbudzone atomy tlenu odpowiadają za zielone i czerwone zorze polarne.
Błyskawice mogą rozrywać dwuatomowe cząsteczki tlenu na pojedyncze, wysoce reaktywne atomy. Te wchodzą w reakcje z innymi cząsteczkami , tworząc cząsteczki ozonu (), który odpowiada za „zapach deszczu”. Błyskawice jonizują powietrze wokół siebie. Niebieskofioletowy kolor piorunów to konsekwencja emisji światła ze wzbudzonych atomów tlenu i azotu.

Rozpuszczalność tlenu w wodzie
Przeanalizuj poniższą krzywą rozpuszczalności gazów w wodzie. Czy cząsteczkowy tlen rozpuszcza się w wodzie. Czy potrafisz oszacować stopień rozpuszczalności tlenu w stosunku do innych gazów? Jak zmienia się jego rozpuszczalnośćrozpuszczalność pod wpływem temperatury?
- 1. zestaw danych:
- temperatura [[°C]]: 0
- metan: 2,58; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- tlen: 4,38; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- wodór: 1,79; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- azot: 2,04; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 2. zestaw danych:
- temperatura [[°C]]: 20
- metan: 1,69; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- tlen: 2,77; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- wodór: 1,49; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- azot: 1,33; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 3. zestaw danych:
- temperatura [[°C]]: 40
- metan: 1,25; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- tlen: 2,06; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- wodór: 1,33; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- azot: 1,07; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 4. zestaw danych:
- temperatura [[°C]]: 60
- metan: 1,05; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- tlen: 1,70; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- wodór: 1,3; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- azot: 0,89; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 5. zestaw danych:
- temperatura [[°C]]: 80
- metan: 0,95; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- tlen: 1,61; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- wodór: 1,30; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- azot: 0,86; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- 6. zestaw danych:
- temperatura [[°C]]: 100
- metan: 0,9; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- tlen: 1,52; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- wodór: 1,30; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
- azot: 0,85; Podpis osi wartości: [/]rozpuszczalność [[mmol · dm[baseline-shift: super; font-size: smaller;]-3[/]]]
Wykres liniowy. Wykres zależności rozpuszczalności wybranych gazów (metanu, tlenu, wodoru oraz azotu) w wodzie od temperatury. Rozpuszczalność wyrażona w wyrażonej w milimolach na decymetr sześcienny. Temperatura wyrażona w stopniach Celsjusza. Lista elementów:
Pierwszy zestaw danych:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność []
tlen: ; Podpis osi wartości: rozpuszczalność []
wodór: ; Podpis osi wartości: rozpuszczalność []
azot: ; Podpis osi wartości: rozpuszczalność []
Drugi zestaw danych:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność []
tlen: ; Podpis osi wartości: rozpuszczalność []
wodór: ; Podpis osi wartości: rozpuszczalność []
azot: ; Podpis osi wartości: rozpuszczalność []
Trzeci zestaw danych:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność []
tlen: ; Podpis osi wartości: rozpuszczalność []
wodór: ; Podpis osi wartości: rozpuszczalność []
azot: ; Podpis osi wartości: rozpuszczalność []
Czwarty zestaw danych:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność ]
tlen: ; Podpis osi wartości: rozpuszczalność []
wodór: ; Podpis osi wartości: rozpuszczalność ]
azot: ; Podpis osi wartości: rozpuszczalność []
Piąty zestaw danych:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność []
tlen: ; Podpis osi wartości: rozpuszczalność []
wodór: ; Podpis osi wartości: rozpuszczalność []
azot: ; Podpis osi wartości: rozpuszczalność []
Szósty zestaw danych:
temperatura []: 100
metan: ; Podpis osi wartości: rozpuszczalność []
tlen: ; Podpis osi wartości: rozpuszczalność []
wodór: ; Podpis osi wartości: rozpuszczalność []
azot: ; Podpis osi wartości: rozpuszczalność []
- 1. zestaw danych:
- temperatura [[°C]]: 0
- metan: 4,17; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- tlen: 7,0; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- wodór: 0,18; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- azot: 2,86; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- 2. zestaw danych:
- temperatura [[°C]]: 20
- metan: 2,72; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- tlen: 4,43; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- wodór: 0,15; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- azot: 1,86; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- 3. zestaw danych:
- temperatura [[°C]]: 40
- metan: 2,0; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- tlen: 3,29; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- wodór: 0,13; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- azot: 1,50; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- 4. zestaw danych:
- temperatura [[°C]]: 60
- metan: 1,68; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- tlen: 2,72; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- wodór: 0,13; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- azot: 1,25; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- 5. zestaw danych:
- temperatura [[°C]]: 80
- metan: 1,52; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- tlen: 2,57; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- wodór: 0,13; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- azot: 1,2; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- 6. zestaw danych:
- temperatura [[°C]]: 100
- metan: 1,44; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- tlen: 2,43; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- wodór: 0,13; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
- azot: 1,18; Podpis osi wartości: [/]rozpuszczalność [[mg na 100 g wody[/]]]
Wykres liniowy. Wykres zależności rozpuszczalności wybranych gazów (metanu, tlenu, wodoru oraz azotu) wyrażonej w miligramach na sto gramów wody od temperatury wyrażonej w stopniach Celsjusza. Lista elementów:
Zestaw pierwszy:
temperatura []:
metan: rozpuszczalność
tlen: ; Podpis osi wartości: rozpuszczalność
wodór: ; Podpis osi wartości: rozpuszczalność
azot: ; Podpis osi wartości: rozpuszczalność .
Zestaw drugi:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność
tlen: ; Podpis osi wartości: rozpuszczalność
wodór: ; Podpis osi wartości: rozpuszczalność
azot: ; Podpis osi wartości: rozpuszczalność .
Zestaw trzeci:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność
tlen: ; Podpis osi wartości: rozpuszczalność
wodór: ; Podpis osi wartości: rozpuszczalność
azot: ; Podpis osi wartości: rozpuszczalność .
Zestaw czwarty:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność
tlen: ; Podpis osi wartości: rozpuszczalność
wodór: ; Podpis osi wartości: rozpuszczalność
azot: ; Podpis osi wartości: rozpuszczalność .
Zestaw piąty:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność
tlen: ; Podpis osi wartości: rozpuszczalność
wodór: ; Podpis osi wartości: rozpuszczalność
azot: ; Podpis osi wartości: rozpuszczalność .
Zestaw szósty:
temperatura []:
metan: ; Podpis osi wartości: rozpuszczalność
tlen: ; Podpis osi wartości: rozpuszczalność
wodór: ; Podpis osi wartości: rozpuszczalność
azot: ; Podpis osi wartości: rozpuszczalność
Tlen jest słabo rozpuszczalny w wodzie, ale rozpuszcza się w niej lepiej od azotu. Dodatkowo, jego rozpuszczalność zmniejsza się wraz ze wzrostem temperatury. Przypomnij sobie, co wpływa na rozpuszczalność substancji i odpowiedź na pytanie: Czy tlen lepiej rozpuszcza się w wodzie słodkiej, czy słonej (zakładając tę samą temperaturę)?
Tlen jest nieco lepiej rozpuszczalny w wodzie słodkiej niż słonej – na rozpuszczalność wpływa także zawartość innych substancji w wodzie. Ryby oddychają tlenem rozpuszczonym w wodzie. Podczas ruchu ryby, woda przepływa przez skrzela, co umożliwia rozpuszczonemu w niej tlenowi przedostawanie się do krwioobiegu zwierzęcia. Zwierzęta lądowe posiadają inne narządy do wymiany gazowej, które nie są przystosowane do pobierania rozpuszczonego w wodzie tlenu.
Inne wielkości fizyczne tlenu
Wielkości fizyczne ułatwiające przedstawienie zmian właściwości chemicznych pierwiastka w zależności od położenia w układzie okresowym to:
Promień atomowy – promień atomu tlenu wynosi ok. ; promień anionu tlenkowego jest większy niż promień atomu tlenu (anion tlenkowy, przy takiej samej liczbie protonów, posiada większą liczbę elektronów niż atom tlenu).
Energia jonizacji – ilość energii, jaką należy dostarczyć, aby oderwać elektron od obojętnego atomu. Kolejne energie jonizacji są coraz większe, pierwsza jest najmniejsza, ponieważ najłatwiej jest oderwać pierwszy elektron. Pierwsza energia jonizacji atomu tlenu wynosi , a druga .
Powinowactwo elektronowe – ilość energii, jaka się wydzieli podczas przyłączania elektronu do obojętnego atomu. Im większa jest wartość powinowactwa, tym łatwiej atom przyłącza elektrony. Wartość powinowactwa elektronowego atomu tlenu wynosi .
Elektroujemność – wielkość wprowadzona przez Paulinga. Jest to zdolność atomu do przyciągania ku sobie elektronów (własnych i obcych). Pierwiastki o największej elektroujemności znajdują się w prawym górnym rogu (pomijając gazy szlachetne) układu okresowego pierwiastków i mają charakter niemetali. Według względnej skali elektroujemności Paulinga, elektroujemność tlenu wynosi .
Słownik
odmiana pierwiastka chemicznego, różniąca się właściwościami fizycznymi i chemicznymi; odmiany alotropowe pierwiastka mogą różnić się między sobą strukturą krystaliczną lub liczbą atomów w cząsteczce
wykres przedstawiający w jakich stanach skupienia występuje dana substancja w zależności od ciśnienia i temperatury
maksymalna ilość substancji, jaka w danych warunkach ciśnienia i temperatury rozpuszcza się w rozpuszczalnika tworząc roztwór nasycony
Bibliografia
https://sciencenotes.org/pure-oxygen-colors-including-red-and-black/ (dostęp: 12.05.2020)
https://www.compoundchem.com/2018/07/31/thunderstorms/ (dostęp: 12.05.2020)
http://www1.lsbu.ac.uk/water/pure_water.html (dostęp: 13.05.2020)
Hassa R., Mrzigod A., Mrzigod J., To jest chemia. Podręcznik dla szkół ponadgimnazjalnych. Zakres podstawowy, Warszawa 2012.
http://mlodyhydrolog.pl/bazawiedzy/baza/woda-to-zycie/19 (dostęp: 08.06.2020)
http://www.edupedia.pl/words/index/show/542907_slownik_chemiczny-diagram_fazowy.html (dostęp: 08.06.2020)
Litwin M., To jest chemia 1. Chemia ogólna i nieorganiczna, podręcznik dla liceum ogólnokształcącego i technikum, zakres rozszerzony, Warszawa 2012.
Hejwawoska S., Odkrywamy na nowo. Chemia 1, podręcznik, zakres rozszerzony, Gdynia 2012.