Przeczytaj
Odkrycie wodoru
Henry Cavendish [käwəndısz] (–) był angielskim chemikiem i fizykiem, badającym chemiczne i fizyczne właściwości gazów wytworzonych w reakcjach chemicznych. Zawdzięczamy mu m.in. odkrycie wodoru, przypadające na rok. Otrzymany w wyniku działania kwasami (kwasem siarkowym() i kwasem chlorowodorowym) na metale (cynk, cynę i żelazo) gaz nazwał „palnym powietrzem”. Zaobserwował także, że w czasie jego spalania powstaje woda, natomiast zmieszanie „palnego powietrza” ze zwykłym powietrzem powoduje wybuch przy zetknięciu z płomieniem.
Utożsamiał wodór z tzw. flogistonem, czyli bliżej nieokreśloną substancją palną, zwaną „materią ognia”. Teoria flogistonu, pochodząca z wieku, miała wielu zwolenników. Henry Cavendish uważał więc wodór za flogiston wydzielany z metalu.
Izotopy wodoru
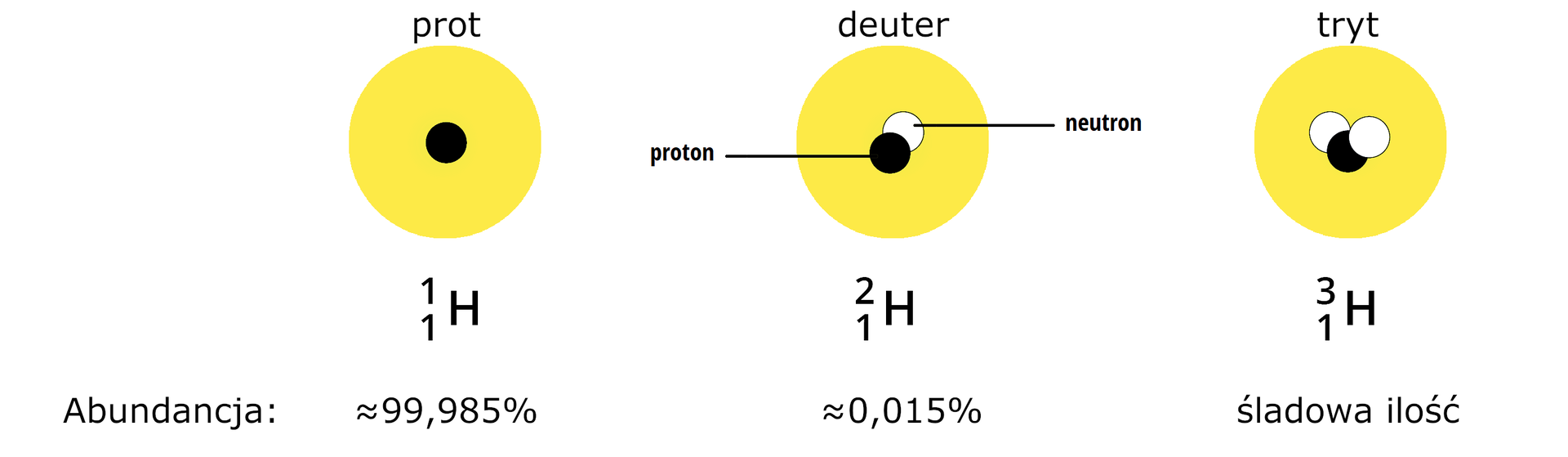
Do naturalnych izotopów wodoru zaliczamy prot o liczbie masowej równej , deuter o liczbie masowej równej oraz tryt o liczbie masowej równej . Ten pierwszy nie posiada neutronów w jądrze atomowym, lecz tylko jeden proton. Jest najliczniej występującym w naturze izotopem wodoru – jego abundancja wynosi około . Deuter, prócz jednego protonu w jądrze, posiada również jeden neutron – jego abundancje szacuje się na . Izotop ten nie jest ani radioaktywny, ani toksyczny. W skład jądra atomowego trytu wchodzą jeden proton oraz dwa neutrony. Jest on radioaktywny. Na Ziemi występują niewielkie ilości trytu z powodu oddziaływania promieniowania kosmicznego z gazami atmosferycznymi. Jest również produktem reakcji nuklearnych. Prot oraz deuter to stabilne odmiany izotopowe wodoru, podczas gdy tryt jest niestabilny i ulega rozpadom z czasem połowicznego rozpadu wynoszącym około lat. Oprócz naturalnych izotopów wodoru wytworzono również sztucznie cięższe izotopy wodoru o liczbie neutronów w jądrze równej –.
Atomy wodoru stanowią wszystkich atomów występujących w Układzie Słonecznym, tym samym odpowiadają za jego masy.
Właściwości fizykochemiczne
Wodór rozpoczyna układ okresowy pierwiastków. Jest on bezbarwnym, bezwonnym i palnym gazem o gęstości mniejszej od powietrza. Wodór jest praktycznie nierozpuszczalny w wodzie.
Temperatura topnienia wodoru wynosi , natomiast temperatura wrzenia . Jego gęstość jest bardzo niewielka i wynosi ( przy ).
Wodór zazwyczaj tworzy cząsteczki dwuatomowe (). Spośród gazów jest najlepszym przewodnikiem ciepła, a także łatwo dyfunduje przez materiały porowate. Jest pochłaniany przez niektóre metale (np. pallad, nikiel).

W czasach zimnej wojny atol Bikini był miejscem prowadzenia przez Stany Zjednoczone prób jądrowych. marca roku przeprowadzono tam próbną eksplozję o kryptonimie „Castle Bravo”. Wybuch bomby wodorowej Shrimp (z ang. „krewetka”) doprowadził do największego skażenia środowiska w historii amerykańskich prób nuklearnych. W bombie znalazły się deuterki litu, zawierające izotopy oraz . Nie przewidziano jednak, że izotop o liczbie masowej również weźmie udział w procesie. W konsekwencji, wybuch, zamiast spodziewanej siły megaton, miał siłę około megaton i doprowadził do radioaktywnego skażenia znacznie większego obszaru od pierwotnie zakładanego.
W chwili powstania wodór wykazuje szczególnie wysoką reaktywnośćreaktywność, ale zwykłe reakcje z wodorem wymagają ogrzewania. W kontakcie z tlenem tworzy mieszankę wybuchową. Szczególnie niebezpieczna jest tzw. mieszanina piorunująca, zawierająca wodór i tlen zmieszane w stosunku objętościowym — czyli stosunku równym współczynnikom stechiometrycznym w reakcji tworzenia przez te gazy wody. Charakteryzuje się ona silnymi właściwościami redukującymiredukującymi. Reaguje bezpośrednio z fluorem i chlorem podczas naświetlania (obie reakcje przebiegają gwałtownie), a po ogrzaniu łączy się z azotem, siarką oraz niektórymi metalami.
Wodór w połączeniu z większością niemetali występuje na stopniu utlenienia, a w związkach chemicznych z większością metali na stopniu utlenienia .
Związki wodoru
- Nazwa kategorii: ZWIĄZKI WODORU
- Nazwa kategorii: WODA
- Nazwa kategorii: NADTLENEK WODORU
- Nazwa kategorii: FLUOROWCOWODORY
- Nazwa kategorii: AMONIAK
- Nazwa kategorii: SIARKOWODÓR
- Nazwa kategorii: WODORKI METALI
- Nazwa kategorii: WĘGLOWODORY Koniec elementów należących do kategorii ZWIĄZKI WODORU
- Elementy należące do kategorii ZWIĄZKI WODORU
Występowanie
Wodór w stanie wolnym występuje w małych ilościach w gazach wulkanicznych i w ilościach śladowych w atmosferze ziemskiej. W formie związanej występuje głównie w wodach morskich i lądowych (jako główny składnik wody). Ten pierwiastek odgrywa równie istotną rolę w ludzkim organizmie jako składnik wielu substancji organicznych, odpowiadających za jego prawidłowe funkcjonowanie (np. białka i cukry).

Otrzymywanie
W przemyśle wodór otrzymuje się głównie za pomocą konwersji węglowodorów z parą wodną. Źródłem węglowodorów najczęściej jest gaz ziemny, a jego główny składnik to metan. Po zmieszaniu metanu z parą wodną, w temperaturze i pod wpływem katalizatora niklowego, zachodzi reakcja, którą można opisać równaniem:
Wodór można także otrzymać poprzez konwersję tlenku węgla z parą wodną:
Wodór otrzymuje się również jako produkt uboczny krakingu węglowodorów oraz w procesie elektrolizy roztworów chlorku sodu – przyłożenie pola elektrycznego powoduje uporządkowanie ruchu jonów w roztworze, ujemnie naładowane jony chloru wędrują do anody, oddają elektrony, przechodząc do stanu cząsteczkowego:
Na katodzie, w analizowanym procesie elektrolizy, zachodzi redukcja wody i wydziela się wodór:
W laboratorium zwykle otrzymuje się go przez działanie kwasów oraz mocnych zasad na metale aktywne, np.:
Zastosowanie
Wodór wykorzystywany jest do utwardzania tłuszczów, np. w procesie produkcji margaryny. Innym zastosowaniem wodoru jest produkcja amoniaku wykorzystywanego m.in. do otrzymywania nawozów azotowych, . Wykorzystuje się go do uwodorniania węglowodorów nienasyconych i aromatycznych. Mieszanina wodoru z tlenkiem węgla jest surowcem w licznych katalitycznychkatalitycznych syntezach przemysłowych (gaz syntezowy). Wodór był dawniej używany do napełniania balonów.

Słownik
ładunek, jaki zgromadziłby się na atomie danego pierwiastka wchodzącego w skład związku chemicznego, przy założeniu, że wszystkie wiązania chemiczne w związku mają charakter wiązań jonowych
proces, w trakcie którego atom przechodzi z wyższego stopnia utlenienia na niższy
zdolność substancji do łatwego wchodzenia w reakcje chemiczne
proces technologiczny polegający na rozszczepianiu wielkich cząsteczek węglowodorów na cząsteczki zawierające mniej atomów węgla, zachodzący w wyniku rozrywania wiązań między atomami węgla
zjawisko polegające na tym, że obecność stosunkowo niewielkiej ilości obcej substancji, zwanej katalizatorem, przyspiesza reakcję chemiczną
nuklidy o tej samej liczbie atomowej i różnych liczbach masowych (tj. o tej samej liczbie protonów i różnych liczbach neutronów)
obfitość występowania izotopu; procentowa zawartość danego izotopu pierwiastka w pierwiastku naturalnie występującym
Bibliografia
Atkins P., Jones, L., Laverman L., Chemical Principles, 7th Edition, New York 2016.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2012.
Encyklopedia PWN
Greenwood N. N., Earnshaw A., Chemistry of the Elements, 2th Edition, Oksford 1997.
Jolly W. L., Hydrogen, California, online: https://www.britannica.com/science/hydrogen/Production-and-applications-of-hydrogen, dostęp: 02.08.2021.