Przeczytaj
Alkohole
AlkoholeAlkohole to związki, które zawierają grupę funkcyjną –OH, związaną z tetraedrycznym (w stanie hybrydyzacjihybrydyzacji ) atomem węgla.

Najważniejsze właściwości chemiczne alkoholi są konsekwencją struktury elektronowej grupy hydroksylowej, przyłączonej do tetraedrycznego atomu węgla (hybrydyzacja ). Atom tlenu (hybrydyzacja ) połączony jest wiązaniem sigma z atomem wodoru (wiązanie utworzone przez orbital atomu tlenu i orbital 1s atomu wodoru). Jest to wiązanie atomowe, silnie spolaryzowane.

Wiązanie , utworzone przez hybrydę atomu węgla i hybrydę atomu tlenu, jest więc mniej spolaryzowane niż wiązanie . Dodatkowo, atom tlenu dysponuje dwiema wolnymi parami elektronowymi. Stanowi centrum nukleofilowe i jest równocześnie zasadą Lewisa. Atom węgla, związany z atomem tlenu, stanowi centrum elektrofilowe.
Budowa
R‑OH to ogólny wzór alifatycznych alkoholi monohydroksylowych. Cząsteczka alkoholu zawiera hydrofilowąhydrofilową grupę -OH i hydrofobowąhydrofobową resztę węglowodorową -R (wyjątkiem jest metanol, który posiada grupę metylową ). Wśród alkoholi alifatycznych łańcuchowych możemy wyróżnić, np. alkohole monohydroksylowe, będące pochodnymi:
alkanów o wzorze ogólnym ;
alkenów o wzorze ogólnym ;
alkinów o wzorze ogólnym .
Alkohole można też traktować jako pochodne wody. W tym ujęciu zakładamy, że jeden z atomów wodoru w cząsteczce wody został zastąpiony grupą węglowodorową R.
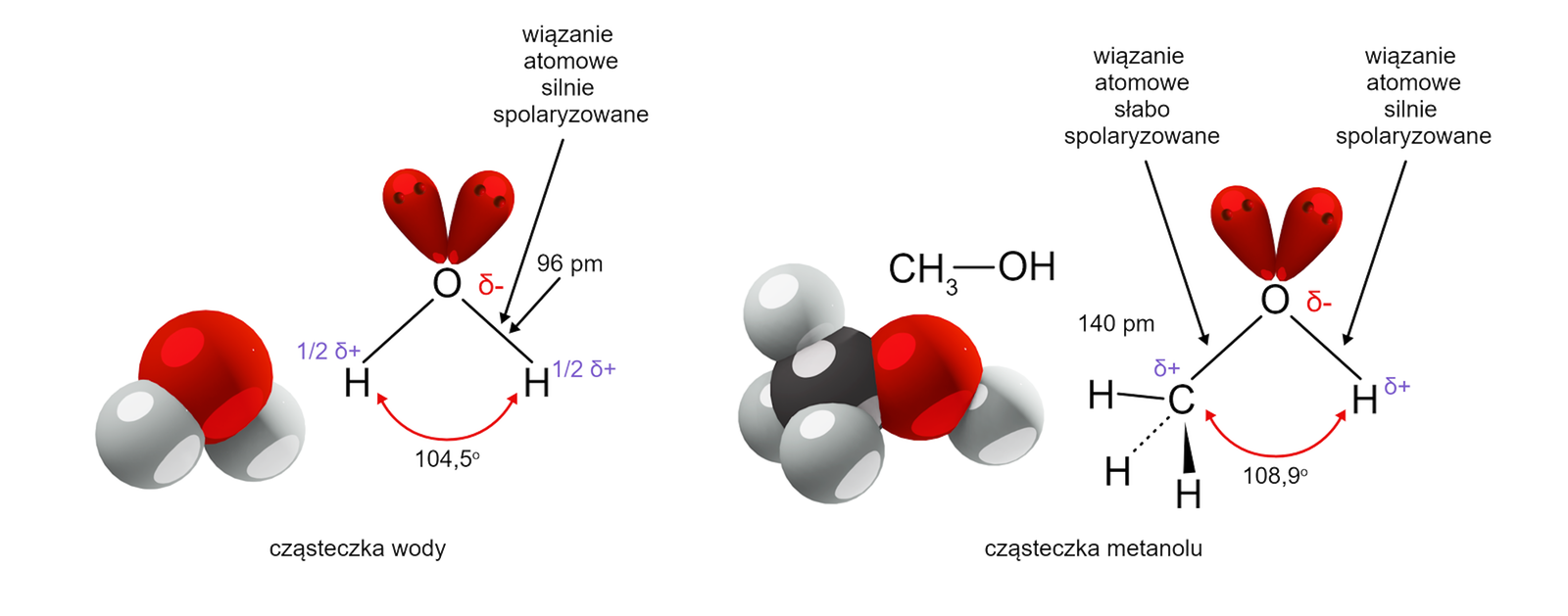
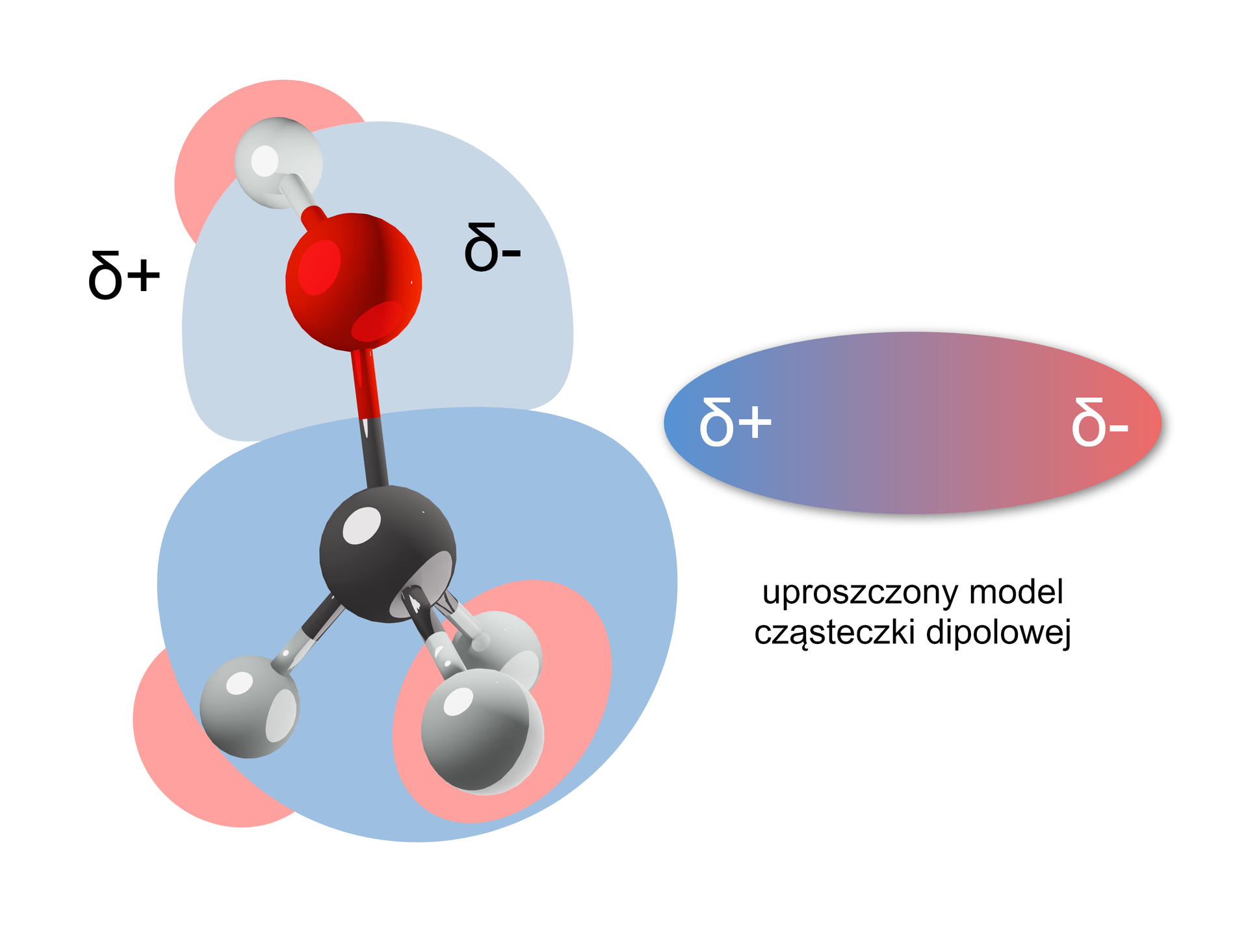
Obecność silnie spolaryzowanego wiązania determinuje właściwości fizyczne i chemiczne alkoholi. Silna polaryzacja wiązania sprawia, że cząsteczki alkoholi są dipolamidipolami.
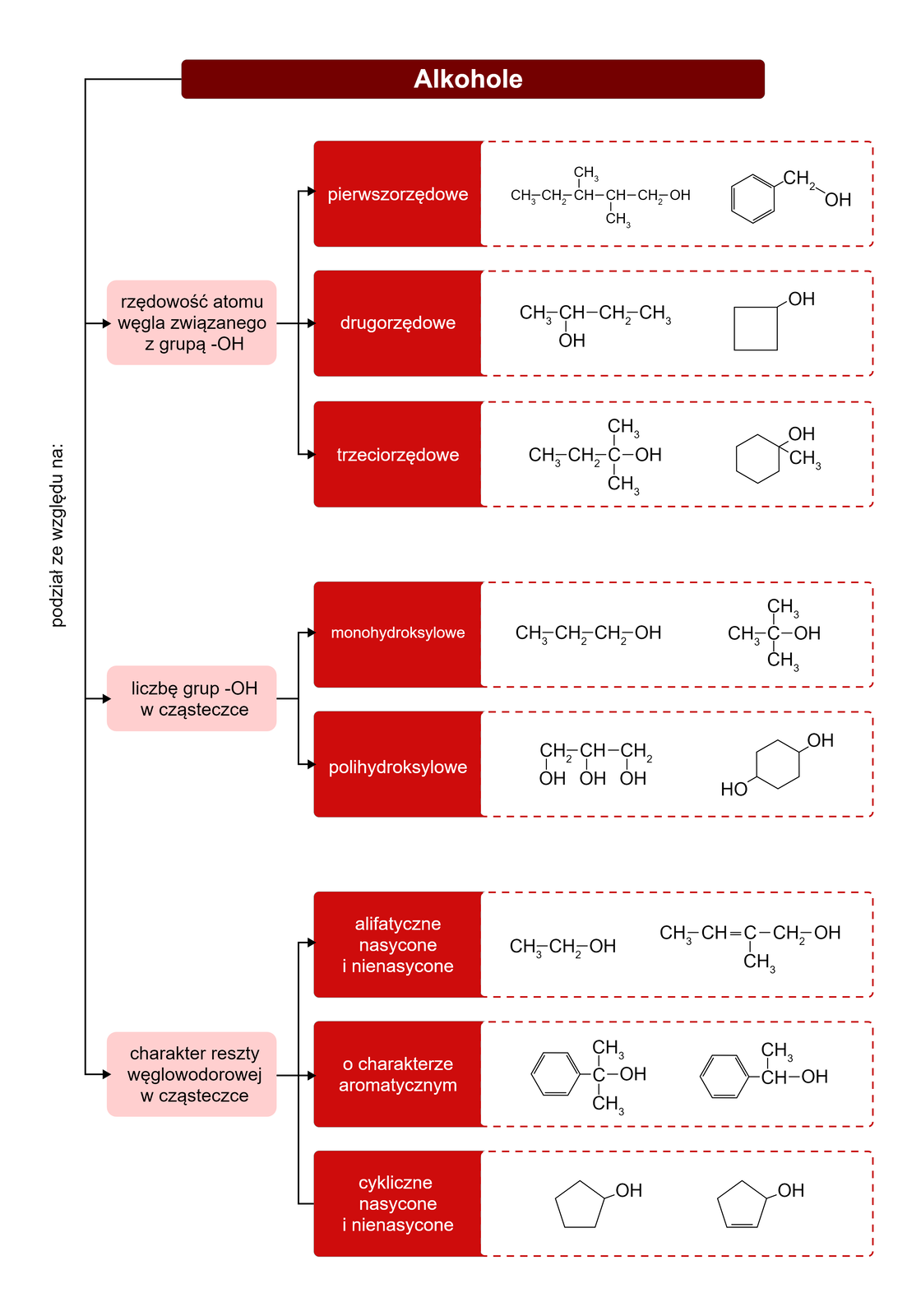
Alkohole są zróżnicowane pod względem budowy. Przykładowa klasyfikacja obejmuje te, które zawierają również reszty węglowodorowe o charakterze aromatycznym.
Słownik
(arab. al‑kuhl „delikatny proszek”) związki organiczne, pochodne węglowodorów, których cząsteczki zawierają grupę hydroksylową (związaną bezpośrednio z tetraedrycznym atomem węgla) zamiast atomu wodoru połączonego związkiem macierzystym z atomem węgla grupy alkilowej lub cykloalkilowej
rozróżnia się alkohole: pierwszorzędowe, drugorzędowe i trzeciorzędowe
zabieg matematyczny z udziałem orbitali atomowych powłoki walencyjnej danego atomu wieloelektronowego, różniących się wartościami pobocznej liczby kwantowej
właściwość substancji, która polega na zdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, gł. z wodą bądź grupami polarnymi innych związków; cecha makroskopowa materiałów, obrazująca ich zdolność do zwilżania wodą
właściwość substancji, która polega na niezdolności jej cząsteczek (lub ich części) do oddziaływania z rozpuszczalnikami polarnymi, gł. z wodą bądź grupami polarnymi innych cząsteczek; cecha makroskopowa materiałów, obrazująca ich brak zdolności do zwilżania przez wodę
cząsteczka polarna; cząsteczka biegunowa; cząsteczka dipolowa; cząsteczka utworzona z atomów o różnej elektroujemności, w której nastąpiło rozdzielenie ładunku dodatniego i ujemnego
Bibliografia
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum - poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.