Przeczytaj
Funkcja stanu
Funkcja stanu – w termodynamice – to funkcja zależna wyłącznie od stanu układu, od aktualnych wartości jego parametrów, takich jak: masa, liczność materii, temperatura, ciśnienie, objętość i inne. Jej zmiany są równe różnicy wartości funkcji w stanie końcowym i początkowym oraz nie zależą od tego, w jaki sposób zmiany zostały wykonane.
Funkcję stanu można porównać z górską wspinaczką – wysokość szczytu w stosunku do poziomu, z jakiego rozpoczynamy wspinaczkę, jest zawsze taka sama, niezależnie od tego, jaką drogą i w jaki sposób znajdziemy się na szczycie. Długość poszczególnych szlaków jest różna – długość drogi jest tzw. funkcją drogi (nie jest funkcją stanu).
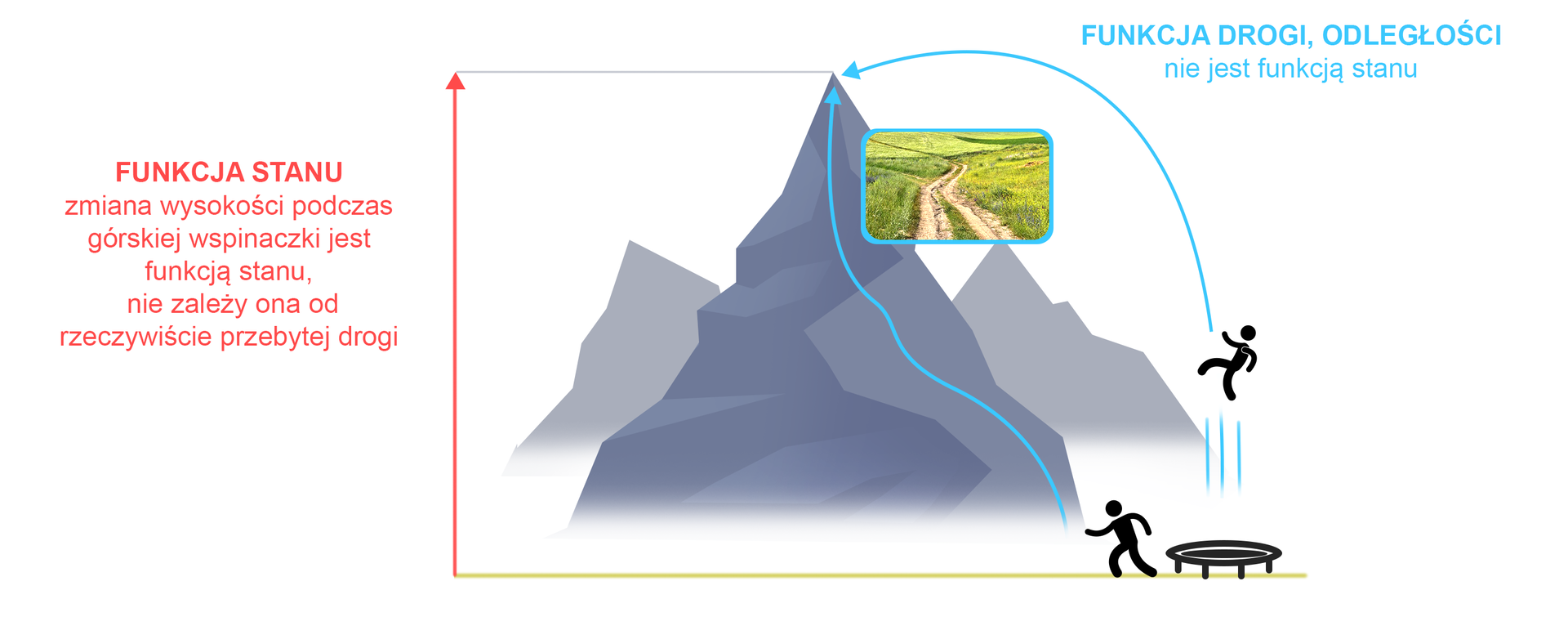
W celu lepszego zrozumienia istoty funkcji stanu i ich znaczenia w termodynamice, należy poznać pojęcia: układ termodynamiczny, otoczenie, parametry stanuparametry stanu i przemiany termodynamiczne.
Układ termodynamiczny a otoczenie
Układ termodynamiczny to część przestrzeni materialnej, która jest głównym przedmiotem rozważań. Pozostała część przestrzeni jest otoczeniem.
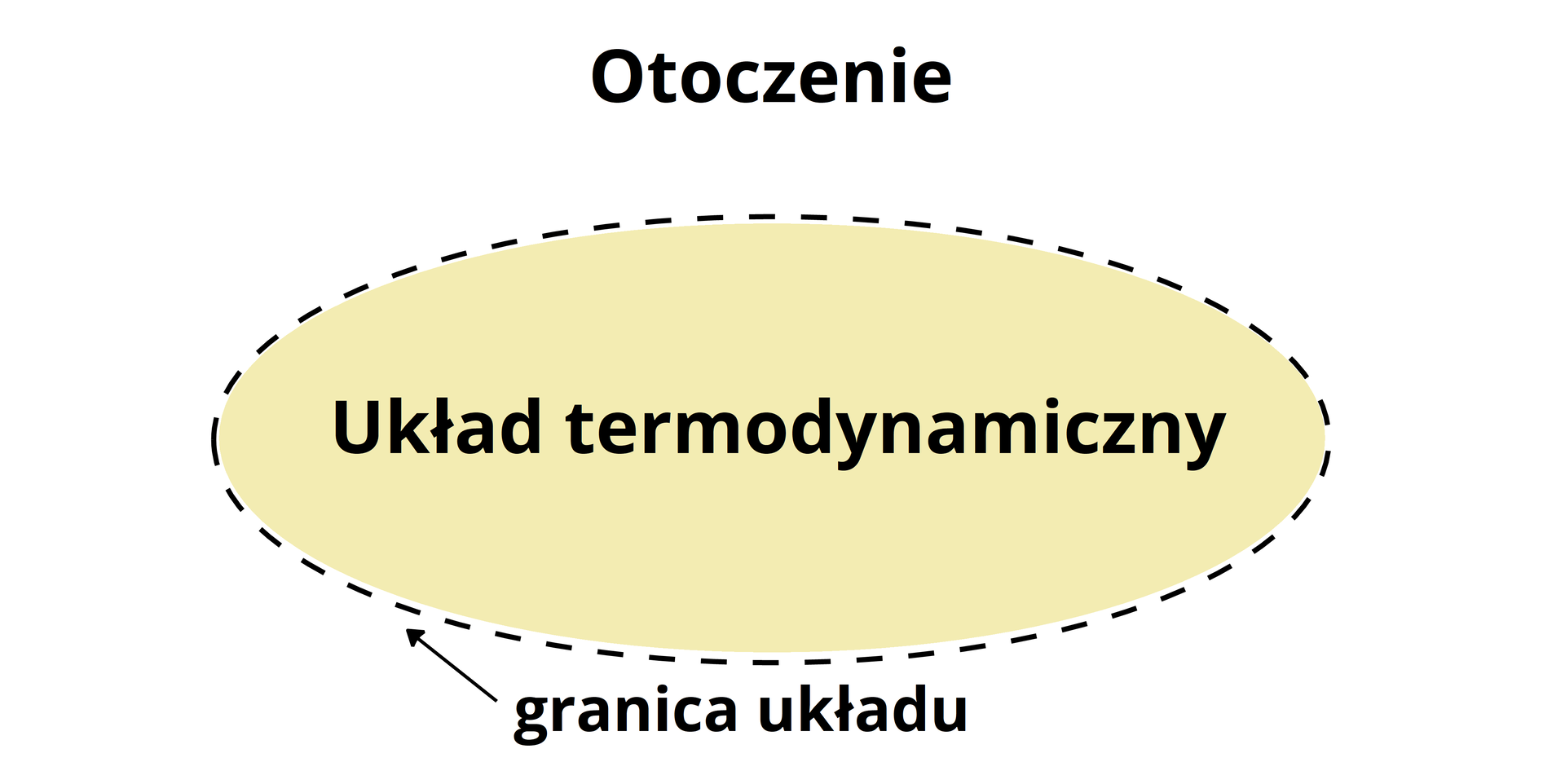
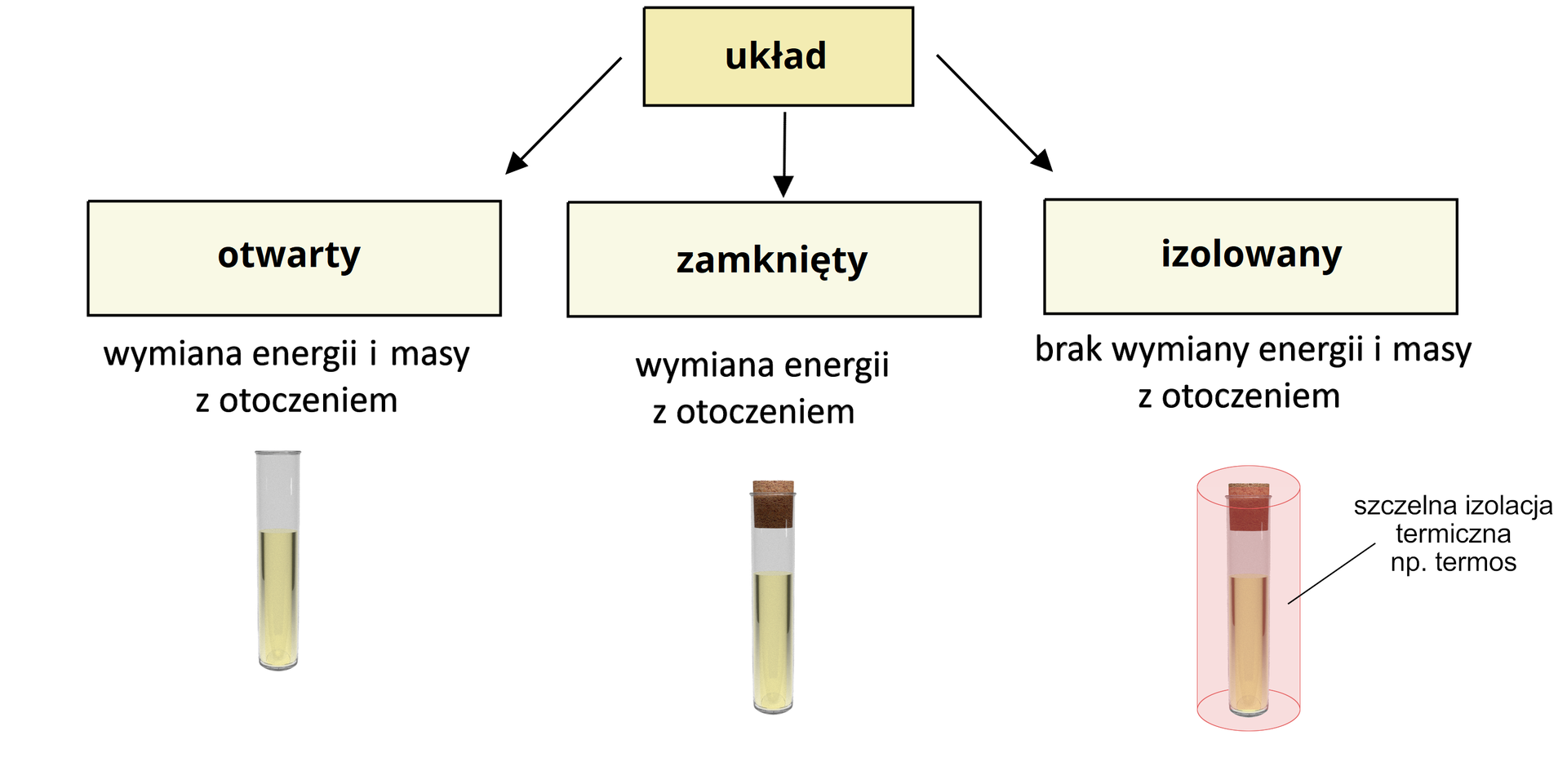
Możemy wyróżnić następujące układy termodynamiczne:
układ izolowany – niemożliwa wymiana materii i energii pomiędzy układem a otoczeniem;
układ zamknięty – możliwa wymiana energii pomiędzy układem a otoczeniem, niemożliwa wymiana materii;
układ otwarty – możliwa wymiana energii, jak i materii pomiędzy układem a otoczeniem;
układ adiabatyczny – wymiana energii tylko na sposób pracy, niemożliwa wymiana materii.
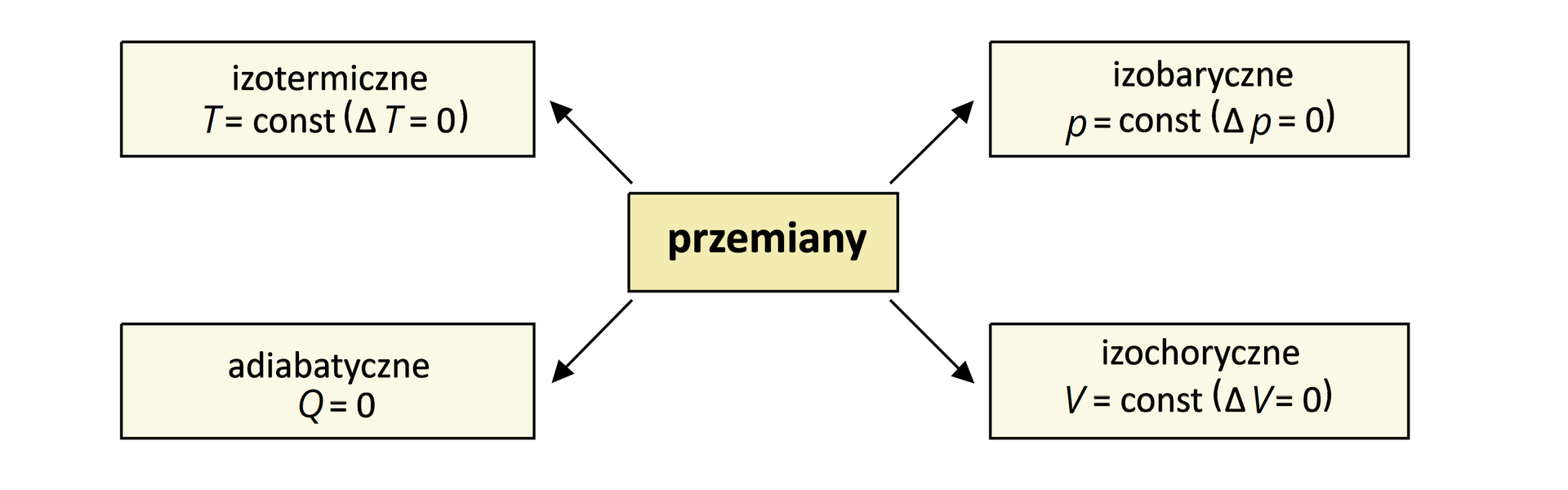
Przemiany termodynamiczne
Przemiana materii i energii może odbywać się w różnych warunkach. Zależnie od tego, czy wartość temperatury, objętości lub ciśnienia układu jest stała, możemy wyróżnić następujące przemiany termodynamiczne:
T – temperatura;
p – ciśnienie;
Q – ciepło;
V – objętość.
Przemiana, w której wymiana energii może nastąpić tylko na sposób pracy, jest przemianą adiabatyczną.
Parametry stanu
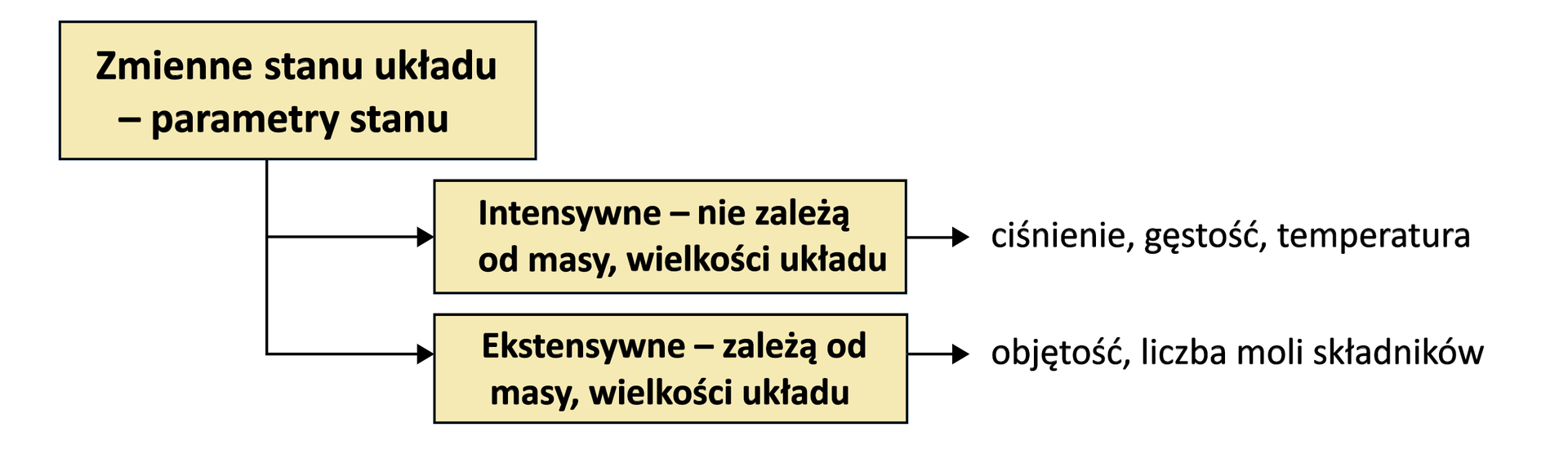
Każdy układ charakteryzuje się pewnymi wielkościami, zmiennymi – tzw. parametrami stanu, do których należą m.in.:
temperatura;
objętość;
ciśnienie;
masa.
Dodatkowo, parametry stanu dzieli się na:
ekstensywneekstensywne, np. masa, objętość, liczba moli;
intensywneintensywne, np. ciśnienie, stężenie, temperatura, gęstość.
Przykładowo, mając jeden układ, który rozdzielamy na dwa układy (w sposób zilustrowany na poniższej grafice), otrzymujemy:

Parametry, które po połączeniu lub podzieleniu ulegną zmianie, jak np. masa, objętość, to parametry ekstensywne. Te, które po połączeniu nie ulegną zmianie (jak np. ciśnienie, stężenie, temperatura), to parametry intensywne.
Termodynamiczne funkcje stanu
Układ opisują również funkcje termodynamiczne, określające jego zdolność do przejścia z jednego stanu do innego. Zmiana funkcji termodynamicznej nie zależy od drogi, lecz jedynie od stanu początkowego i końcowego układu. Dlatego funkcje termodynamiczne są funkcjami stanu. Należą do nich:
energia wewnętrzna;
entalpia;
entropia;
entalpia swobodna (dla procesów izotermiczno‑izobarycznych);
energia swobodna (dla procesów izotermiczno‑izochorycznych).
Energia wewnętrzna
Energia wewnętrzna () układu zamkniętego może być wymieniana na sposób ciepła i pracy z otoczeniem.
Gdzie:
– energia wewnętrzna;
– ciepło;
– praca.
Energia wewnętrzna jest funkcją stanu, ponieważ np. w układzie adiabatycznym (w której ) można zauważyć, że , zatem:
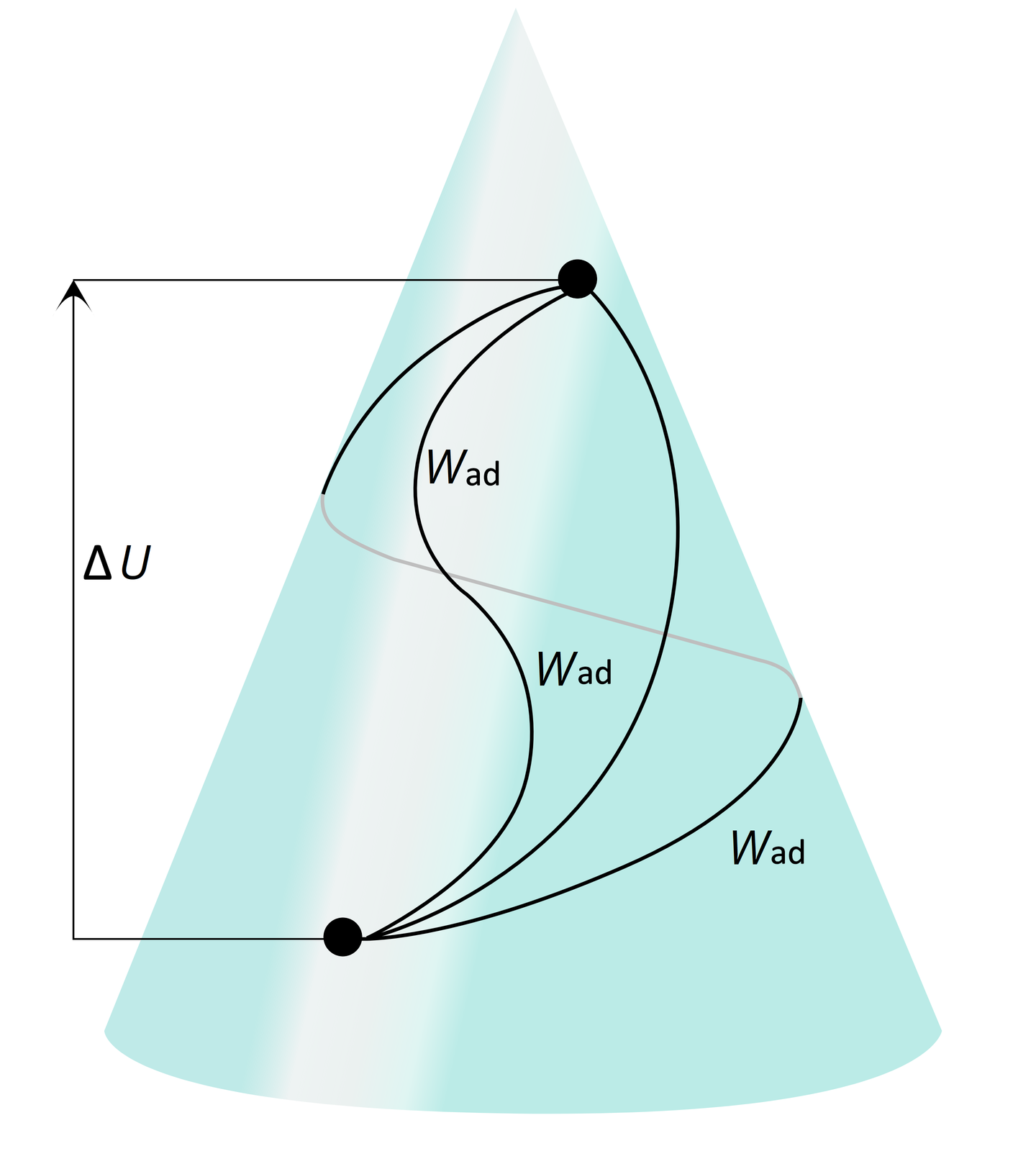
Aby wywołać taką samą zmianę energii wewnętrznej, sposób wykonania pracy jest nieważny – ważna jest tylko zmiana energii, czyli tak jak w przypadku górskiej wycieczki, liczy się tylko zmiana wysokości, która nie zależy od rzeczywiście przebytej drogi.
Entalpia
Entalpia () jest funkcją stanu i pozostaje w relacji z energią wewnętrzną układu:
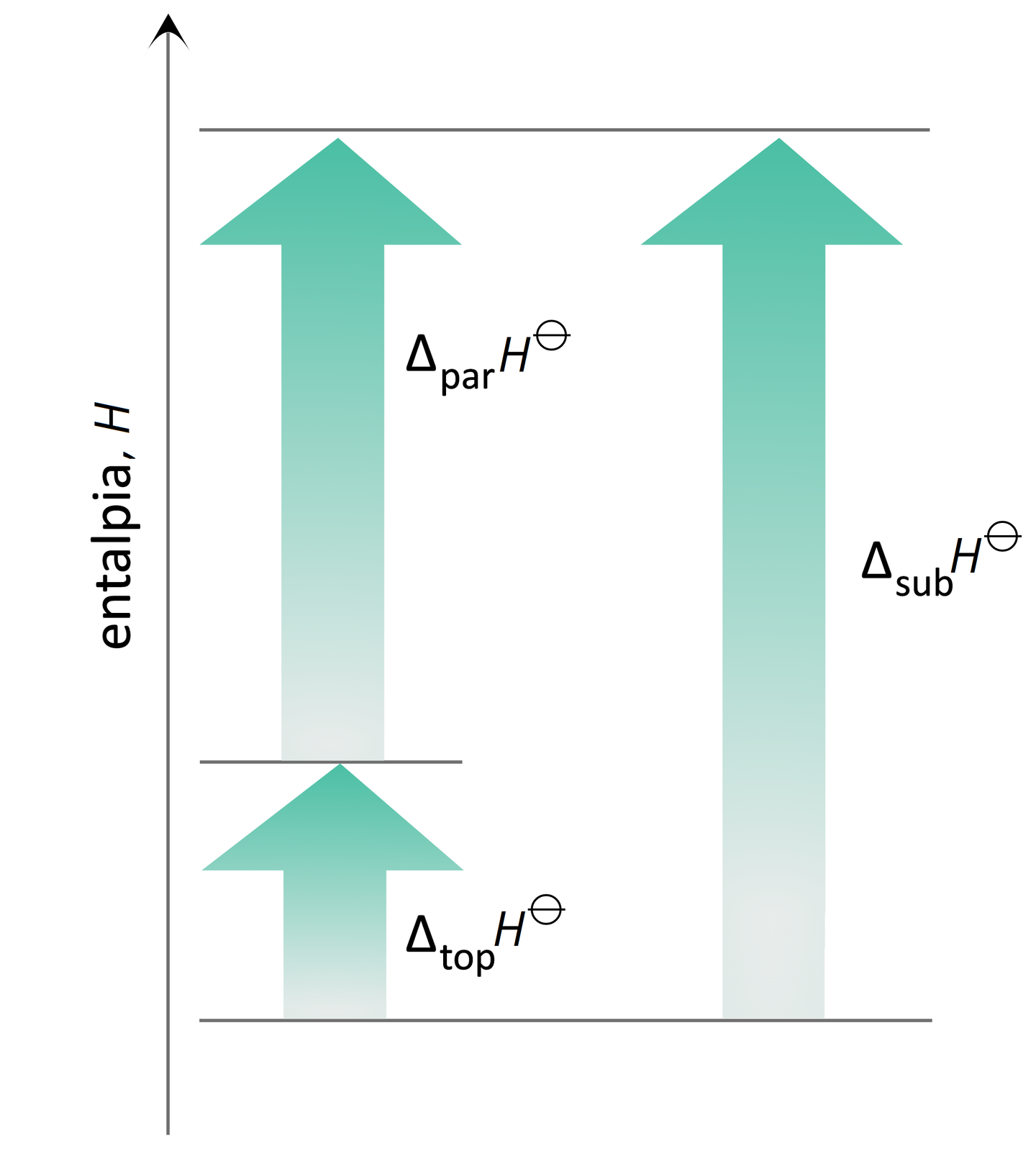
W przypadku cieczy i ciał stałych, praktycznie ze względu na małe zmiany objętości. Entalpia H jest funkcją stanu, ponieważ jej zmiana nie zależy od drogi przemiany, a jedynie od stanu początkowego i końcowego układu. Na przykład przemiana ciała stałego w gaz (sublimacjasublimacja) może być jednoetapowa albo może składać się z dwóch etapów topnienia ciała stałego, a następnie parowania cieczy. Niezależnie od wybranej drogi, pośredniej lub bezpośredniej, zmiana entalpii w układzie będzie zawsze taka sama. Wzrost entalpii sprzyja zajściu procesu czy reakcji chemicznej.
Entropia
EntropiaEntropia () jest funkcją stanu, która określa, w jakim kierunku mogą zachodzić procesy w układzie izolowanym. A mogą one zachodzić tylko w kierunku wzrostu entropii (II zasada termodynamiki). W stanie równowagi entropia przyjmuje wartość stałą, maksymalną. Entropia utożsamiana jest również z nieuporządkowaniem układu. Im bardziej nieuporządkowany jest układ, im większy chaos, tym większa jest wartość entropii.

To „nieuporządkowanie” można opisać odpowiednim wzorem. Matematycznie owa funkcja związana jest z prawdopodobieństwem znalezienia układu w danym stanie bez jakichkolwiek zmian całkowitej energii układu:
gdzie:
– stała Boltzmanna ;
– prawdopodobieństwo termodynamiczne; liczba sposobów, na jakie można opisać układ (tzw. liczba mikrostanów układu).
Chcąc udowodnić, że entropia jest funkcją stanu, należy wykazać, że jej zmiana nie zależy od drogi przemiany, a jedynie od stanu początkowego i końcowego układu. Można to wyjaśnić na przykładzie rozbitego kielicha. Przed pęknięciem znajduje się w stanie początkowym o niskiej entropii. Po rozbiciu, kielich znajduje się w stanie końcowym o wysokiej entropii, czyli o wysokim nieuporzadkowaniu. Podczas tłuczenia występują różne stany pośrednie (SIndeks dolny 22, SIndeks dolny 33) o określonej entropii, jednak całkowita zmiana entropii definiowana jako różnica między stanem końcowym i początkowym, nie zależy od stanów pośrednich:
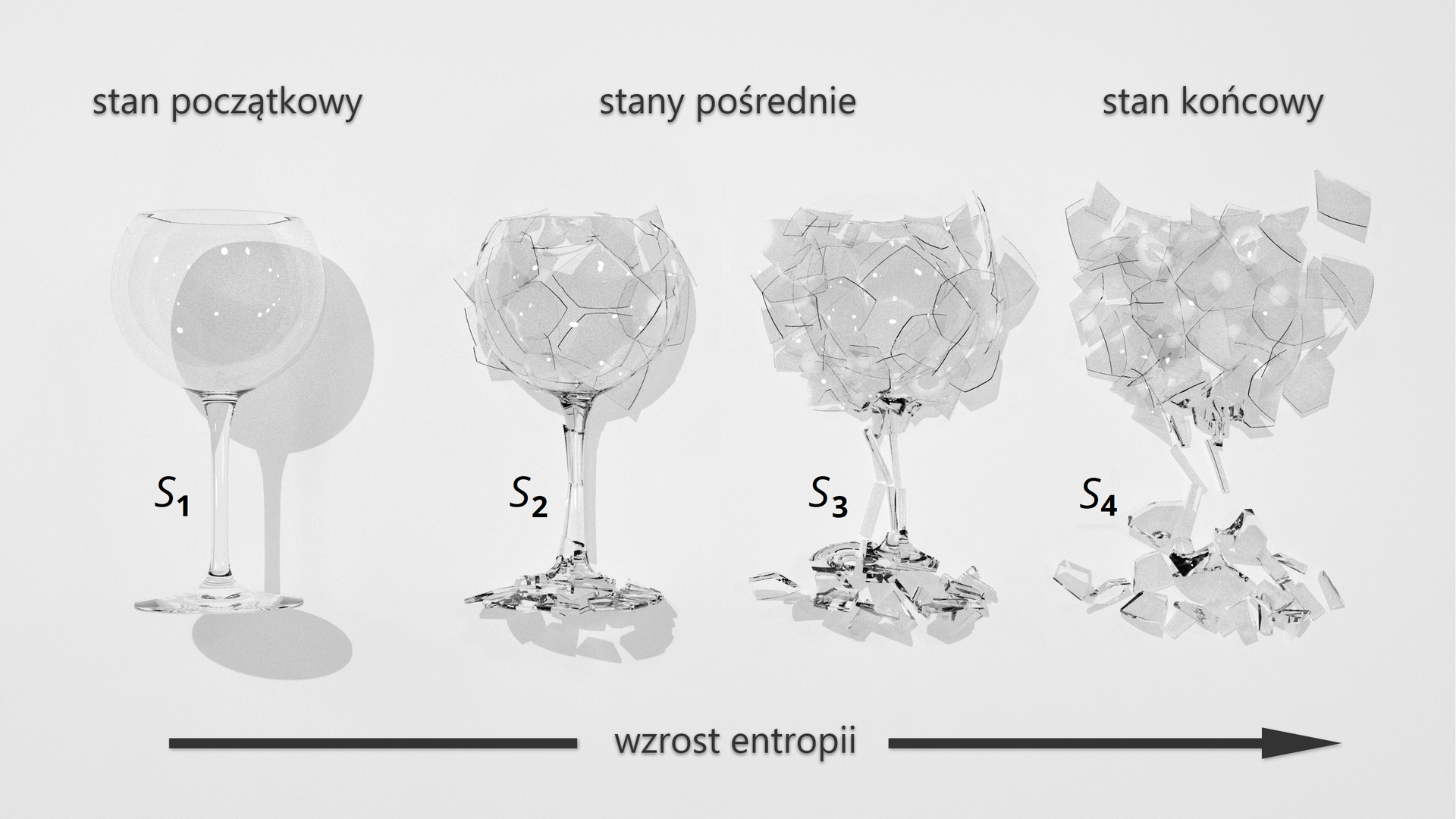
Parametry termodynamiczne układu to funkcje stanu i jego parametry stanu.
Ciepło () i praca () nie są funkcjami stanu, to tzw. funkcje drogi (lub funkcje procesu).
Entalpia swobodna
Jak już wspomniano, entropia pozwala określić kierunek przemiany chemicznej w układzie izolowanym. Co jednak w sytuacji, gdy mamy do czynienia z układem, który nie jest izolowany?
W przypadku układów izolowanych, entropia układu również ma znaczenie, jednak nie jest jedynym czynnikiem determinującym smorzutność reakcji – układ bowiem może wymieniać z otoczeniem m.in. ciepło, które może zmieniać entropię otoczenia. Jest zatem możliwe, aby proces, dla którego zmiana entropii układu jest ujemna, zachodził spontanicznie.
Jedną z wielkości, pozwalającą określić spontaniczność procesu w warunkach nieizolowanych, jest zmiana entalpii swobodnej – .
Entalpia swobodna, a dokładnie jej zmiana, pozwala określić, czy reakcja zachodzi samorzutnie w warunkach izotermiczno‑izobarycznych, czyli w stałej temperaturze i pod stałym ciśnieniem. Wyraża się ona następującym wzorem:
gdzie oznacza zmianę entalpii w trakcie reakcji, to temperatura wyrażona w kelwinach, a to zmiana entropii reakcji.
Reakcja zachodzi samorzutnie w sytuacji, gdy . Można zatem stwierdzić, że samorzutności reakcji sprzyja rosnąca wartość zmiany entropii i temperatury oraz malejąca wartość zmiany entalpii.
Jest to uzasadnione, ponieważ – jak już wspomniano – rosnąca entropia świadczy o większej skłonności do samorzutności reakcji, z kolei malejąca wartość entalpii wskazuje na egzotermiczność procesu, czyli wydzielanie ciepła do otoczenia, a tym samym podnoszenie jego entropii.
czynnik entalpowy | czynnik entropowy | zmiana entalpii swobodnej | temperatura | proces |
|---|---|---|---|---|
dla każdego i | dowolna | samorzutny – zachodzi dzięki zmianie entropii i entalpii we wszystkich temperaturach | ||
niska | samorzutny tylko w niskich temperaturach – uwarunkowany wyłącznie zmianą entalpii | |||
wysoka | niesamorzutny | |||
niska | niesamorzutny | |||
wysoka | samorzutny tylko w wysokich temperaturach – uwarunkowany wyłącznie zmianą entropii | |||
dowolna | niesamorzutny – niezależnie od temperatury |
Entalpia swobodna zależy od zmian entalpii oraz zmian entropii, które są funkcjami stanu, zatem entalpia swobodna również jest funkcją stanu.
Energia swobodna
Energia swobodna, a dokładnie jej zmiana, pozwala określić (podobnie jak miało to miejsce w przypadku entalpii swobodnej) samorzutność procesu i wyraża się ona wzorem:
Między energią swobodną () a entalpią swobodną () zachodzi zależność:
gdzie oznacza ciśnienie, z kolei symbolizuje objętość układu.
Zmiana energii swobodnej wykorzystywana jest do określania, jaka ilość energii wewnętrznej może ulec przekształceniu w pracę w warunkach nieizolowanych w trakcie procesów, które zachodzą w stałej temperaturze i w stałej objętości. Z tego powodu nie jest tak powszechnie stosowana, jak entalpia swobodna (wiele procesów zachodzi pod stałym ciśnieniem i może im towarzyszyć zmiana objętości), jednak znajduje zastosowanie do określania samorzutności procesów, którym towarzyszy zmiana ciśnienia, np. w reaktorach chemicznych, gdzie zachodzą reakcje z udziałem gazów.
Energia swobodna w warunkach izotermiczno‑izochorycznych jest funkcją stanu, gdyż zależy ona wyłącznie od zmian entropii oraz energii wewnętrznej, które również są funkcjami stanu.
Słownik
wielkości fizyczne opisujące stan układu termodynamicznego, takie jak: temperatura, ciśnienie, objętość, ilości (np. stężenia) poszczególnych substancji
funkcja termodynamiczna stanu, będąca miarą nieuporządkowania układu i rozproszenia energii
dowolna wielkość fizyczna, która nie zależy od wielkości układu, liczby cząsteczek układu lub od jego masy
dowolna wielkość fizyczna, której wartość jest proporcjonalna do rozmiarów układu, np. entropia, liczba (liczność) cząstek, ładunek elektryczny, masa, objętość, pęd; oznacza to, że wartość ta, obliczona dla układu złożonego z rozłącznych podukładów, jest sumą wartości obliczonych dla podukładów
przemiana fazowa bezpośredniego przejścia ze stanu stałego w stan gazowy z pominięciem stanu ciekłego; zjawisko odwrotne do sublimacji to resublimacja
Bibliografia
Atkins P. W., Chemia Fizyczna, Warszawa 2006.
Gumiński K., Termodynamika, Warszawa 1974, wyd. 3.
Stauffer D., Stanley H. E., Od Newtona do Mandelbrota, Warszawa 1996.
Orear J., Fizyka, Warszawa 1993.