Przeczytaj
Przemysłowe otrzymywanie kwasu siarkowego() (kwasu tetraoksosiarkowego) z pierwiastków można podzielić na etapy.
Etap
Pierwszym etapem otrzymywania kwasu siarkowego jest otrzymanie tlenku siarki() w wyniku spalania siarki w tlenie. Entalpia tworzenia tlenku siarki(), poprzez spalaniespalanie siarki w tlenie, wynosi .
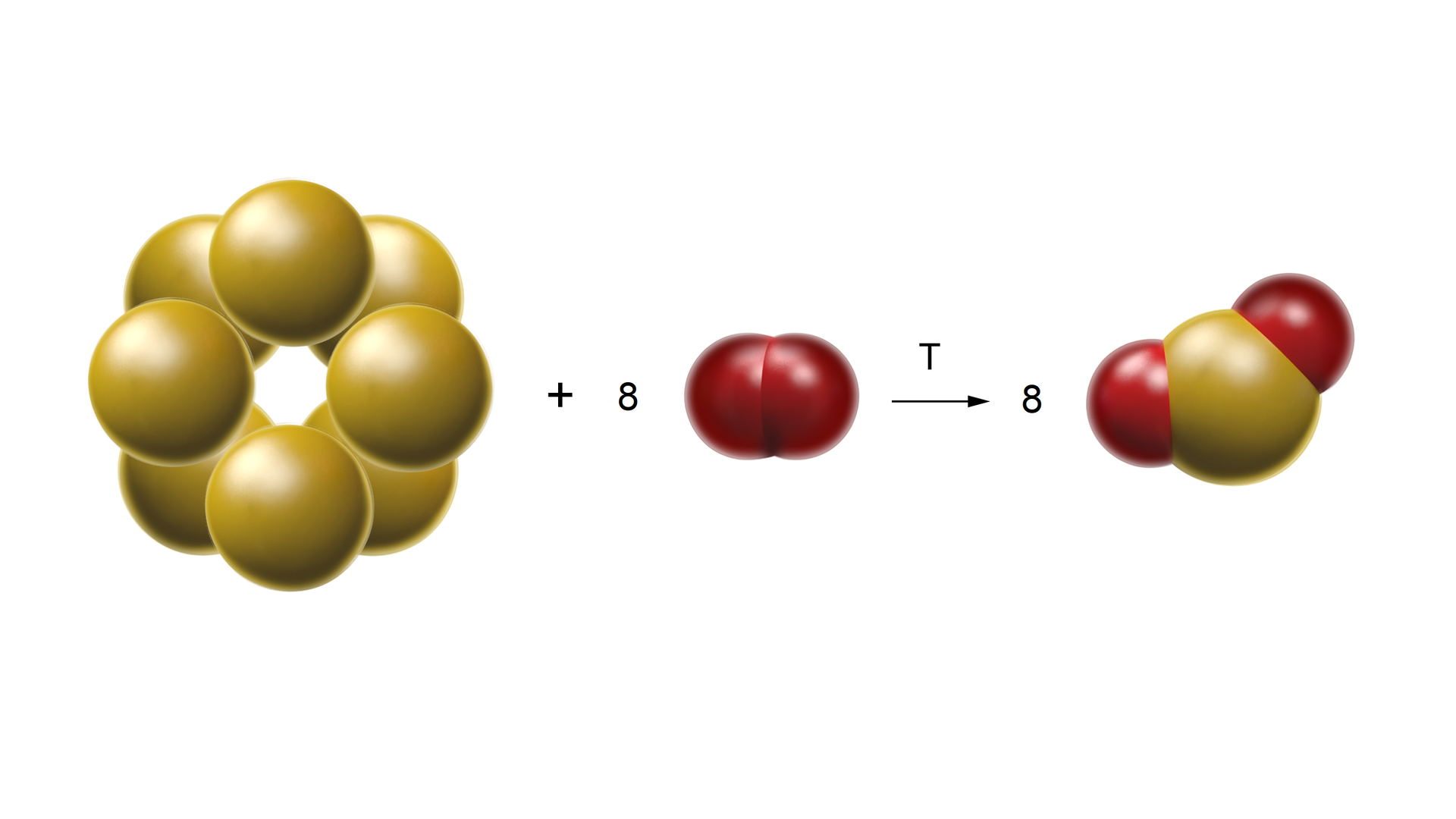
Etap
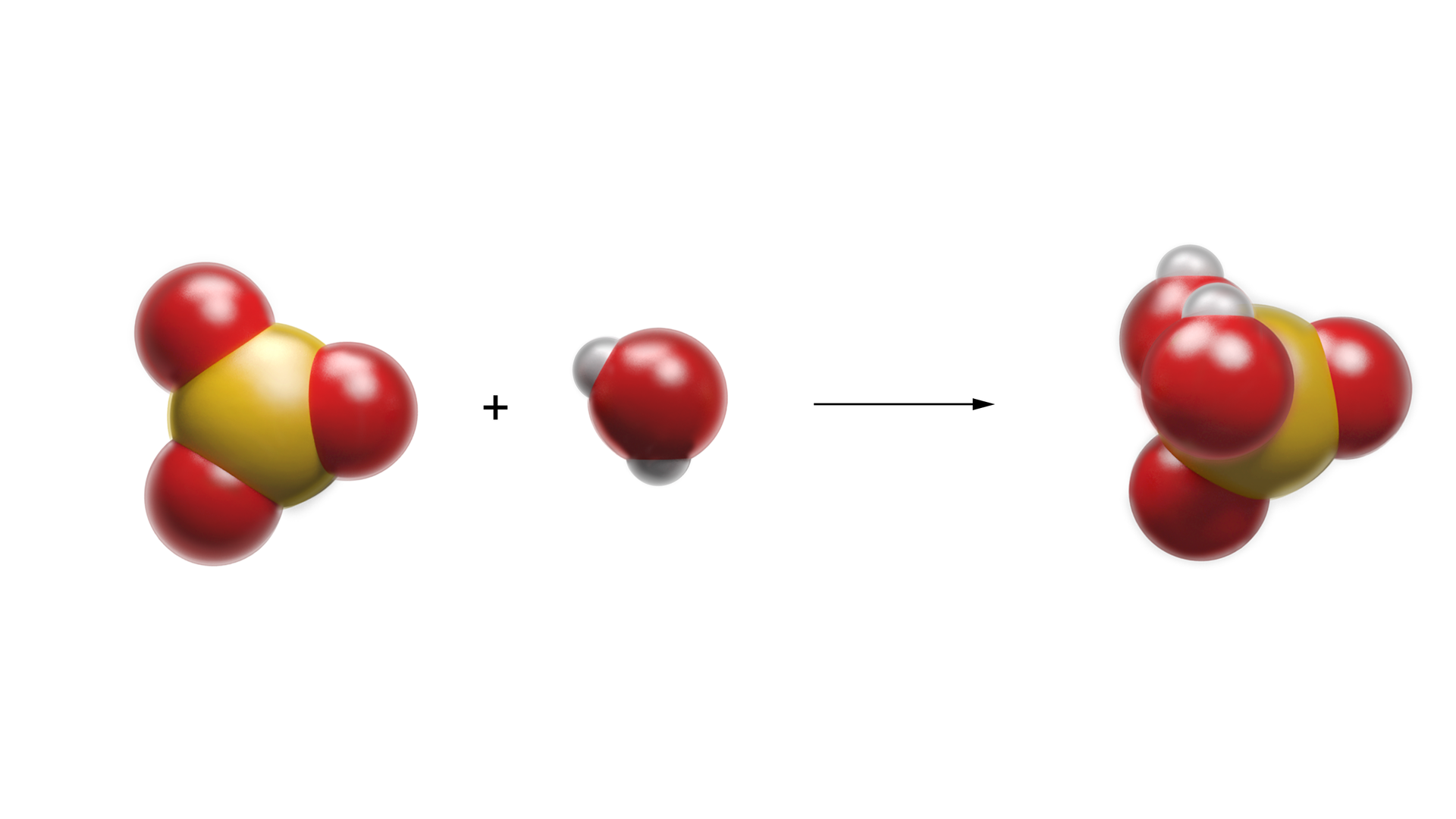
Kolejnym etapem produkcji kwasu siarkowego() jest utlenienie otrzymanego tlenku siarki() do tlenku siarki().
Reakcja utlenienia tlenku siarki() do tlenku siarki() jest reakcją odwracalnąreakcją odwracalną. Oznacza to, że przebiega ona jednocześnie w kierunku tworzenia produktów, jak i w kierunku odtwarzania substratów. Entalpia reakcji otrzymywania dwóch moli tlenku siarki() z dwóch moli tlenku siarki() i z jednego mola tlenu wynosi . Reakcja ta jest procesem egzotermicznym. Wraz z podniesieniem temperatury tlenek siarki() ulega rozkładowi na tlenek siarki(). Najlepszą temperaturą do prowadzenia procesu utleniania tlenku siarki() jest temperatura około . W tej temperaturze, po ustaleniu się równowagi między produktami a substratami, możemy otrzymać aż tlenku siarki().

Otrzymywanie tlenku siarki() w temperaturze jest procesem bardzo czasochłonnym. W celu przyspieszenia procesu stosuje się katalizator – tlenek wanadu() .
Etap
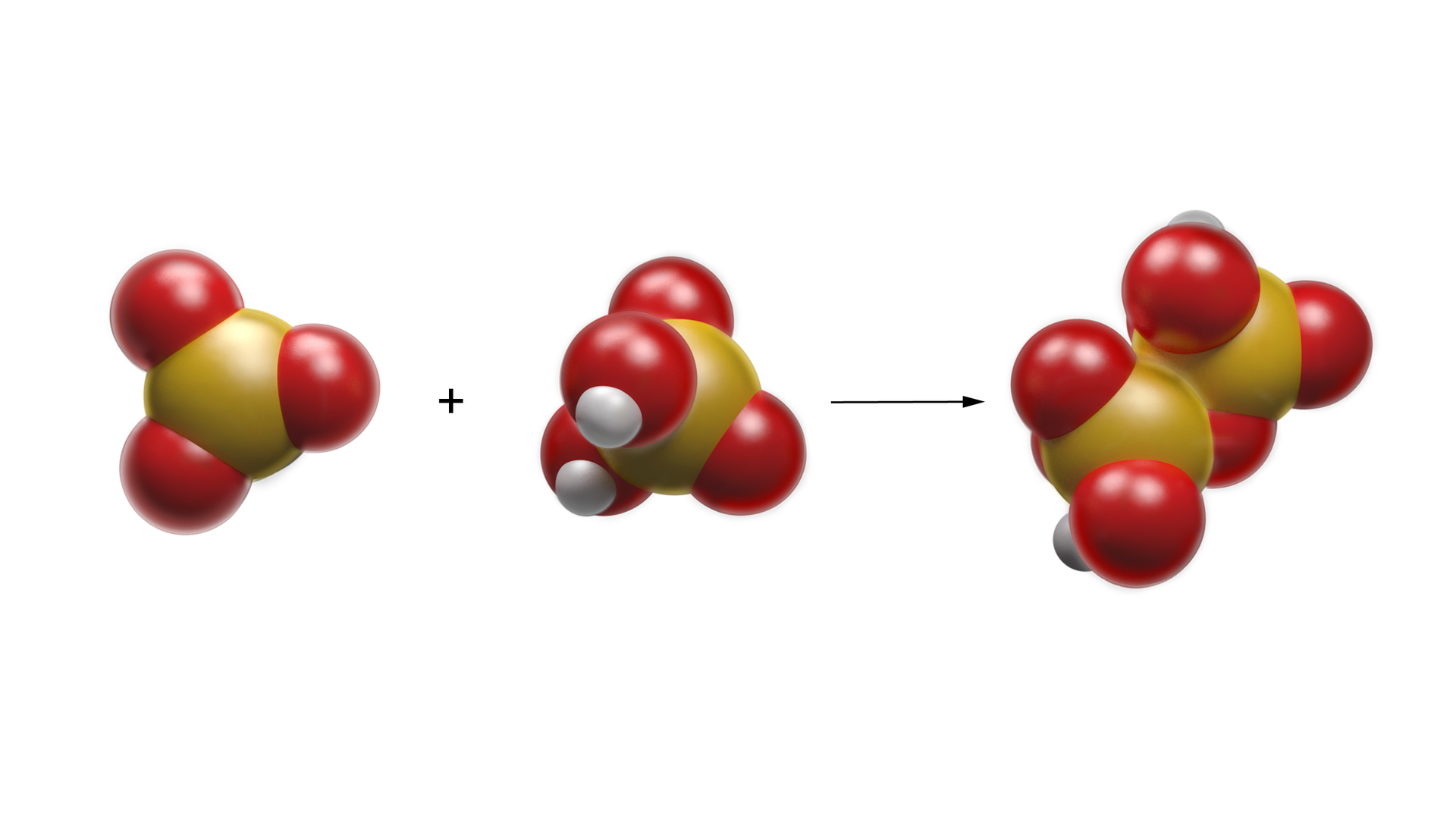
Ostatnim etapem otrzymywania kwasu jest rozpuszczenie tlenku siarki() w wodzie. Jednocześnie zachodzi reakcja egzotermiczna. W jej wyniku wydziela się duża ilość ciepła, co powoduje powstanie tzw. „mgły” kwasu siarkowego().
W praktyce przemysłowej przepuszcza się tlenek siarki() przez stężony kwas siarkowy(). W wyniku absorpcji tlenku siarki() powstaje kwas pirosiarkowy (kwas heptaoksodisiarkowy).
W wyniku rozcieńczenia roztworu kwasu heptaoksodisiarkowego otrzymujemy kwas siarkowy().
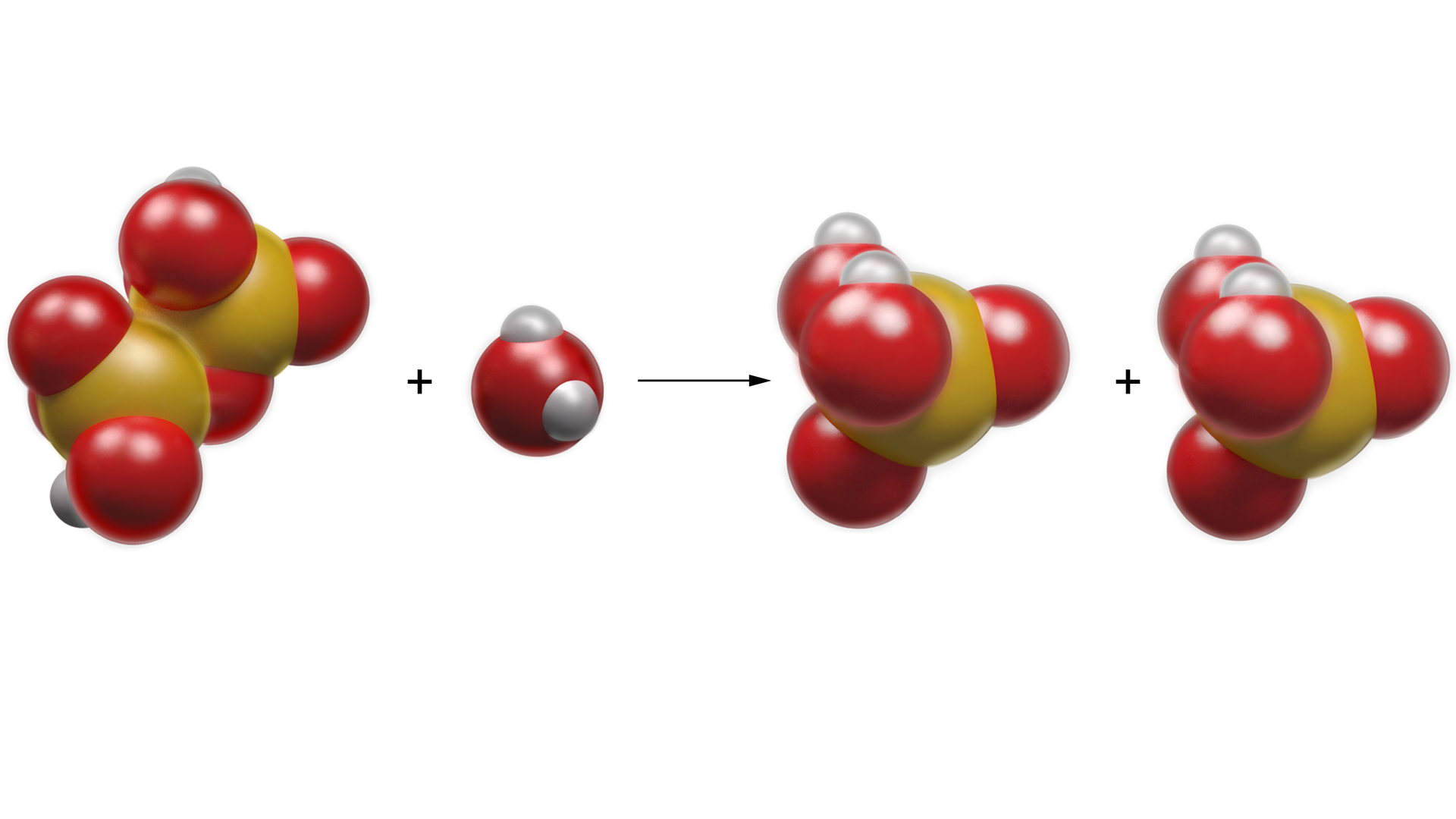
Otrzymany w ten sposób kwas przeprowadzany jest do specjalnych zbiorników – gotowych do dystrybucji.
Podsumowanie
Etapy otrzymywania kwasu siarkowego(), opisane w materiale, w przemyśle nazywane są procesem kontaktowym. W wyniku tych procesów możemy otrzymać kwas siarkowy() lub dymiący kwas siarkowy, inaczej nazywany oleum, który zawiera w sobie rozpuszczony tlenek siarki() w ilości około . Kwas siarkowy() jest substancją higroskopijnąsubstancją higroskopijną o gęstości . Podczas rozcieńczania stężonego kwasu siarkowego() zachodzi proces silnie egzotermiczny. Dlatego ważne jest, żeby podczas rozcieńczania kwasu powoli wlewać go do wody.
Słownik
(łac. absorptio „wchłanianie”) chem. wchłanianie substancji (zw. absorbatem), zwykle gazu, przez ciecz lub ciało stałe (zw. absorbentem) i równomierne zatrzymywanie absorbatu w całej masie absorbentu
efekt energetyczny reakcji tworzenia danego związku chemicznego z pierwiastków
substancje zdolne do pochłaniania pary wodnej i wody
reakcja chemiczna złożona z elementarnych procesów przebiegających jednocześnie w przeciwnych kierunkach: , w której produkty reakcji, przebiegającej z lewa na prawo, są substratami reakcji biegnącej w kierunku przeciwnym i odwrotnie
reakcja, w której dochodzi do przeniesienia jednego lub więcej elektronów od atomu, jonu lub cząsteczki donora (czyli reduktora) do akceptora (czyli utleniacza), co wiąże się ze wzrostem stopnia utlenienia donora elektronu i spadkiem stopnia utlenienia akceptora elektronu
proces fizykochemiczny, którego podstawą jest przebiegająca z dużą szybkością reakcja utleniania, polegająca na gwałtownym łączeniu się substancji spalanej (paliwa) z utleniaczem, której towarzyszy wydzielanie się dużej ilości energii i efekty świetlne
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2007.
Encyklopedia PWN
Molenda J., Technologia chemiczna, Warszawa 1997.
Rocznik Statystyczny Przemysłu 2019, Główny Urząd Statystyczny, Warszawa 2020.