Przeczytaj
Co to jest amonoliza?
Reakcja halogenopochodnych węglowodorów z amoniakiem należy do typu reakcji, zwanych amonoliząamonolizą. Jest to reakcja wymiany, zachodząca pomiędzy amoniakiem a związkiem organicznym – w tym przypadku halogenopochodną węglowodoruhalogenopochodną węglowodoru, czyli inaczej halogenkiem alkilowym. W wyniku tej reakcji powstają sole amoniowe, z których w następnym etapie otrzymuje się aminyaminy.
Indeks dolny R oznacza grupę węglowodorową, a X oznacza atom halogenu. Indeks dolny koniecR oznacza grupę węglowodorową, a X oznacza atom halogenu.
W wyniku działania wodnym lub alkoholowym roztworem amoniaku na halogenek alkilowy, następuje zastąpienie atomu halogenu (na przykład , , ) sprotonowaną grupą aminową i powstanie soli amoniowej. Pod wpływem wodnego roztworu mocnego wodorotlenku (np. ) wydziela się wolna amina.
Na przykład, w wyniku reakcji chlorometanu z amoniakiem powstaje sól metanoaminy, czyli chlorowodorek metyloaminy, który, reagując z zasadą sodową, daje metanoaminę.
Amonoliza halogenków zachodzi zgodnie z mechanizmem substytucji nukleofilowej
Amoniak pełni rolę nukleofila, ze względu na występującą wolną parę elektronową na atomie azotu. W pierwszym etapie (1) następuje atak nukleofilowy na atom węgla, obdarzony ładunkiem dodatnim, spowodowanym polaryzacją wiązania węgiel‑chlor. Powstaje wówczas związek przejściowy, w którym następuje osłabienie tego wiązania, a tworzy się nowe: węgiel‑azot. W drugim etapie (2) następuje całkowite utworzenie wiązania węgiel‑azot oraz rozerwanie wiązania węgiel‑chlor, które odchodzi jako anion chlorkowy. W tym czasie powstaje sól amoniowa, stanowiąca nowy produkt.
Otrzymywanie czystej aminy w wyniku działania na powstającą sól amoniową wodnym roztworem wodorotlenku jest reakcją kwasowo‑zasadową, polegającą na wymianie protonu (3).
Największą wydajność produktów amonolizy uzyskuje się w przypadku reakcji halogenków pierwszorzędowych z amoniakiem. W przypadku halogenków drugo- i trzeciorzędowych, reakcja substytucji nukleofilowejsubstytucji nukleofilowej konkuruje z reakcją eliminacji, przy czym eliminacja praktycznie zawsze przeważa.
Należy pamiętać, że w wyniku syntezy aminy pierwszorzędowej, z pierwszorzędowego halogenku i amoniaku, możliwe jest powstanie amin o różnej rzędowości w ciągu następujących przemian:
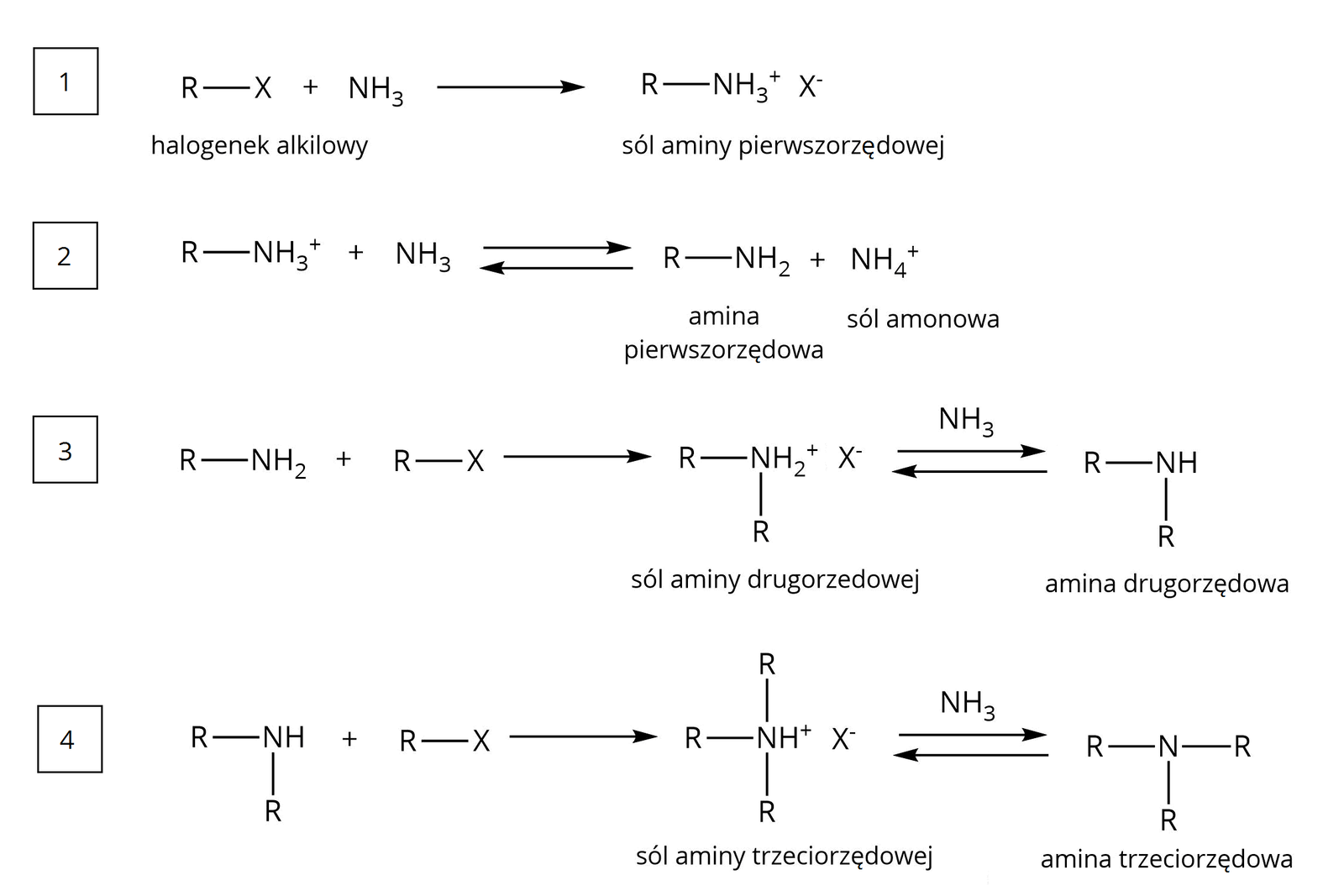
Indeks dolny R oznacza grupę węglowodorową, a X oznacza atom halogenu. Indeks dolny koniecR oznacza grupę węglowodorową, a X oznacza atom halogenu.
Dlatego reakcja halogenopochodnych węglowodorów z amoniakiem nie pozwala na otrzymanie wyłącznie aminy pierwszorzędowej bez domieszek amin o wyższej rzędowości. Aby otrzymać aminę pierwszorzędową, należy użyć nadmiaru amoniaku w stosunku do halogenopochodnej węglowodoru.
Słownik
reakcja wymiany zachodząca między amoniakiem i związkiem organicznym, na przykład bezwodnikiem kwasowym, halogenkiem kwasowym, węglowodorowym lub estrem
węglowodory, których cząsteczki zawierają jeden lub więcej atomów fluorowca: fluoru — fluoropochodne, chloru — chloropochodne, bromu — bromopochodne, jodu — jodopochodne
reakcja substytucji (podstawienia), w której czynnikiem atakującym jest nukleofil (inddywiduum z nadmiarem elektronów); substytucja nukleofilowa polega na podstawieniu grupy X związanej z atomem węgla odczynnikiem nukleofilowym; grupą X jest przeważnie grupa elektronoakceptorowa, która polaryzuje wiązanie C‑X (np. , , ), następnie odchodzi z parą elektronową
pochodne amoniaku w cząsteczce, którego jeden lub więcej atomów wodoru zostało zastąpionych grupami węglowodorowymi
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Encyklopedia PWN
McMurry J., Chemia organiczna, Warszawa 2000.
Morrison R. T., Boyd R. N., Chemia organiczna, Warszawa 1985.