Przeczytaj
Litowce są bardzo aktywnymi metalamimetalami i dlatego nie występują w przyrodzie w stanie wolnym, lecz wchodzą w skład związków chemicznych, w których występują na stopniu utlenieniastopniu utlenienia.
Konfiguracja elektronowa wybranych litowców
Litowce należą do pierwszej grupy układu okresowego. Na powłoce walencyjnej posiadają jeden niesparowany elektronelektron. Aby uzyskać konfigurację gazu szlachetnego, wystarczy odłączyć jeden elektronu. Stąd ich wysoka reaktywność. Litowce tworzą związki jonowe. Poniżej zostały zapisane konfiguracje elektronowe wybranych litowców.
Litowiec | Konfiguracja elektronowa | Konfiguracja elektronowa |
|---|---|---|
Właściwości fizyczne litowców
Litowce to bardzo aktywne chemicznie metale. Sód i potas przechowuje się w nafcie, w celu ochrony przed kontaktem ze składnikami powietrza. Z tego samego powodu rubid i cez umieszcza się w zatopionych ampułkach bez dostępu powietrza. Sód i potas to miękkie, srebrzystobiałe metale – pozostawione na powietrzu bardzo szybko matowieją, pokrywając się warstwą tlenków i węglanów. Litowce charakteryzują się niskimi temperaturami topnienia i wrzenia oraz małymi gęstościami, np. sód ma gęstość mniejszą od wody, dlatego pływa po jej powierzchni.
Otrzymywanie litowców
Litowce otrzymuje się zwykle w wyniku elektrolizyelektrolizy stopionych soli lub wodorotlenków.
Lit można otrzymać w procesie elektrolizy stopionego , potas w wyniku elektrolizy stopionych KCl lub KF, sód przez elektrolizę stopionego lub .
Przebieg elektrolizy stopionego :
luka do uzupełnienia luka do uzupełnienia luka do uzupełnienia luka do uzupełnienia
luka do uzupełnienia luka do uzupełnienia
Elektroliza stopionego
luka do uzupełnienia luka do uzupełnienia luka do uzupełnienia + luka do uzupełnienia luka do uzupełnienia
luka do uzupełnienia luka do uzupełnienia
Właściwości litowców a ich liczba atomowa
Zmiany właściwości litowców związane ze wzrostem liczby atomowej.
Właściwości litowców i ich wybranych związków
▪ dobrze rozpuszczalna w wodzie;
▪ zwykle formowana w granulki, które mają właściwości higroskopijne., ▪ biała higroskopijna substancja;
▪ dobrze rozpuszczalna w wodzie;
▪ formowana w granulki; łatwo chłonie z powietrza; jest silnie żrąca., ▪ biała, krystaliczna substancja;
▪ dobrze rozpuszczalna w wodzie., ▪ biała, krystaliczna substancja;
▪ dobrze rozpuszczalna w wodzie., ▪ biała, krystaliczna substancja;
▪ dobrze rozpuszczalna w wodzie., i ▪ bezbarwne krystaliczne substancje;
▪ dobrze rozpuszczalne w wodzie.
NaOH
▪ biała krystaliczna substancja żrąca;
▪ dobrze rozpuszczalna w wodzie;
▪ zwykle formowana w granulki, które mają właściwości higroskopijne.
KOH
▪ biała higroskopijna substancja;
▪ dobrze rozpuszczalna w wodzie;
▪ formowana w granulki; łatwo chłonie CO2 z powietrza; jest silnie żrąca.
NaCl
▪ biała, krystaliczna substancja;
▪ dobrze rozpuszczalna w wodzie.
Na2CO3
▪ biała, krystaliczna substancja;
▪ dobrze rozpuszczalna w wodzie.
NaHCO3
▪ biała, krystaliczna substancja;
▪ dobrze rozpuszczalna w wodzie.
KNO3 i NaNO3
▪ bezbarwne krystaliczne substancje;
▪ dobrze rozpuszczalne w wodzie.
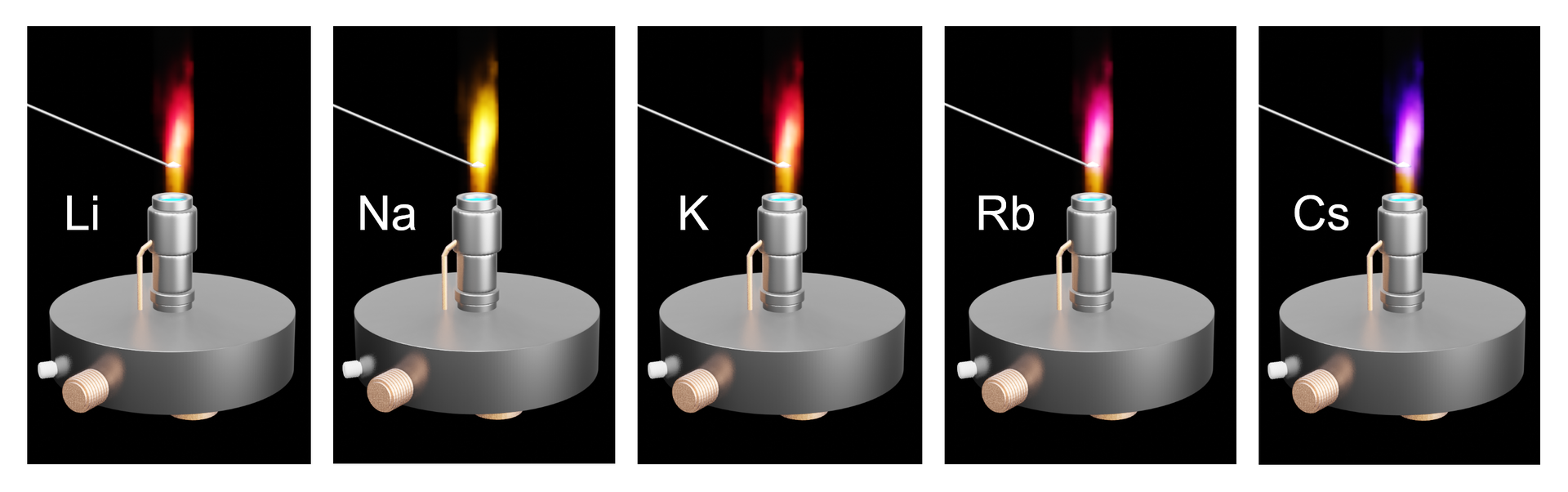
Lotne sole litowców wprowadzone do płomienia palnika barwią go w charakterystyczny sposób
Podczas wprowadzenia roztworu soli litowców do płomienia, następuje wzbudzenie atomuwzbudzenie atomu metalu, co skutkuje zabarwieniem się płomienia na odpowiedni kolor. Metodę tę wykorzystuje się do analizy kationów.
Słownik
(łac. metallum gr. métallon „kopalnia”, „kruszec”) substancje odznaczające się dobrym przewodnictwem elektrycznym i cieplnym, charakterystycznym połyskiem, dużą wytrzymałością mechaniczną oraz plastycznością
pojęcie umowne, określające liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomowi pierwiastka chemicznego, wchodzącego w skład określonego związku, gdyby cząsteczki tego związku miały budowę jonową
(gr. ḗlektron „bursztyn”), cząstka elementarna o masie i ładunku elektrycznym , występująca w dwóch stanach ładunkowych: jako ujemny – negaton, i dodatni – pozyton
(gr. ḗlektron „bursztyn”, lýsis „rozłożenie”) podstawowy proces elektrochemiczny, który polega na chemicznej przemianie składników elektrolitu (a często i materiału elektrod), przebiegającej na elektrodach pod wpływem przepływu prądu elektrycznego
atom, którego elektrony znajdują się na wyższych poziomach energetycznych niż w stanie podstawowym; przeskokowi elektronów na niższe poziomy energetyczne, podczas powracania atomu do stanu podstawowego, towarzyszy emisja kwantów promieniowania elektromagnetycznego (światła, promieniowania rentgenowskiego)
Bibliografia
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia : Liceum – poziom podstawowy i rozszerzony, Wydawnictwo Szkolne PWN, Warszawa – Bielsko–Biała .