Przeczytaj
Termodynamika
Termodynamika to dział fizyki badający efekty energetyczne przemian fizycznych i chemicznych. Pozwala on m.in. zbadać możliwość przebiegu danego procesu w określonych warunkach. Szczególnie ważnym pojęciem, związanym z tym działem, jest energia wewnętrzna, którą określa się jako całkowitą energię danego ciała. Składają się na nią:
energia ruchów oraz drgań cząsteczek, jonów i atomów;
energia oddziaływań między elektronami, jądrami atomowymi oraz elektronami z jądrami atomowymi;
energia oddziaływań między nukleonami.
Z tym działem ściśle związane są również pojęcia, takie jak układukład i otoczenieotoczenie. Na ten pierwszy składają się reagenty biorące udział w danej reakcji chemicznej (substraty oraz produkty), a na otoczenie wszystkie elementy zewnętrzne, które nie biorą udziału w danej reakcji chemicznej (np. laboratorium, zlewka reakcyjna, naukowiec itp.).
Wyróżnia się trzy typy układów:
układ otwartyukład otwarty – czyli taki, który może wymieniać z otoczeniem materię i energię (np. otwarta kolba z gorącą wodą – woda paruje,oddaje ciepło, a jej cząsteczki ulegają przeniesieniu poza układ).
układ zamkniętyukład zamknięty – czyli taki, który nie wymienia z otoczeniem materii chemicznej, lecz może wymieniać z otoczeniem energię (np. zamknięta kolba z gorącą wodą – cząsteczki nie mogą wydostać się z układu, ale woda stygnie, oddając ciepło do otoczenia).
układ izolowanyukład izolowany – czyli taki, który nie może i nie wymienia z otoczeniem ani materii, ani energii (np. termos z gorącą wodą – nie następuje wymiana ciepła, a cząsteczki nie są usuwane z układu).
Znając już ważne pojęcia dotyczące tego rozdziału, można zapoznać się z pierwszą zasadą termodynamiki, która mówi, że:
w układzie izolowanym całkowita ilość energii pozostaje stała.
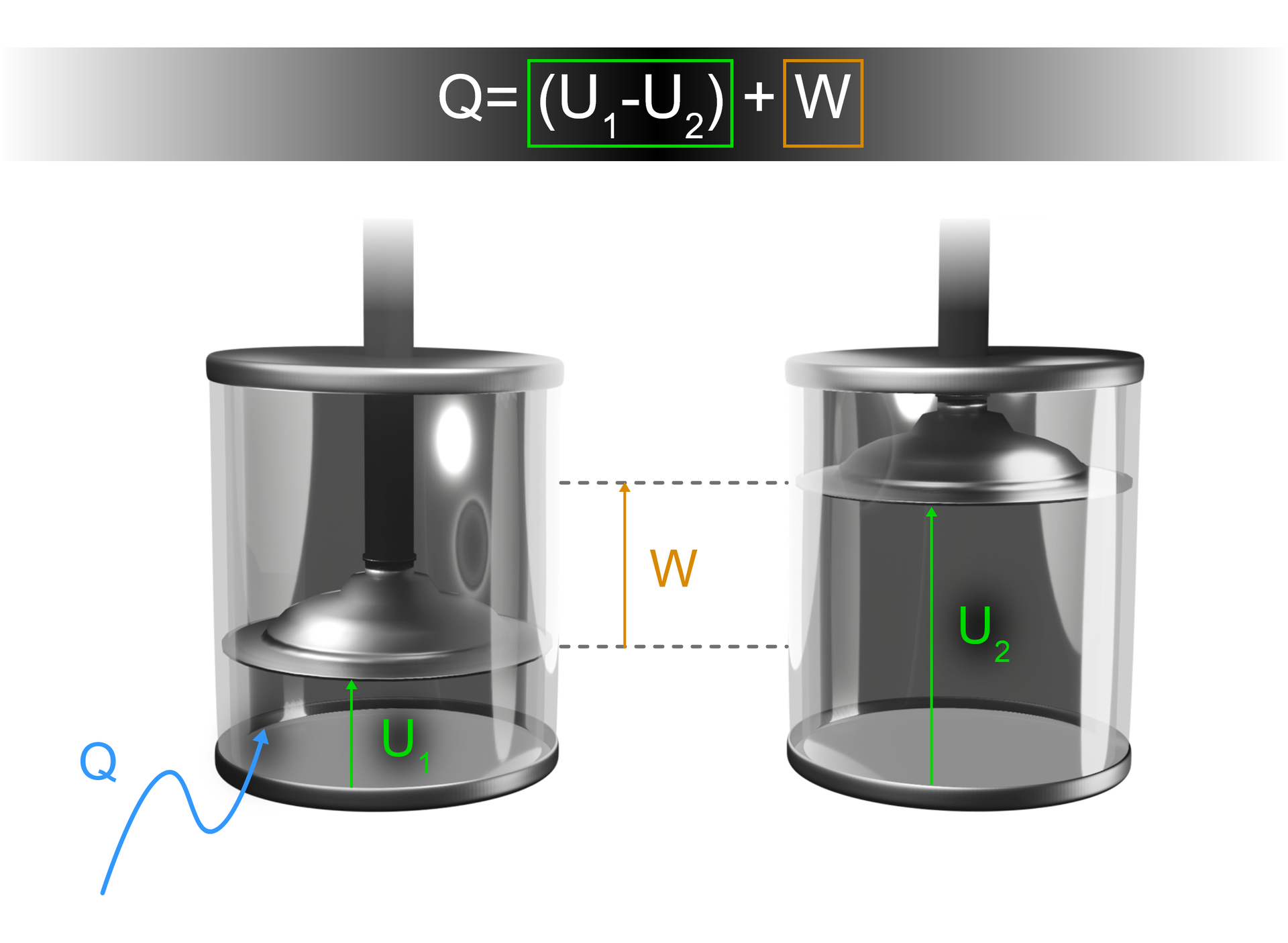
Ilość energii może jednak ulegać zmianie (i nie jest to już wtedy układ izolowany), przybierając postać energii w formie pracy lub ciepła. Innymi słowy, zmiana energii wewnętrznej układu (lub ciała) jest równa sumie dostarczonego ciepła i pracy wykonanej nad tym układem (lub ciałem), co opisuje poniższe równanie:
gdzie:
– zmiana energii wewnętrznej układu [J];
– ciepło wymienione przez układ z otoczeniem [J];
– praca wykonana nad układem oraz praca wykonana przez układ [J].
Zgodnie z powyższym równaniem, ciepło i praca dostarczone do układu są wyrażane jako wielkości dodatnie, natomiast ciepło i praca oddane przez ten układ jako wielkości ujemne.
Zasada zachowania energii
Pierwsza zasada termodynamiki nazywana jest inaczej zasadą zachowania energii, co prowadzi do następujących wniosków:
energia wewnętrzna układu jest funkcją stanu, czyli nie zależy od drogi analizowanej przemiany, lecz od stanu początkowego i końcowego;
ciepło i praca są formami przekazywania energii pomiędzy układem a otoczeniem;
energia układu izolowanego, który nie wymienia ciepła ani nie wykonuje pracy, pozostaje bez zmian ().
Przemiany termodynamiczne
Gaz doskonałyGaz doskonały to układ, który może być poddawany różnym przemianom termodynamicznym. Zastosowanie pierwszej zasady termodynamiki dotyczy przemian, w wyniku których pewne wielkości, takie jak temperatura, objętość czy ciśnienie, są stałe. Do takich przemian należą:
przemiana izotermiczna,
przemiana izochoryczna,
przemiana izobaryczna,
przemiana adiabatyczna.
Przemiana izotermiczna to taka przemiana, która zachodzi w temperaturze stałej
(). Dzięki temu cała energia, przekazana ciału w postaci ciepła, jest zużywana na wykonanie pracy przez gaz. Z równania stanu gazu wynika, że w tej przemianie ciśnienie gazu jest odwrotnie proporcjonalne do jego objętości, bowiem dla danej masy gazu wyrażonej w molach mamy:
Zależność ta nazywana jest prawem Boyle'a Mariotte'a.
Dla tej przemiany:
ponieważ:
gdzie:
– ciepło właściwe ;
– masa ciała [kg];
– zmiana temperatury [K].
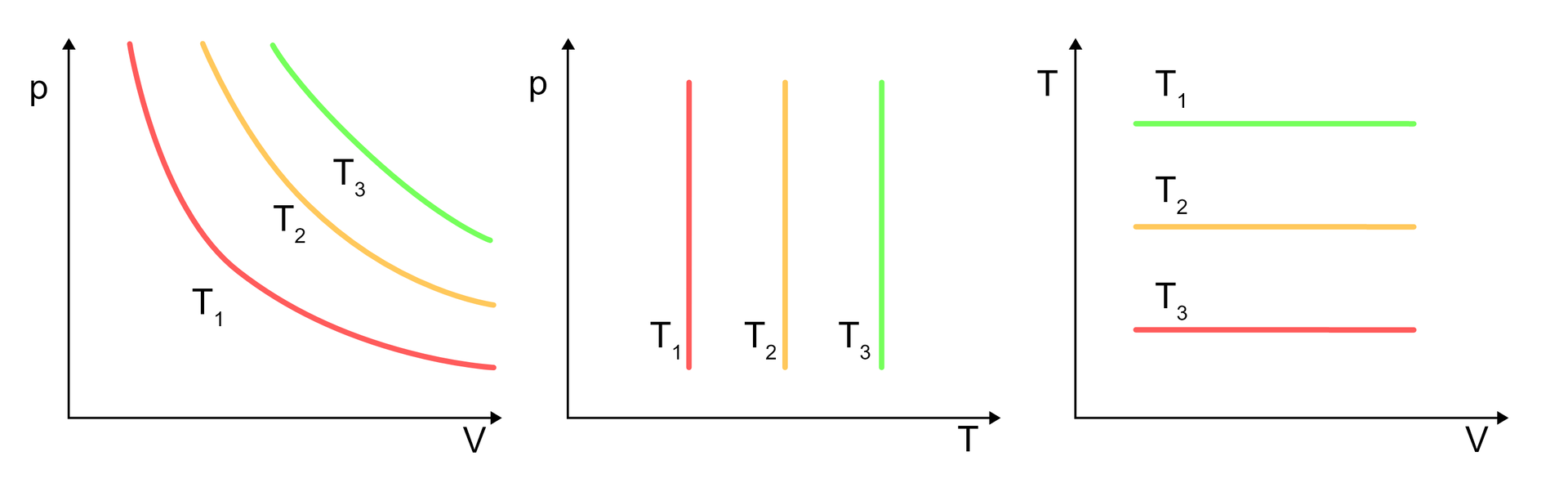
Zgodnie z powyższymi wykresami, w tej przemianie ciśnienie gazu jest odwrotnie proporcjonalne do jego objętości, dlatego mamy następującą zależność:
Przemiana izochoryczna to z kolei taka, która zachodzi w stałej objętości (). W jej wyniku dostarczone do układu ciepło jest zużywane na zwiększenie energii wewnętrznej układu, co z kolei powoduje wzrost temperatury.
Dla tej przemiany:
ponieważ:
gdzie:
– ciśnienie;
– zmiana objętości.
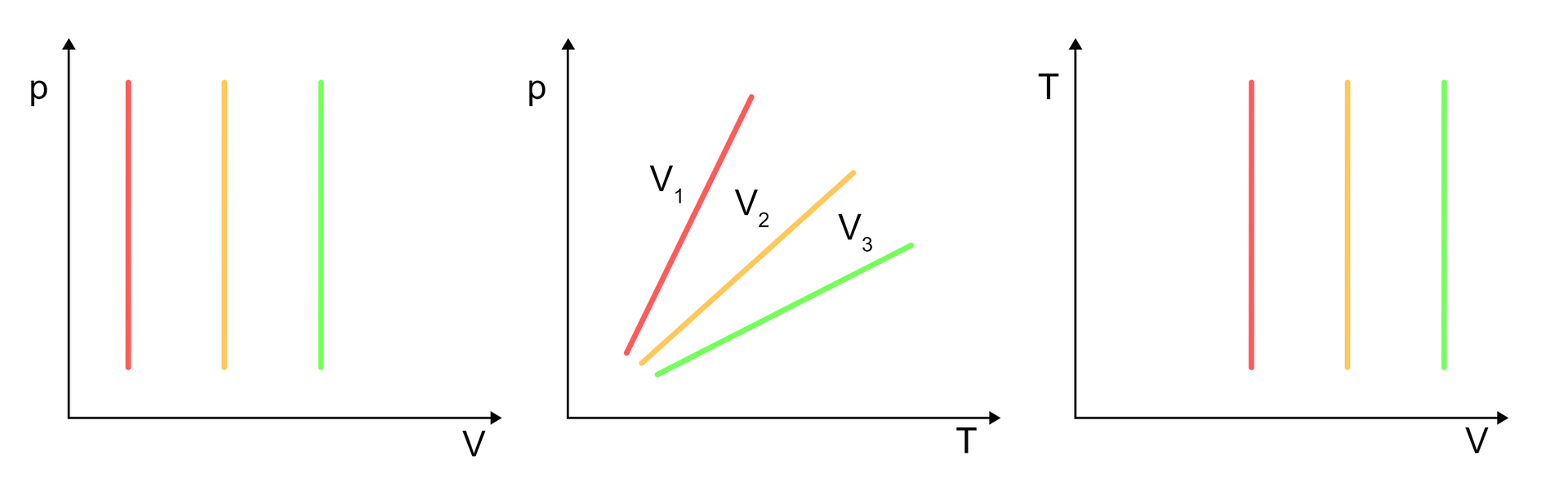
Zgodnie z powyższymi wykresami, zmianie ulegają temperatura i ciśnienie gazu, ale w taki sposób, aby stosunek ciśnienia do temperatury był stały. Wówczas mamy następującą zależność:
Przemiana izobaryczna to przemiana, która zachodzi pod stałym ciśnieniem
(). W efekcie dostarczone do układu ciepło powoduje wykonanie przez układ pracy oraz wzrost jego energii wewnętrznej.
Dla tej przemiany:
lub przy zastosowaniu pojęcia entalpiientalpii ():
gdzie:
– ciśnienie;
– zmiana objętości.
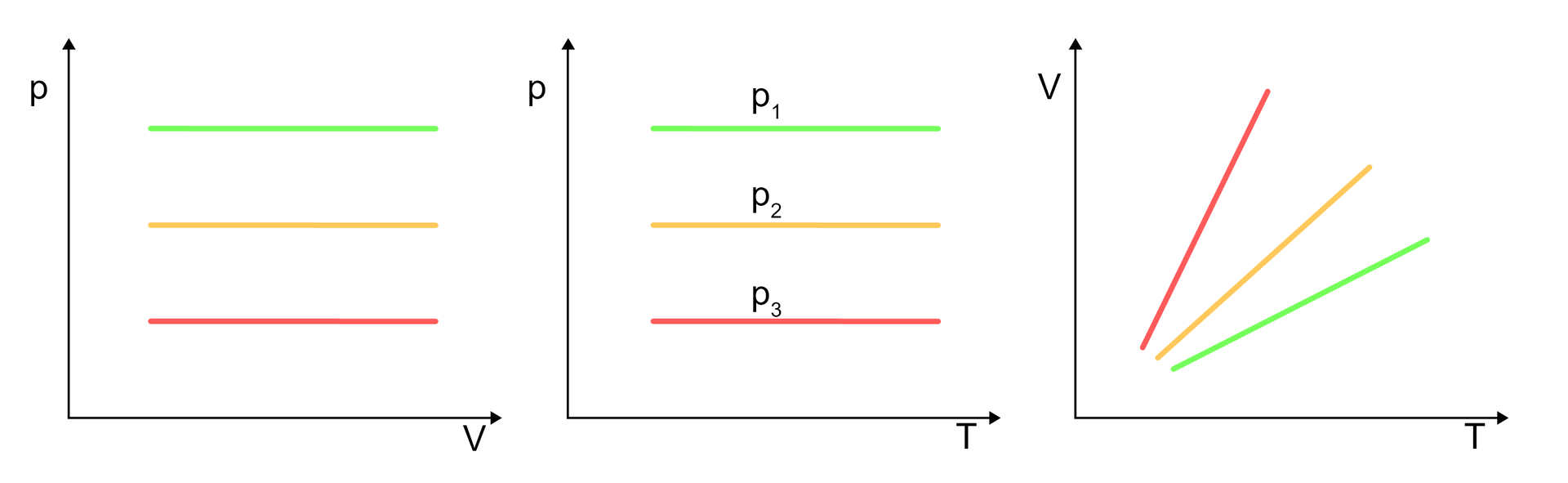
Zgodnie z powyższymi wykresami, objętość gazu jest wprost proporcjonalna do jego temperatury. Wówczas następuje zależność:
Ostatnia już przemiana adiabatyczna to ta, która zachodzi bez wymiany ciepła z otoczeniem (). W jej wyniku zmiana energii wewnętrznej gazu jest spowodowana pracą wykonaną przez siły zewnętrzne.
Dla tej przemiany:
lub przy zastosowaniu równaniu Poissona:
– ciepło właściwe gazu przy stałym ciśnieniu;
– ciepło właściwe gazu przy stałej objętości.

Słynne perpetuum mobile (z łac. „wiecznie poruszające się”) to, jak zapewne wiesz, hipotetyczna maszyna. Możliwość jej działania poprzez wytwarzanie pracy w nieskończoność zaprzecza paradygmatom współczesnej fizyki. Urządzenie to miało wielu zwolenników, a wzmianek na jej temat można się już doszukiwać w XIII wieku. Sam Leonardo da Vinci stworzył projekt tego słynnego urządzenia. Pomimo wielkiego zainteresowania jego konceptem, nikomu, aż do czasów współczesnych, nie udało się skonstruować maszyny, która zaprzeczałaby prawom fizyki, a przede wszystkim, opisanej w tym rozdziale, pierwszej zasadzie termodynamiki.
Słownik
ciepło pochłaniane lub wydzielane w czasie reakcji chemicznej, które zostało zmierzone w stałych warunkach ciśnienia i temperatury w stosunku do reagentów
wszystkie substancje biorące udział w danej reakcji chemicznej
układ reakcyjny, który może wymieniać z otoczeniem materię i energię
układ, który nie wymienia z otoczeniem materii chemicznej, lecz może wymieniać z nim energię
układ, który nie może i nie wymienia z otoczeniem ani materii, ani energii
wszystkie elementy zewnętrzne, które nie biorą udziału w reakcji, czyli nie należą do układu
tzw. fizyczny model gazu, który nie wykazuje oddziaływań międzycząsteczkowych (poza odpychaniem), a objętość jego cząsteczek, w porównaniu do objętości gazu, jest znikoma, zderzenia cząsteczek są idealnie sprężyste, a cząsteczki są w ciągłym, chaotycznym ruchu
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.