Przeczytaj
Stała dysocjacji
Procesy równowagowe opisywane są za pomocą stałych równowagi reakcji. W stanie równowagi chemicznej stosunek iloczynu stężeń produktów do iloczynu stężeń substratów jest wielkością stałą, charakterystyczną dla danej reakcji (w danej temperaturze) i nosi nazwę stałej równowagi.
Stałą równowagi reakcji opisującej proces dysocjacji oznaczamy literą . Dla reakcji odwracalnej:
wyrażenie na stałą równowagi reakcji dysocjacji ma postać:
Gdzie:
– stała równowagi reakcji dysocjacji;
, , – równowagowe stężeniarównowagowe stężenia molowe.
Wielkość oznacza, że (w określonej temperaturze) w stanie równowagi stosunek iloczynu stężeń jonów oraz , powstałych w wyniku dysocjacji elektrolitycznej, do stężenia cząsteczek niezdysocjowanych jest wielkością stałą.
W przypadku dysocjacji w środowisku wodnym uwzględnia się również we wzorze wodę, której stężenie zapisuje się w mianowniku:
Stężenie wody w roztworach rozcieńczonych jest praktycznie wielkością stałą, dlatego można pomnożyć obie strony powyższego równania przez tę wartość, w wyniku czego otrzymuje się nową stałą – stałą dysocjacjistałą dysocjacji (również zapisywaną jako , w tej sekcji dla odróżnienia od stałej równowagi zapisywana będzie jako ):
Dla stałej dysocjacji kwasówkwasów w indeksie dolnym przy zapisujemy „a” – skrót pochodzi od angielskiego słowa acid, po polsku kwas – . Stałą dysocjacji zasad zapisujemy jako , gdzie „b” jest to skrót od angielskiego słowa base – zasadazasada.
W czasie dysocjacji słabych elektrolitów, np. słabych kwasów, nie wszystkie cząsteczki ulegają przemianom w jony. Ustala się zatem równowaga, którą dla słabych kwasów jednoprotonowych możemy zapisać w następujący sposób:
Gdzie:
– stała dysocjacji słabego kwasu;
, , , – równowagowe stężenia molowe.
Również amoniak rozpuszczony w wodzie nie ulega całkowitej, a tylko częściowej dysocjacji. Pomiędzy jonami powstałymi w czasie dysocjacji a cząsteczkami niezdysocjowanymi ustala się równowaga:
Gdzie:
– stała dysocjacji słabej zasady;
, , , – równowagowe stężenia molowe.
Stała dysocjacji jest wielkością bezwymiarową i dlatego wartości i w obliczeniach podaje się bez jednostki. Należy jednak pamiętać, że wartości stałych dysocjacji obliczane są w odniesieniu do stężeń molowych.
Stała dysocjacji a temperatura
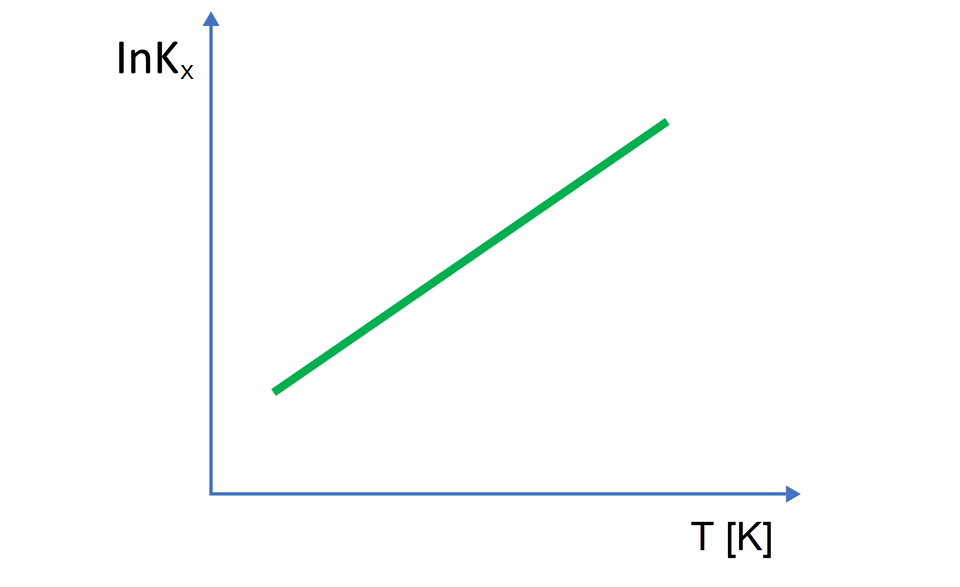
Co istotne, wartość stałej dysocjacji zależy tylko od temperatury, a nie od stężenia elektrolituelektrolitu. Wraz ze wzrostem temperatury (reakcja endotermiczna), dysocjacja staje się łatwiejsza, a więc większe jest stężenie produktów dysocjacji. Tym samym rośnie wartość stałej dysocjacji. Zależność stałej dysocjacji od temperatury określa równanie:
gdzie:
– stała dysocjacji;
– stała charakterystyczna dla danej reakcji;
– ciepło reakcji ;
– stała gazowa, odpowiadająca wartości ;
– temperatura .
Można zatem zauważyć, że pobieranie ciepła do układu, w którym przebiega reakcja dysocjacji, oznacza jego przyrost, a tym samym rośnie temperatura. W tym wypadku wartość przyjmuje wartości dodatnie. Po podstawieniu dodatniej wartości do przedstawionego powyżej równania, zaobserwujemy wzrost wartości wraz ze wzrostem temperatury. Zależność taką prezentuje poniższy wykres.
Stała dysocjacji kwasów wieloprotonowych
Dla kwasów wieloprotonowych – dysocjujących wieloetapowo – można zauważyć, że stała dysocjacji pierwszego etapu () jest największa, a wartości kolejnych stałych dysocjacji się zmniejszają. Można to tłumaczyć tym, że w pierwszym etapie jon wodorowy odłącza się od cząsteczki elektrycznie obojętnej, natomiast w drugim etapie i każdym kolejnym musi oddysocjować od jonów naładowanych ujemnie, co jest znacznie trudniejsze. Tym samym widać wyraźnie, że w etapie pierwszym kwas dysocjuje w dużo większym stopniu niż w etapie drugim jon. W takim razie najbardziej intensywny jest etap dysocjacji, a każdy kolejny zachodzi coraz słabiej.
etap:
etap:
etap:
Jak wynika z powyższych zapisów, poszczególne etapy dysocjacji charakteryzują kolejne stałe dysocjacji, przy czym:
Dodatkowo ilości jonów z poszczególnych etapów dysocjacji są różne, przy czym najmniej jonów pochodzi z ostatniego etapu dysocjacji.
Stała dysocjacji a moc elektrolitu
Im większa wartość stałej dysocjacji, tym mocniejszy kwas lub zasada. Aby porównać moc kwasu, w przypadku kwasów wieloprotonowych, wybieramy pierwszą stałą dysocjacji (), przyjmując, że większość jonów pochodzi z pierwszego etapu dysocjacji. Dla przykładu, porównując wartości odpowiednich stałych dysocjacji, można stwierdzić, że azotowy() jest kwasem mocniejszym od kwasu węglowego , ale słabszym od kwasu chlorowego() .
Kwas nieorganiczny | Stała dysocjacji lub |
|---|---|
Zasada | Stała dysocjacji |
|---|---|
Indeks górny Źródło: Ł. Banasiak, J. Filipska, A. Grabowska, T. Ishikawa, M. Mroczek Wybrane wzory i stałe fizykochemiczne na egzamin maturalny z biologii, chemii i fizyki, Warszawa 2022. Wybrane wzory i stałe fizykochemiczne na egzamin maturalny z biologii, chemii i fizyki, Warszawa 2015. Indeks górny koniecŹródło: Ł. Banasiak, J. Filipska, A. Grabowska, T. Ishikawa, M. Mroczek Wybrane wzory i stałe fizykochemiczne na egzamin maturalny z biologii, chemii i fizyki, Warszawa 2022. Wybrane wzory i stałe fizykochemiczne na egzamin maturalny z biologii, chemii i fizyki, Warszawa 2015.
Obliczanie stałej dysocjacji
Stałą dysocjacji można obliczyć, znając stopień dysocjacjistopień dysocjacji. Tę zależność przedstawia Prawo rozcieńczeń Ostwalda. Można je przedstawić jako matematyczną interakcję pomiędzy stałą dysocjacji elektrolitu a jego stopniem dysocjacji w roztworze o stężeniu całkowitym (wyjściowym) :
W przypadku gdy
Wzór ten pozwala zatem wyznaczyć wartość stałej dysocjacji w sytuacji, gdy znany jest stopień dysocjacji roztworu oraz jego stężenie początkowe
Podsumowanie
Podsumowując informacje o stałej dysocjacji, należy zapamiętać, że:
stała dysocjacji jest wartością bezwymiarową;
wartość stałej dysocjacji nie zależy od stężenia elektrolitu tylko od temperatury;
wartość stałej dysocjacji jest miarą mocy kwasów i zasad;
im wyższa wartość stałej dysocjacji, tym mocniejszy elektrolit;
wartość stałej dysocjacji elektrolitu można obliczyć z prawa rozcieńczeń Ostwalda.
Słownik
stężeniowa stała dysocjacji; stosunek iloczynu stężeń jonów powstających podczas dysocjacji elektrolitycznej do stężenia cząsteczek niezdysocjowanych, pozostających w równowadze chemicznej z jonami, jest stały w danej temperaturze i opisuje dysocjację elektrolitów słabych
stężenie molowe w stanie równowagi chemicznej, czyli stanie, w którym reakcje zachodzą z jednakową szybkością w obu kierunkach
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) związek chemiczny, który ulega procesowi rozpadu na jony pod wpływem wody i jest zdolny do przewodzenia prądu elektrycznego; gdy jest całkowicie zdysocjowany, mówimy o elektrolicie mocnym
substancje, które w wodnych roztworach, w wyniku dysocjacji elektrolitycznej, tworzą kationy oksoniowe i aniony tzw. reszt kwasowych; definicja szersza, która wykracza poza zachowanie kwasów w roztworach wodnych, to ta zgodna z teorią Brønsteda–Lowry’ego, według której kwasy to substancje chemiczne, które są donorami kationów wodoru (oddają jon wodorowy) w reakcji z akceptorami jonów wodorowych
substancje, które zwiększają stężenie jonów
Bibliografia
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Staluszka J. Równowagi i procesy jonowe Chemia 3, Gdynia 2006.
Krzeczkowska M., Loch J., Mizera A., Chemia. Repetytorium. Liceum – poziom podstawowy i rozszerzony, Warszawa–Bielsko‑Biała 2010.
Minczewski J., Marczenko Z., Chemia analityczna. T.2. Chemiczne metody analizy ilościowej. Wyd. 10. PWN, Warszawa 2011.