Przeczytaj
Doświadczenie nr 1
Uczeń w laboratorium chemicznym miał za zadanie przeprowadzić cztery doświadczenia chemiczne, zgodne ze schematem:

Nie we wszystkich probówkach uczeń zaobserwował zmiany. Pamiętał, że nikiel to srebrzystoszare ciało stałe, a jego jony nadają roztworom wodnym zieloną barwę.
Jak myślisz, co może decydować o tym, że reakcja pomiędzy metalem a solą innego metalu zachodzi lub nie zachodzi?
W oparciu o przeprowadzone doświadczenia, uczeń zapisał następujące obserwacje i wnioski:
Dlaczego w probówkach nr 1 i 2 zaszła reakcja chemiczna, a w probówkach nr 3 i 4 nie zaobserwowano żadnych zauważalnych zmian?
Zapewne już wiesz, że metale wykazują różne właściwości chemiczne i różną reaktywność. Jedne są bardziej reaktywne, a drugie mniej. O tym, który metal jest bardziej aktywny, mówią nam wartości potencjałów elektrochemicznychpotencjałów elektrochemicznych metali. Wartości te można odczytać z szeregu elektrochemicznego. W tym szeregu metale są ustawione od tych najbardziej aktywnych chemicznie (o najbardziej ujemnym potencjale standardowym) do tych najmniej aktywnych chemicznie (o najwyższym/najbardziej dodatnim potencjale standardowym), np. lit jest bardziej aktywny chemicznie od magnezu.
SZEREG ELEKTROCHEMICZNY METALI
Elektroda | |
|---|---|
Indeks dolny Źródło: D. Witowski, Zbiór zadań 2002‑2012. Liceum i Technikum, Łańcut 2012. Indeks dolny koniecŹródło: D. Witowski, Zbiór zadań 2002‑2012. Liceum i Technikum, Łańcut 2012.
Na podstawie doświadczenia nr 1 zapisz równania reakcji chemicznych w formie cząsteczkowej i jonowej skróconej, które zaszły w probówce nr 1 i nr 2.

Probówka 1.
Probówka 2.
Porównywanie aktywności chemicznej miedzi() z innymi metalami
Doświadczenie nr 2
Wykonano doświadczenia chemiczne, zgodne z poniższym schematem:
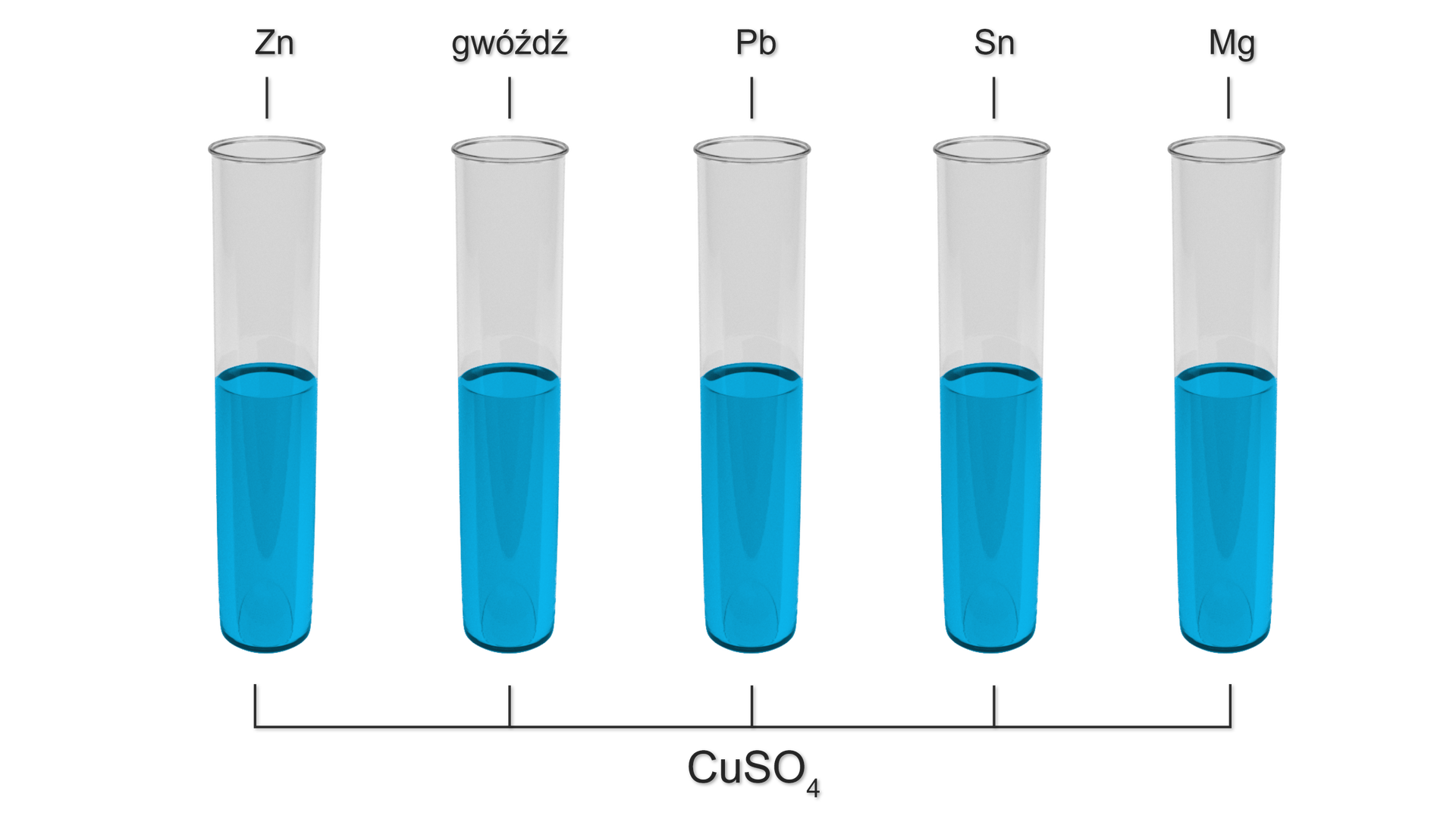
Użyte metale były w formie blaszek. Gwóźdź wykonany był z żelaza.
W których probówkach wytrąci się miedź? Odpowiedź uzasadnij, zapisując równania reakcji chemicznych w formie cząsteczkowej lub zaznaczając, że dana reakcja nie zachodzi. Zapisz ogólny wniosek z przeprowadzonego doświadczenia.
Czy glin wyprze miedź z roztworu siarczanu() miedzi() oraz roztworu chlorku miedzi()?
Doświadczenie nr 3
Zaprojektuj doświadczenie, dzięki któremu sprawdzisz, czy glin wyprze miedź z roztworów siarczanu() miedzi() oraz chlorku miedzi(). W tym celu uzupełnij hipotezę, obserwacje, wnioski oraz zapisz równania reakcji chemicznych.
Schemat doświadczenia:

Słownik
zdolność substancji do łatwego ulegania reakcjom chemicznym
wielkość, która określa udział danego składnika w potencjale termodynamicznym fazy dla cząsteczek naładowanych elektrycznie
Bibliografia
L. Jones, P. Atkins, Chemia ogólna, cząsteczki, materia, reakcje, Warszawa 2014.
A. Bielański, Podstawy chemii nieorganicznej, Warszawa 1987.
D. Mickiewicz, Żarłoczne metale i propozycja dla nauczycieli, 2011.