Przeczytaj
Jednym z rodzajów reakcji w chemii organicznej są reakcje eliminacjieliminacji. Polegają one na odłączeniu atomu lub grupy atomów od cząsteczki, w skutek czego powstaje nowe wiązanie pomiędzy atomami węgla. Powoduje to albo zwiększenie krotności istniejącego już wiązania, albo cyklizację cząsteczki.
Najczęściej dochodzi do eliminacji cząsteczek typu , oraz , gdzie to atomy fluorowców, np. , , , .
Reakcje eliminacji zachodzą w sposób jedno- lub dwuetapowy. Mechanizm jednoetapowy jest znany jako reakcja typu , a mechanizm dwuetapowy jest znany jako reakcja . Cyfra „” lub „” nie odnosi się do liczby kroków w mechanizmie, ale do kinetyki reakcji. Zatem eliminacja typu jest reakcją dwucząsteczkową zachodzącą zgodnie z kinetyką drugiego rzędudrugiego rzędu, podczas gdy eliminacja typu jest reakcją pierwszego rzędureakcją pierwszego rzędu, jednocząsteczkową.
Eliminacja typu
Eliminacja typu to reakcja dwucząsteczkowa. Oznacza to, że w reakcji biorą udział dwie cząsteczki: cząsteczka, z której zostają usunięte atomy (np. halogenek alkilowy) oraz inna cząsteczka mająca charakter nukleofilowy (mająca nadmiar elektronów), będąca zasadą LewisaLewisa oznaczaną często literą B. Najczęściej jest to anion hydroksylowy () lub alkoholanowy (, gdzie to reszta węglowodorowa).
Mechanizm eliminacji przebiega w jednym etapie, z utworzeniem stanu przejściowego, zgodnie z poniższym schematem:
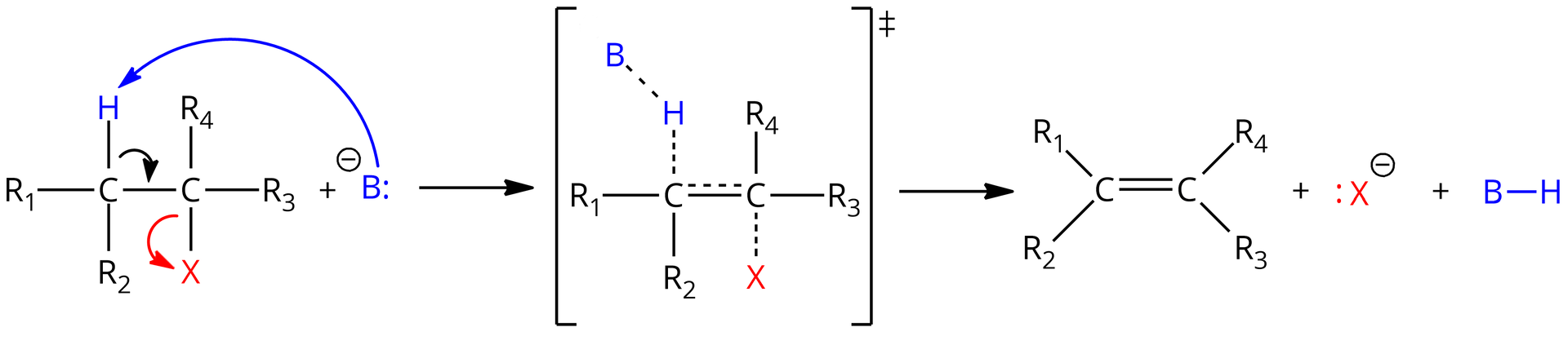
, , , – grupa węglowodorowa lub atom wodoru
W pierwszej kolejności następuje atak zasady Lewisa () na atom wodoru, który związany jest z atomem węgla, sąsiadującym z atomem węgla. Przy nim z kolei znajduje się atom , np. lub . To powoduje utworzenie stanu przejściowego, gdzie jednocześnie zasada odrywa atom wodoru, tworzy się wiązanie podwójne pomiędzy atomami węgla oraz zerwane zostaje wiązanie z atomem . Następnie całkowicie zostaje zerwane wiązanie oraz i powstaje obojętny, organiczny produkt (np. alken). W efekcie solwatacji przez polarne cząsteczki rozpuszczalnika, grupa opuszcza cząsteczkę wraz z parą elektronową, a atom wodoru tworzy nowe wiązanie z zasadą . Eliminacja typu zachodzi bez powstawania produktów pośrednich.
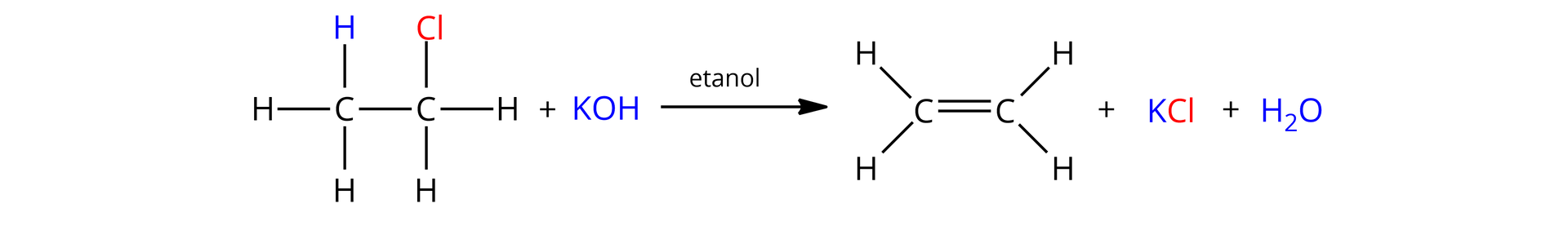
Przykładem reakcji eliminacji typu jest reakcja chloroetanu z wodorotlenkiem potasu w środowisku etanolu, zachodząca zgodnie z poniższym równaniem reakcji:
Reguła Zajcewa
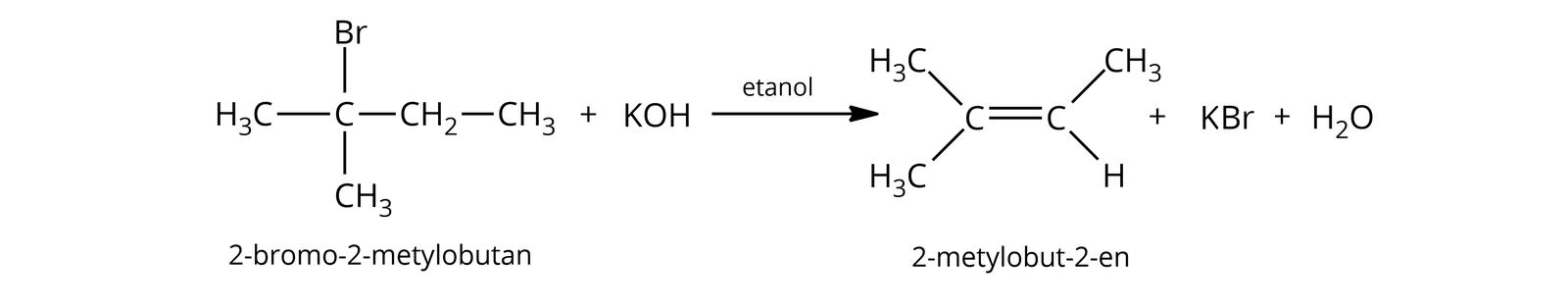
O kierunku eliminacji cząsteczek z substratu , z którego mogą powstawać izomery położenia wiązania wielokrotnego, decyduje trwałość produktów. Jest to reguła Zajcewa, która mówi o tym, że łatwiej zachodzi eliminacja atomu wodoru od atomu węgla związanego z większą ilością grup alkilowych. Innymi słowy, „temu atomowi węgla, który ma mało atomów wodorów, zostanie odebrane”. Produktami głównymi są więc bardziej rozgałęzione izomery. Wynika to z trwałości termodynamicznej alkenów, a ta rośnie wraz ze wzrostem rozgałęzienia łańcucha węglowodorowego. Przykładowo, w wyniku reakcji -bromo--metylobutanu z , zachodzącej zgodnie z mechanizmem typu , produktem głównym jest -metylobut--en, a nie -metylobut--en.
Eliminacja typu zachodzi głównie w reakcjach usuwania cząsteczek typu z pierwszorzędowych, drugorzędowych i trzeciorzędowych halogenków alkilowych i wymaga dużego stężenia zasady.
Należy pamiętać również, że eliminacja typu jest reakcją konkurencyjną do reakcji substytucji typu . Dlatego aby otrzymać produkty eliminacji, a nie substytucji, należy reakcje prowadzić w warunkach bezwodnych.
Eliminacja typu
Eliminacja typu to reakcja jednocząsteczkowa, zachodząca w dwóch etapach. Samorzutna dysocjacja atomu prowadzi do powstania karbokationu, który zostaje poddany atakowi nukleofilanukleofila (zasady Lewisa), dając odpowiedni alken.
Mechanizm eliminacji przebiega zgodnie z poniższym schematem:
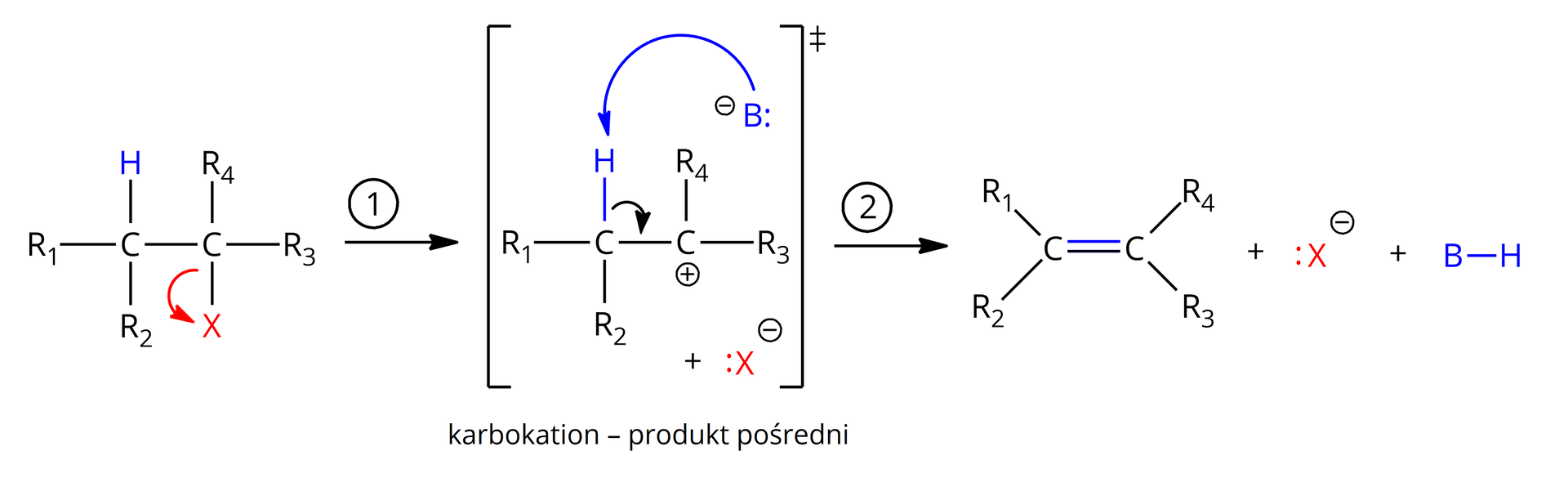
W pierwszym etapie reakcji następuje spontaniczna dysocjacja fluorowca halogenku alkilowego, prowadząca do powstania karbokationu (). Fluorowiec opuszcza cząsteczkę jako anion . Jest to najwolniejszy etap reakcji, determinujący szybkość jej zachodzenia. Atom wodoru sąsiadującego atomu węgla zostaje poddany atakowi zasady Lewisa . Wówczas zaczyna pękać wiązanie , a para elektronowa przemieszcza się, tworząc nowe wiązanie pomiędzy atomami węgla – wiązanie typu
. Utworzony zostaje obojętny produkt organiczny (alken) oraz nowa cząsteczka ().
Eliminacja typu nazywana jest często eliminacją elektrofilową, ponieważ w kluczowym momencie reakcji powstaje elektrofil w postaci karbokationu.
Przykładem reakcji typu jest reakcja -chloro--metylopropanu z rozcieńczonym roztworem wodorotlenku potasu. Otrzymuje się wówczas -metylopropen.
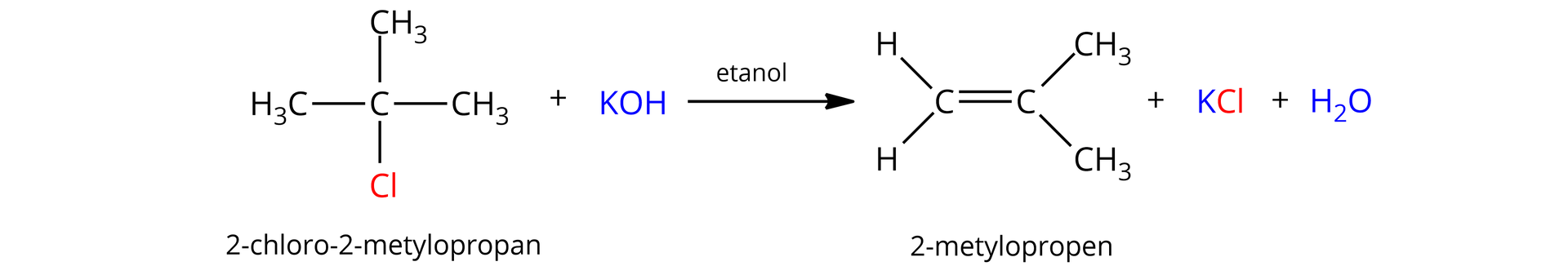
Dehydratacja alkoholialkoholi katalizowana kwasem, która prowadzi do otrzymania alkenu, należy do reakcji eliminacji typu .
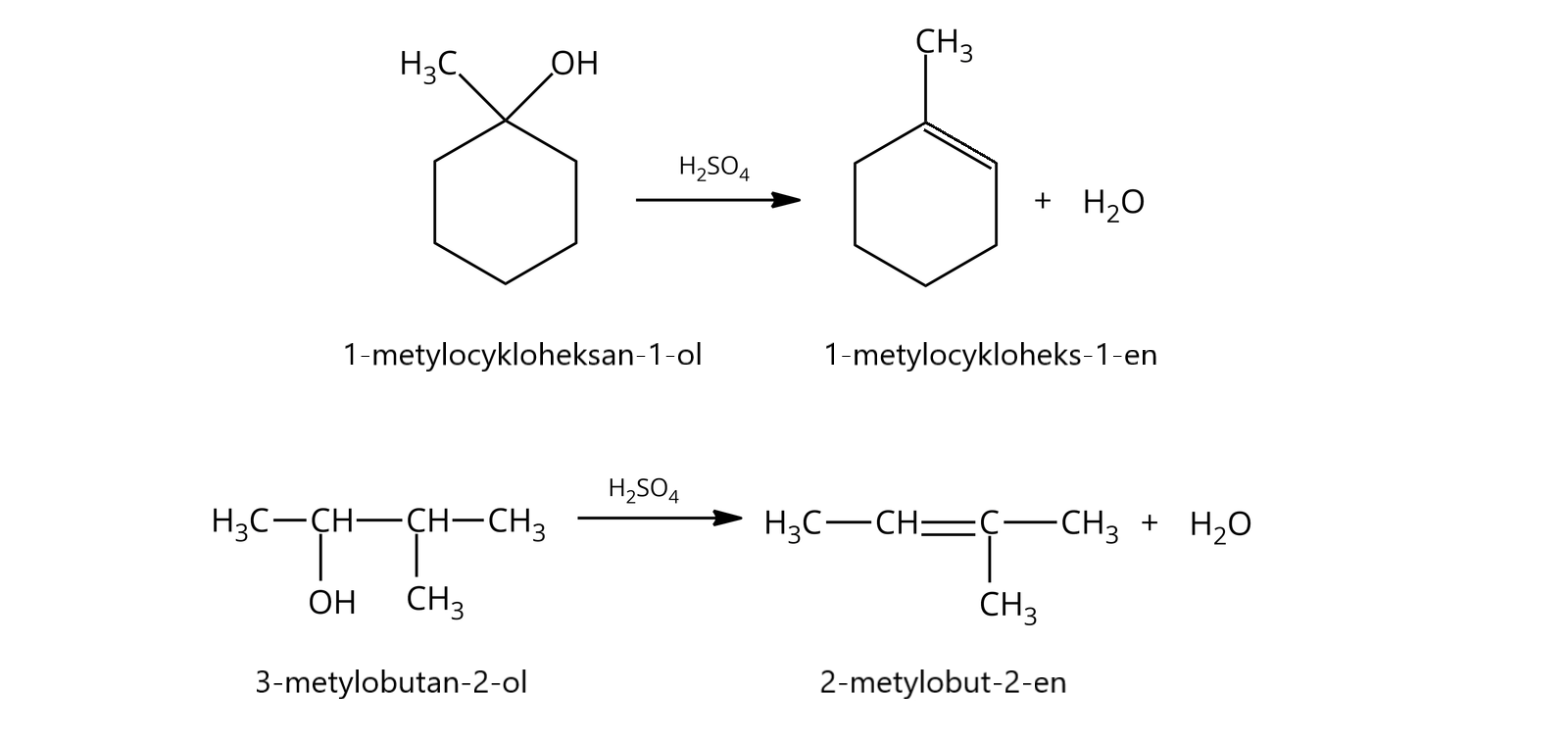
Reakcja eliminacji typu również zachodzi zgodnie z regułą Zajcewa – czyli produktem głównym (trwalszym) jest bardziej rozgałęziony alken.
Eliminacja typu zachodzi głównie dla trzeciorzędowych halogenków alkilowych w roztworach o niskim stężeniu zasady, a także dla alkoholi w reakcjach katalizowanych kwasem.
Należy pamiętać, że eliminacja typu jest reakcją konkurencyjną do reakcji substytucji typu . Dlatego reakcje eliminacji przeprowadzane w środowisku zasadowym wymagają warunków bezwodnych, aby uniknąć reakcji substytucji prowadzącej np. do otrzymania alkoholi, podobnie jak w przypadku mechanizmu typu .
Eliminacja typu i – porównanie
Podsumowanie reakcji eliminacji:
typ reakcji | ||
|---|---|---|
eliminacja z halogenków pierwszorzędowych | zachodzi przy użyciu silnych zasad | nie zachodzi |
eliminacja z halogenków drugorzędowych | Uprzywilejowana przy użyciu silnych zasad | może zachodzić w przypadku halogenków benzylowych i alkilowych () |
eliminacja z halogenków trzeciorzędowych | uprzywilejowana przy użyciu zasad | konkuruje z reakcją |
eliminacja z alkoholi w reakcjach katalizowanych kwasem | nie zachodzi | zachodzi |
Indeks dolny Na podstawie: John McMurry, Chemia organiczna, Warszawa, PWN, 2000. Indeks dolny koniecNa podstawie: John McMurry, Chemia organiczna, Warszawa, PWN, 2000.
Słownik
(łac. eliminare „usuwać”) reakcja chemiczna związków organicznych polegająca na odszczepieniu z ich cząsteczek grup atomów lub jonów
cząsteczki będące pochodnymi alkanów, w których atom lub atomy wodoru przyłączone do grupy alkilowej zastapione zostały atomami fluorowca
(arab. al‑kuhl „delikatny proszek”) związki organiczne, pochodne węglowodorów, których cząsteczki zawierają grupę (jedną lub więcej grup) hydroksylową (wodorotlenową) –OH zamiast atomu wodoru związanego w związku macierzystym z atomem węgla grupy alkilowej lub cykloalkilowej
indywiduum chemiczne obdarzone ładunkiem ujemnym (np. , , ) lub cząsteczka obojętna posiadająca wolne pary elektronowe (np. , , )
teoria, wg której kwasami są jony lub cząsteczki mające niedobór elektronów, mogące reagować z jonami lub cząsteczkami zawierającymi wolne pary elektronowe, czyli zasadami Lewisa
reakcja, której szybkość jest wprost proporcjonalna do stężenia substratu; równanie kinetyczne przyjmuje postać: , gdzie jest substratem, natomiast stałą szybkości; w równaniu kinetycznym reakcji biegnącej zgodnie z kinetyką pierwszego rzędu suma wykładników potęg jest więc równa
reakcja, dla której równanie kinetyczne przyjmuje postać: lub , gdzie i są substratami, natomiast k stałą szybkości; w równaniu kinetycznym reakcji biegnącej zgodnie z kinetyką drugiego rzędu suma wykładników potęg jest więc równa
Bibliografia
Encyklopedia PWN
McMurry J., Chemia organiczna, tłum. H. Koroniak i inni, t. 4, Warszawa 2018.
Morrison R. T., Boyd R. N., Chemia organiczna, tłum. W. Antkowiak i in., t. 1, Warszawa 1985.