Przeczytaj
Nie tylko budulec kości
Wapń jest pierwiastkiem, który nie występuje w stanie wolnym, lecz jest składnikiem skał. Metaliczny wapń ma ograniczone zastosowania. Używany jest podczas produkcji metali, takich jak miedź czy nikiel. Z uwagi na silne powinowactwo chemicznepowinowactwo chemiczne wapnia do siarki, skutecznie usuwa ją ze złóż metali.

Wapń, z uwagi na silne właściwości higroskopijne oraz powinowactwo do tlenu, wykorzystywany jest także do osuszania gazów szlachetnych oraz ropy naftowej.
Nie sposób nie wspomnieć o zastosowaniach tego metalu podczas redukcji, np. tlenków uranu oraz toru do postaci metalicznej.
Wapń przede wszystkim odgrywa ważną rolę w organizmie człowieka. Jego jony są niezbędne w procesach krzepnięcia krwi, skurczy mięśni i przekazywania impulsów nerwowych. Jest budulcem naszych kości i zębów, a jego zawartość w organizmie stanowi około 2% masy ciała. W momencie jego niedoboru w organizmie oraz po złamaniach kości, źródłem wapnia w postaci leku może być glukonian wapnia – sól wapniowa kwasu glukonowego. Jest ona podawana także pacjentom z osteoporozą. To jednak nie jedyna właściwość glukonianu wapnia. Związek ten stosowany jest również jako dodatek do żywności o symbolu E578.
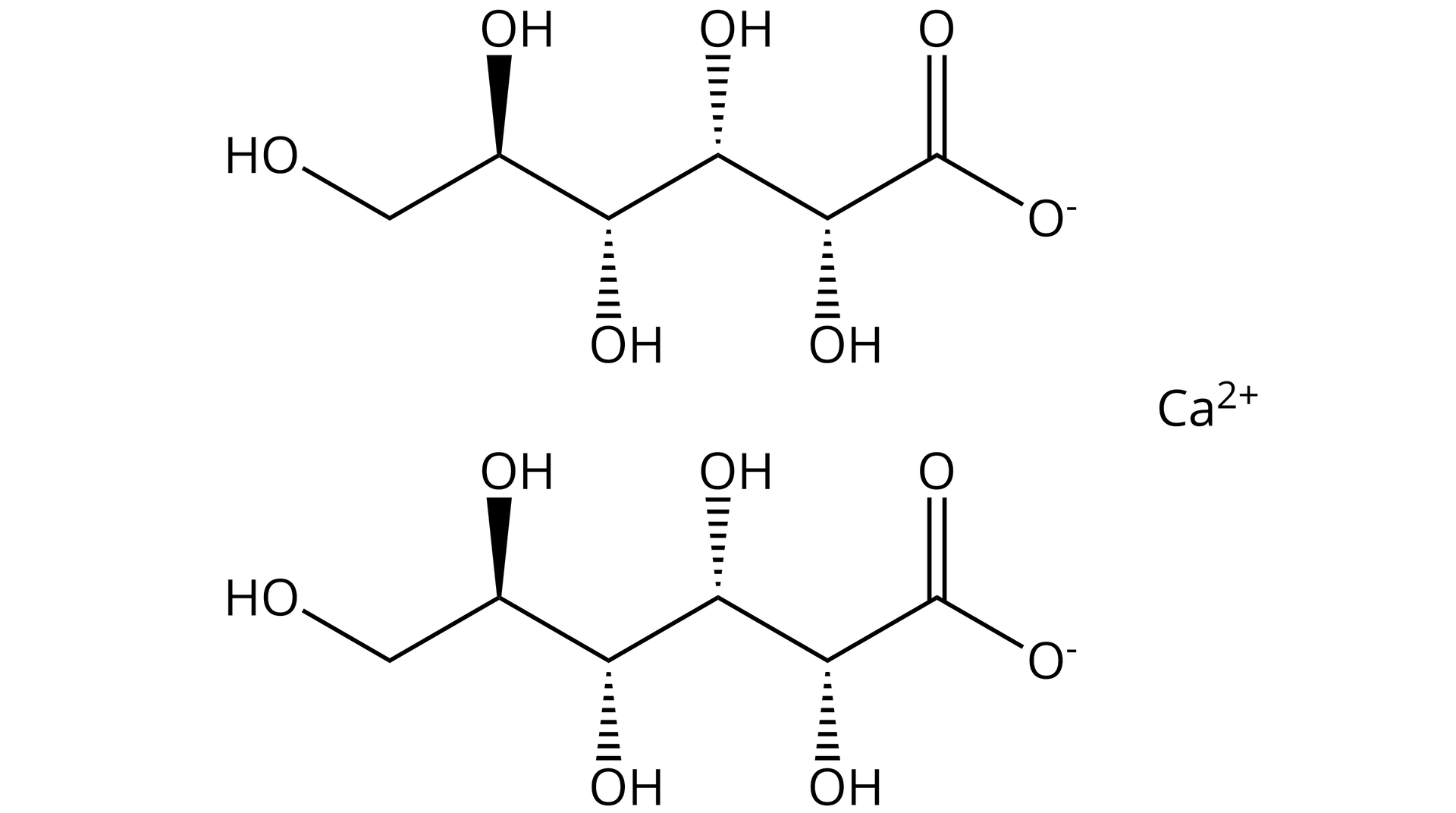
1 g glukonianu wapnia zawiera 89 mg zjonizowanego wapnia.
Skały
Naturalnym źródłem wapnia w przyrodzie są skały, takie jak wapienie, marmur, kreda, a także minerały kalcyt, dolomit czy apatyt.
Wapienie
Wapienie to skały osadowe zbudowane głównie z . Stosowane są jako materiał budowlany, np. składnik betonu.
Marmur
Dawniej marmury stanowiły cenny materiał dla rzeźbiarzy i do dziś stosowane są jako kamień ozdobny w budownictwie.
Kreda
Kreda to skała o strukturze porowatej, w skład której wchodzi węglan wapnia () oraz niewielkie ilości gliny. Jednym z jej ważniejszych zastosowań jest produkcja cementu. W poniższej galerii przedstawiono kilka zastosowań kredy.
Gips
W przyrodzie występuje krystaliczny siarczan(VI) wapnia - woda(1/2) o wzorze sumarycznym . W czasie prażenia , cząsteczki wody odłączają się i powstaje tzw. gips palony (siarczan(VI) wapnia - woda(2/1)).
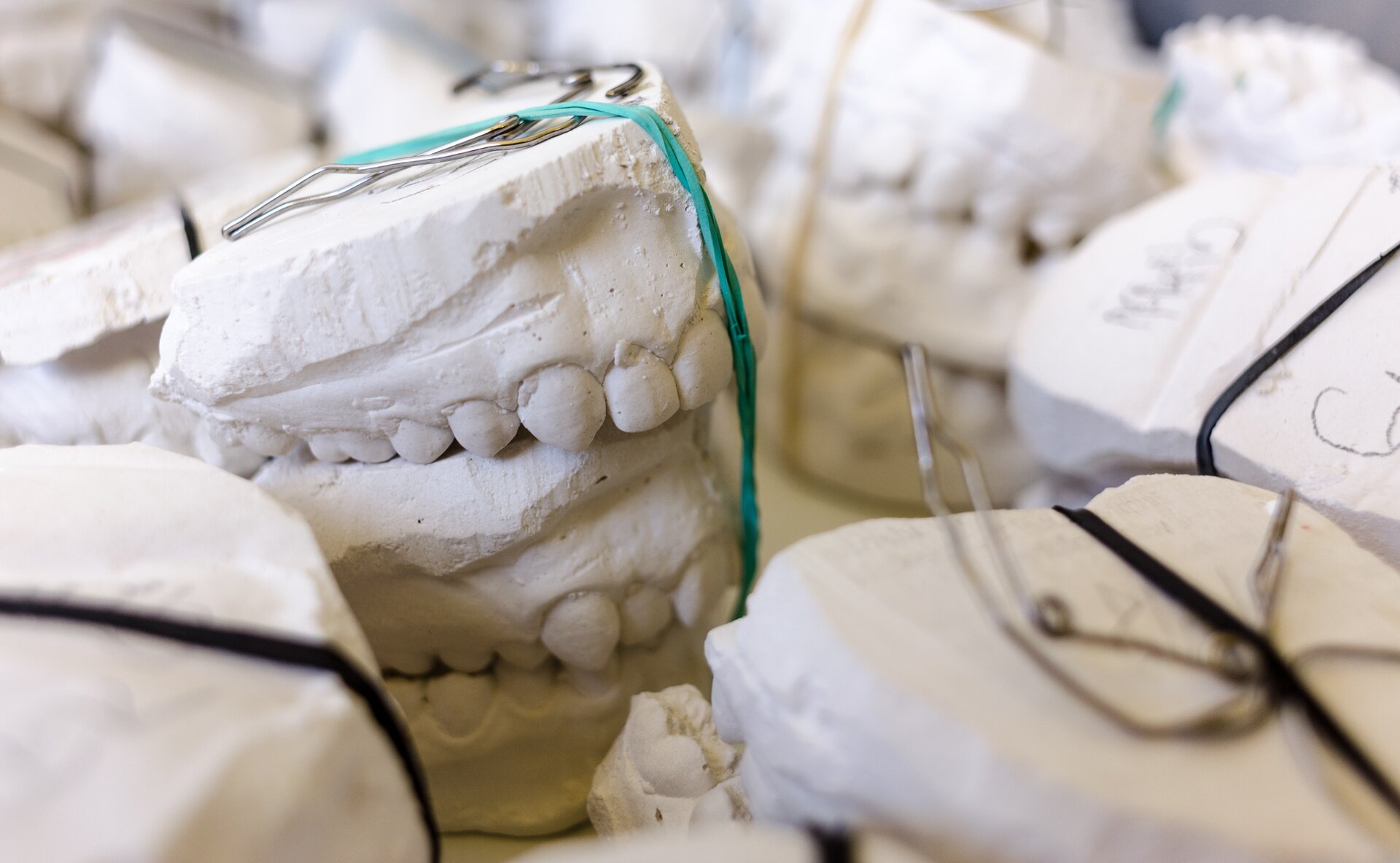
To białe ciało stałe, nierozpuszczalne w wodzie. Proszek ten wykorzystywany jest w chirurgii do usztywniania kończyn po złamaniach. W kontakcie z wodą, gips palony (w postaci sypkiego proszku) tworzy zaprawę gipsową. Kiedy woda odparowuje, zachodzi proces odwrotny do przedstawionego powyżej.
Powyżej opisana reakcja zachodzi podczas schnięcia gipsu na złamanych kończynach lub w trakcie wykonywania odlewów i modeli. W poniższej galerii przedstawiono przykłady użycia zaprawy gipsowej.
Wapno palone czy gaszone?
W wyniku termicznego rozkładu węglanu wapnia powstaje wapno palonewapno palone ():
Tlenek wapnia, czyli wapno palone, jest jednym z najstarszych materiałów znanych ludzkości. Poniżej przedstawiono jego najważniejsze zastosowania.
Z kolei podczas reakcji wapna palonego i wody powstaje tzw. wapno gaszonewapno gaszone, czyli wodorotlenek wapnia.
Poniżej przedstawiono najważniejsze zastosowania wapna gaszonego.

Nasycony roztwór wodorotlenku wapnia (tzw. woda wapiennawoda wapienna) jest stosowana w warunkach laboratoryjnych do wykrywania tlenku węgla(IV). W obecności tego tlenku woda wapienna mętnieje, co jest wynikiem powstawania nierozpuszczalnego węglanu wapnia.
Wykonaj mapę myśli, w której przedstawisz najważniejsze pojęcia związane z zastosowaniem wapnia oraz jego związków.
- Nazwa kategorii: Zastosowanie 1
Słownik
tlenek wapnia () otrzymywany w wyniku termicznego rozkładu węglanu wapnia
wodorotlenek wapnia () otrzymywany m.in. w wyniku reakcji wapna palonego z wodą
nasycony roztwór wodorotlenku wapnia
powinowactwo reakcji chemicznej; wielkość termodynamiczna określająca zdolność układu substancji do przereagowania w określonym kierunku w danych warunkach
Bibliografia
Cox P. A., Chemia nieorganiczna. Krótkie wykłady, Warszawa 2012.
Czerwiński A., Czerwińska A., Jelińska‑Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik dla liceum ogólnokształcącego i technikum, Warszawa 2002.
Encyklopedia PWN
Greenwood N. N., Earnshaw A., Chemistry of the elements, 2nd Edition, Oksford 1997.
Kołodziejczyk A., Naturalne związki organiczne, Warszawa 2013.
Saunders N., Saunders A., Clinton S., Parsonage M., Poole E., AS Chemistry for AQA, Oxford 2007.
Świerkocka B., Świerkocki J., Projekt: Matura Chemia, Warszawa 2012.