Przeczytaj
Rozmiary atomów i ich jonów

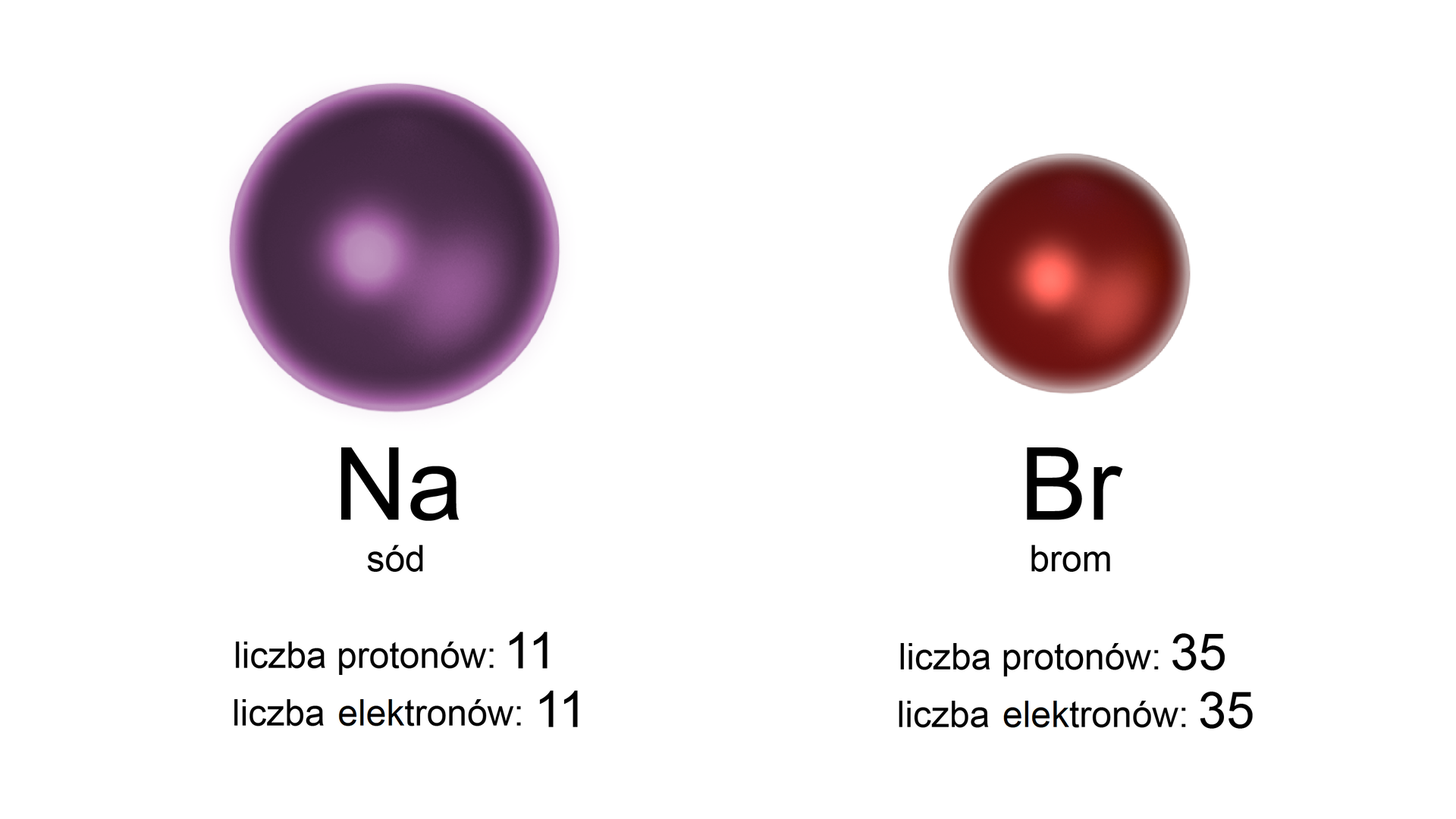
Skorzystaj z układu okresowego pierwiastków oraz przedstawionych powyżej informacji i uzupełnij tabelę podającą informacje o bromie.
W jaki sposób brom reaguje z metalami?
Przeanalizuj kilka metali o następujących symbolach: , , , , , które położone są w różnych grupach układu okresowego, porównując ich elektroujemności.
Bromek sodu ()
Konfiguracje elektronowe skrócone podpowłokowe, zawierające rdzeń gazu szlachetnego dla atomu sodu i atomu bromu, występujących w stanie podstawowym, są następujące:
;
.
Co się dzieje z atomami, gdy sód i brom reagują ze sobą?
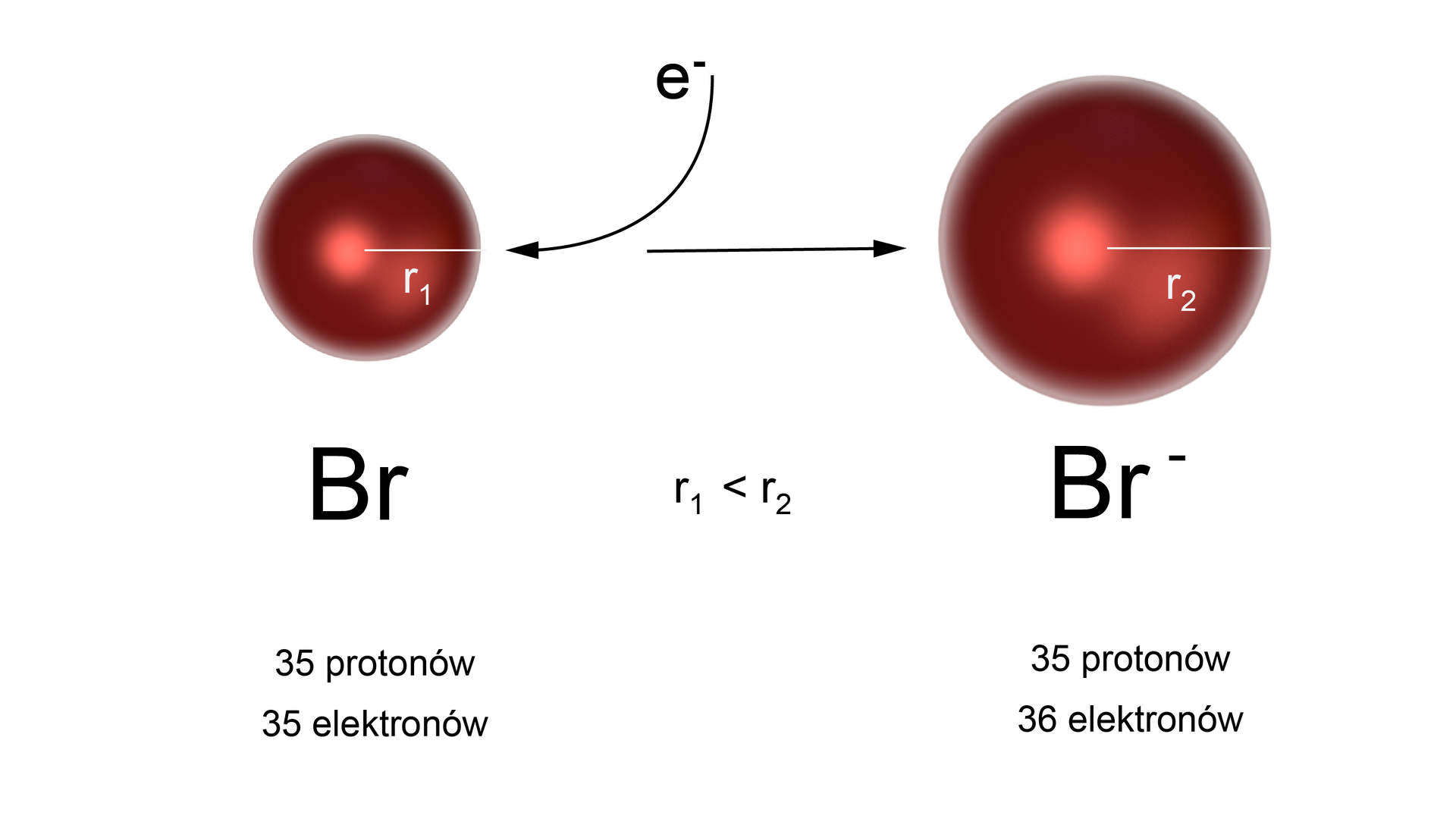
Atom sodu oddaje elektron i powstaje kation , o konfiguracji elektronowej identycznej jak atom neonu. Kation ma mniejszy promień niż atom, z którego powstał.

Atom bromu przechwytuje elektron i powstaje anion , o konfiguracji elektronowej identycznej jak atom kryptonu. Anion ma większy promień niż atom, z którego powstał.
Kation sodu i anion bromkowy oddziałują na siebie siłami elektrostatycznymi – tworzy się wiązanie jonowewiązanie jonowe. Elektroujemność sodu i bromu wg skali Paulinga wynosi odpowiednio i . Różnica elektroujemności równa się zatem .
Tworzenie się kationu sodu:
Powstawanie anionu bromkowego:
Reakcja sumaryczna:
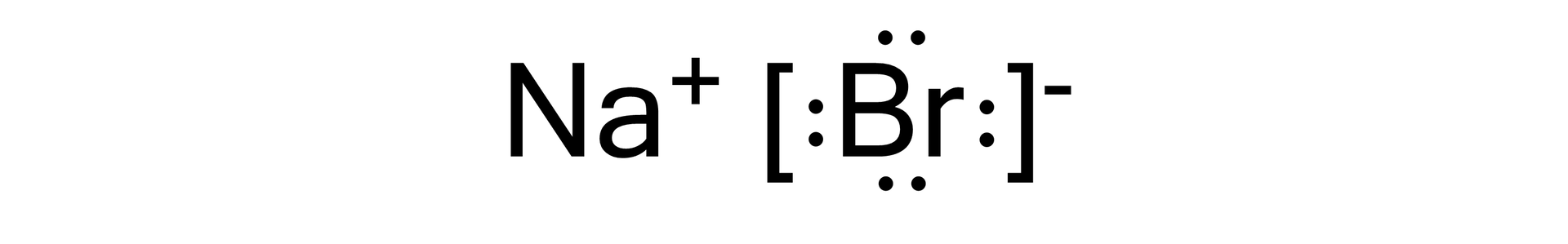
W analogiczny sposób zachodzi reakcja bromu z innymi metalami grupy , np. litu czy potasu.
Poniżej znajduje sie galeria slajdów.
Bromek wapnia ()
Konfiguracje elektronowe skrócone podpowłokowe, zawierające rdzeń gazu szlachetnego dla atomu wapnia i atomu bromu, występujących w stanie podstawowym, są następujące:
;
.
Podobnie jak w przypadku litowców, wapń, jak również inne pierwiastki z grupy (z wyjątkiem berylu) tworzą z bromem związki o budowie jonowej. W związku z tym dochodzi do oddania przez atom wapnia dwóch elektronów i powstania kationu , o konfiguracji elektronowej identycznej jak atom argonu. Podobnie jak w przypadku sodu, powstały kation ma mniejszy promień niż atom, z którego powstał.
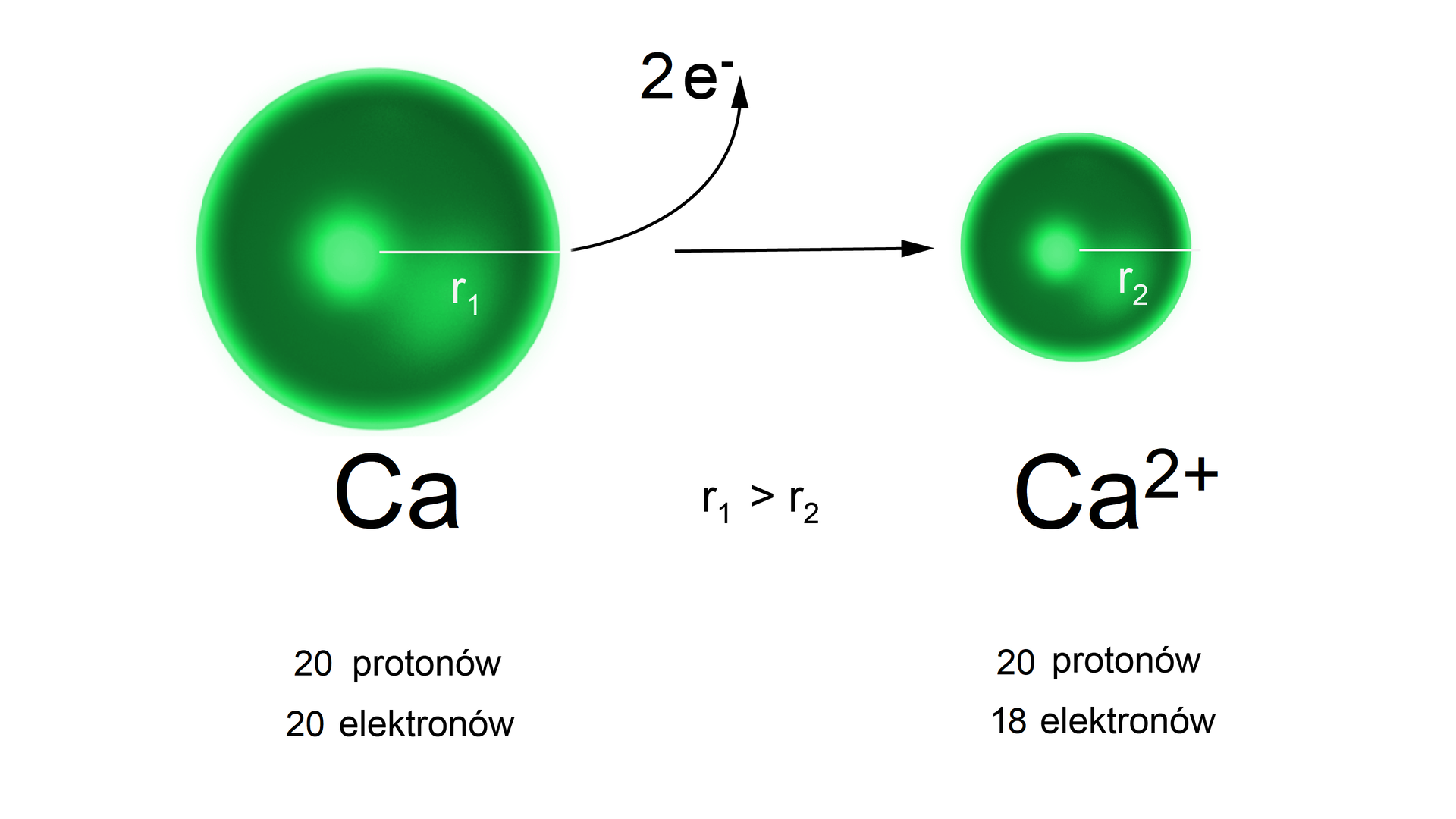
Kation wapnia i aniony bromkowe oddziałują na siebie siłami elektrostatycznymi i tworzą się wiązania jonowe. Elektroujemność wapnia wg skali Paulinga wynosi odpowiednio , zatem różnica elektroujemności między atomem wapnia i bromu równa się .
Tworzenie się kationu wapnia:
Powstawanie anionu bromkowego:
Reakcja sumaryczna:
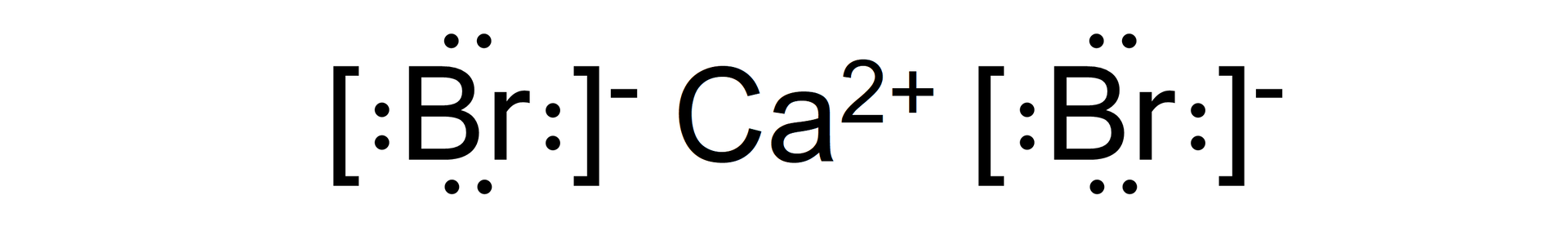
Bromek glinu ()
Brom bezpośrednio reaguje z glinem, tworząc bromek glinu.
W efekcie, w reakcji powstają między atomami wiązania kowalencyjne spolaryzowane. Według skali Paulinga różnica elektroujemności wynosi:
Oznacza to, że każdy z atomów, wchodzących w skład cząsteczki bromku glinu, oddaje po jednym elektronie walenycjnym w celu utworzenia wiążącej pary elektronowej. Bromek glinu jest zatem przykładem soli, w której wiązanie nie jest typowo jonowe, jak to ma miejsce zazwyczaj, a jego charakter jest raczej kowalencyjny.

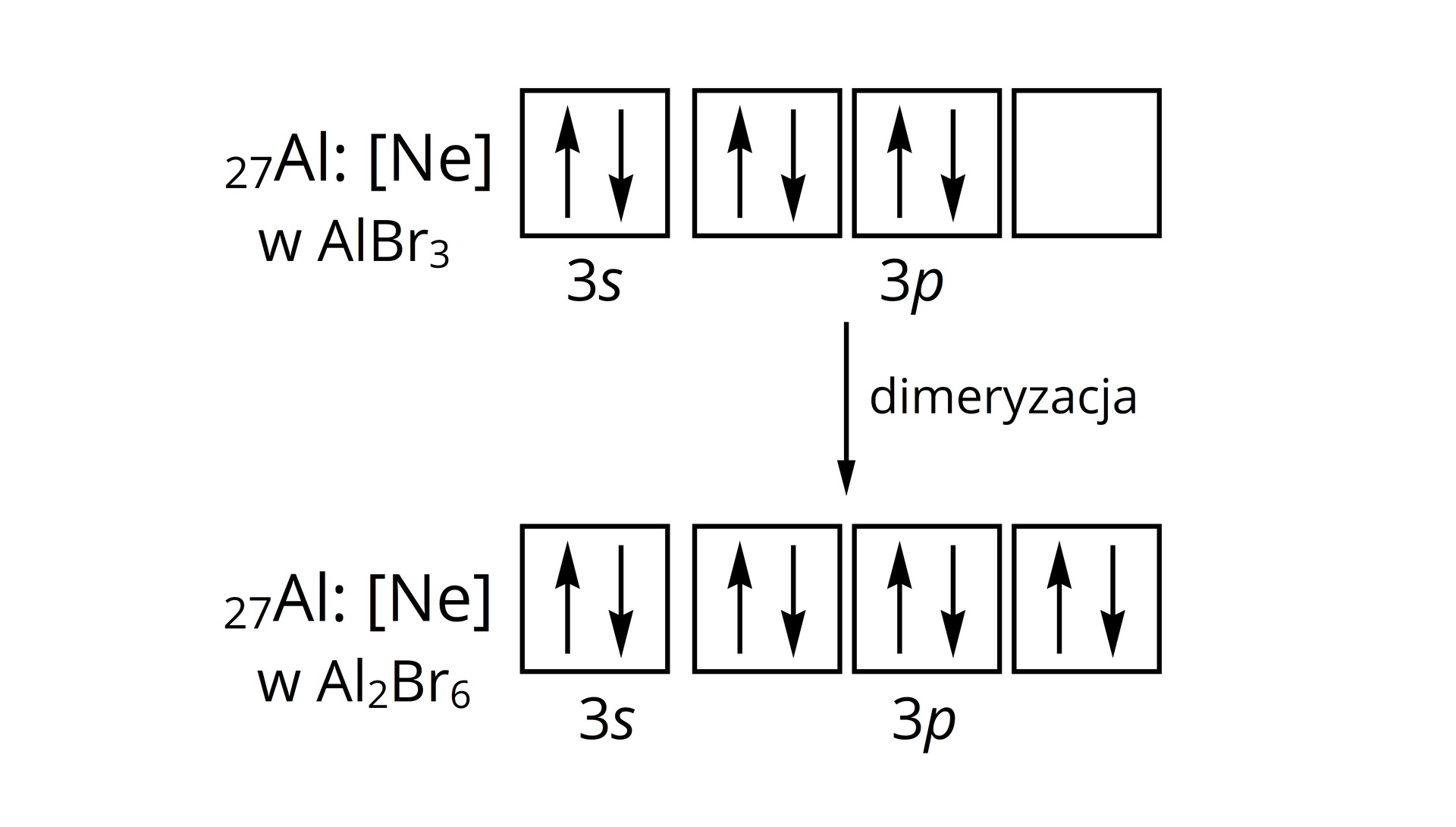
Bromek glinu zazwyczaj występuje w postaci dimeru – w stanie stałym, ciekłym, gazowym oraz w rozpuszczalnikach słabo solwatujących (np. ). Wówczas reakcję syntezy bromku glinu powinno się zapisywać następująco:
Rozpad dimeru na dwie cząsteczki monomeru następuje w wysokich temperaturach.
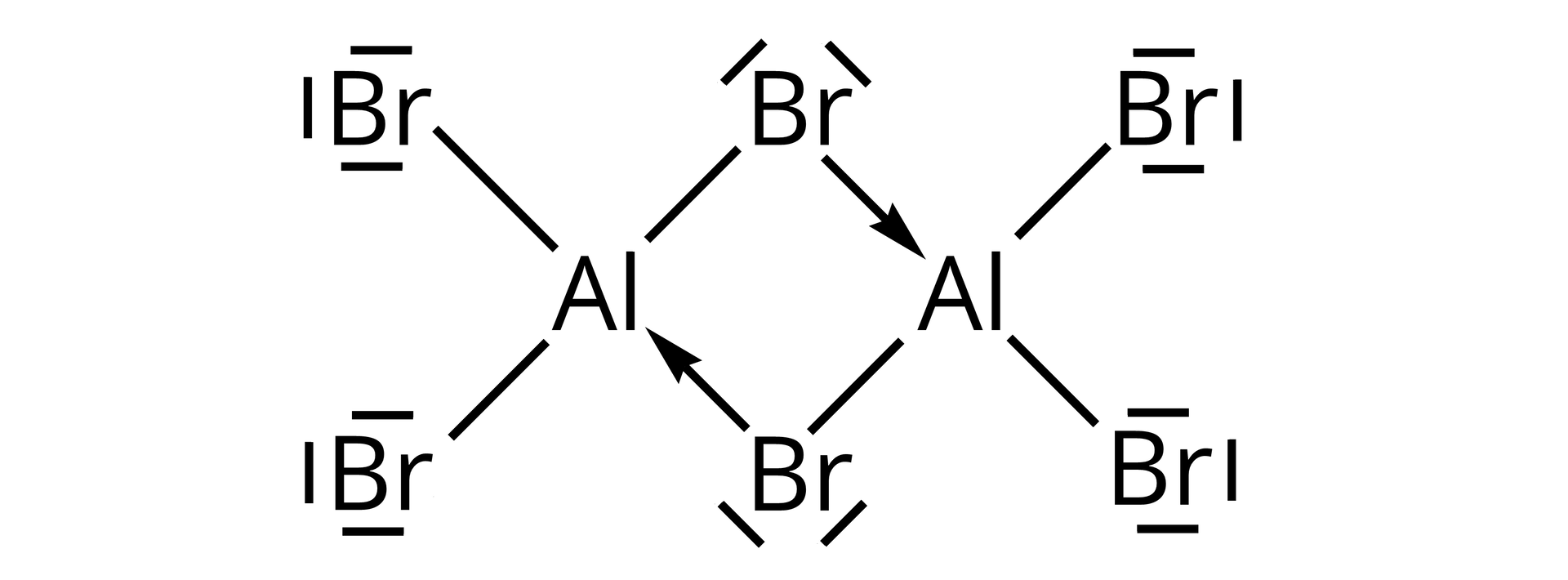
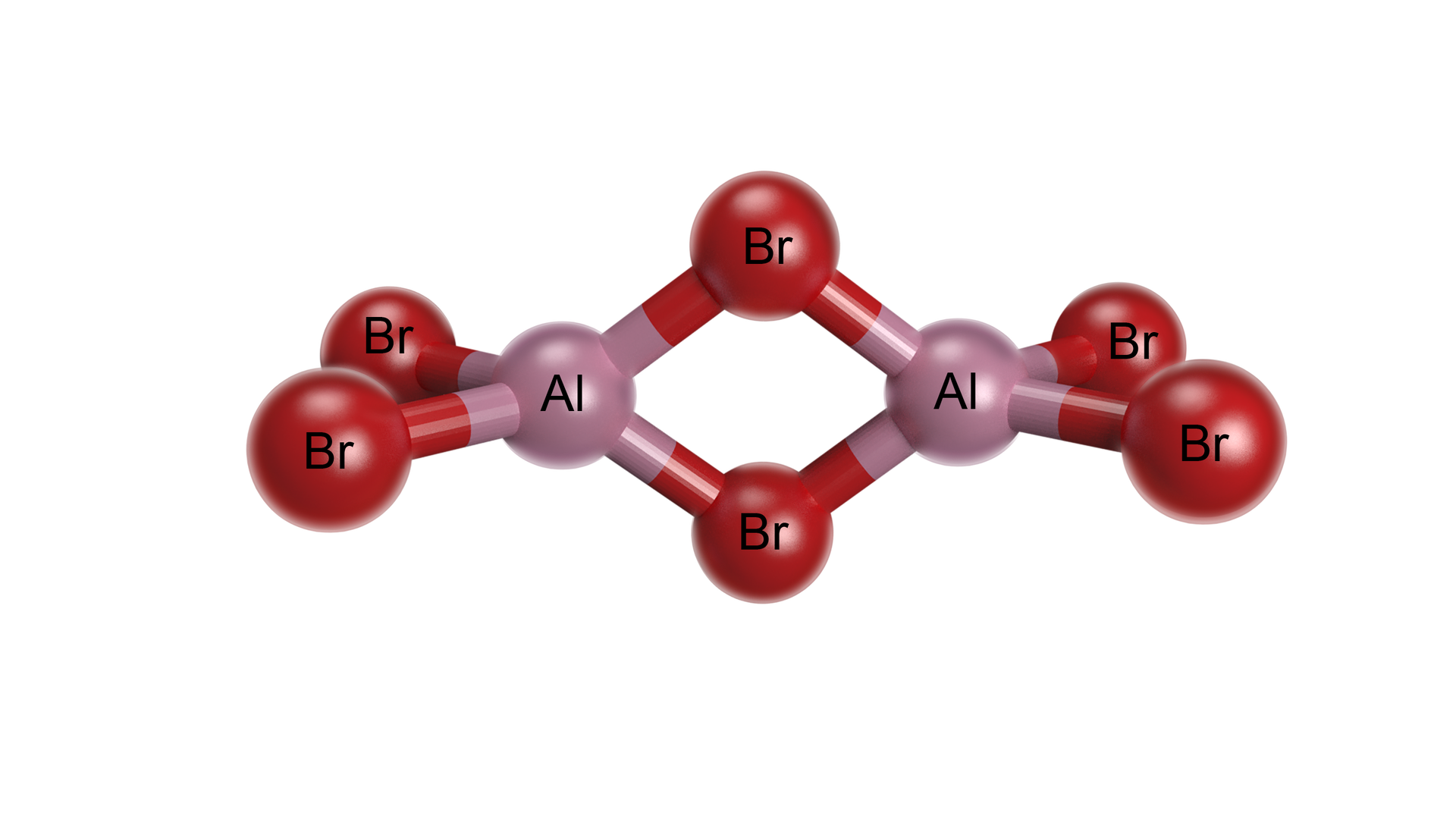
Powstawanie dimeru bromku glinu jest uwarunkowane obecnością niezapełnionego orbitalu na atomie glinu w cząsteczce . W trakcie powstawania dimeru atom glinu jednej z cząsteczek, zawierających dimer, tworzy wiązanie koordynacyjne z atomem bromu drugiej cząsteczki. Dzięki temu atom glinu zapełnia pusty orbital i osiąga korzystną energetycznie konfigurację gazu szlachetnego.
Bromek żelaza() ()
Konfiguracje elektronowe skrócone podpowłokowe, zawierające rdzeń gazu szlachetnego dla atomu żelaza i atomu bromu, występujących w stanie podstawowym, są następujące:
;
.
Według skali Paulinga różnica elektroujemności wynosi:
Równanie reakcji:
Model cząsteczki bromku żelaza():


Bromek miedzi() ()
Konfiguracje elektronowe skrócone podpowłokowe, zawierające rdzeń gazu szlachetnego dla atomu miedzi i atomu bromu, występujących w stanie podstawowym, są następujące:
;
.
Według skali Paulinga różnica elektroujemności wynosi:
Równanie reakcji:
Model cząsteczki bromku miedzi():



Bromki sodu i potasu znalazły zastosowanie w medycynie. Wykazują działanie uspokajające, a w większych dawkach nasenne. Działanie to wynika z wypierania jonów chloru przez jony bromu w przestrzeniach międzykomórkowych.
W przypadku przewlekłego zażywania lub przedawkowania, dochodzi do zatrucia bromem, który objawia się m.in.: psychozami, halucynacjami i trądzikiem bromowym (acne bromide), a nawet może prowadzić do śpiączki lub zgonu.
Duże ryzyko zatrucia pacjenta bromem wynika stąd, iż lecznicza dawka bromu jest bardzo zbliżona do dawki toksycznej. Dawkowanie tego leku musi być niezwykle ostrożne.
Słownik
nieorganiczne związki bromu, w których występuje on na stopniu utlenienia, także związki organiczne, których cząsteczki zawierają atom bromu
wiązanie chemiczne, które powstaje w wyniku oddziaływania elektrostatycznego (przyciągania się) jonów o przeciwnych znakach
Bibliografia
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1987, s. 571‑574.
Piosik R., Karawajczyk B., Technika demonstracji i ćwiczenia laboratoryjne z metodyki nauczania chemii i ochrony środowiska, Gdańsk 2004, s. 56‑57.