Przeczytaj
Charakterystyka amidów
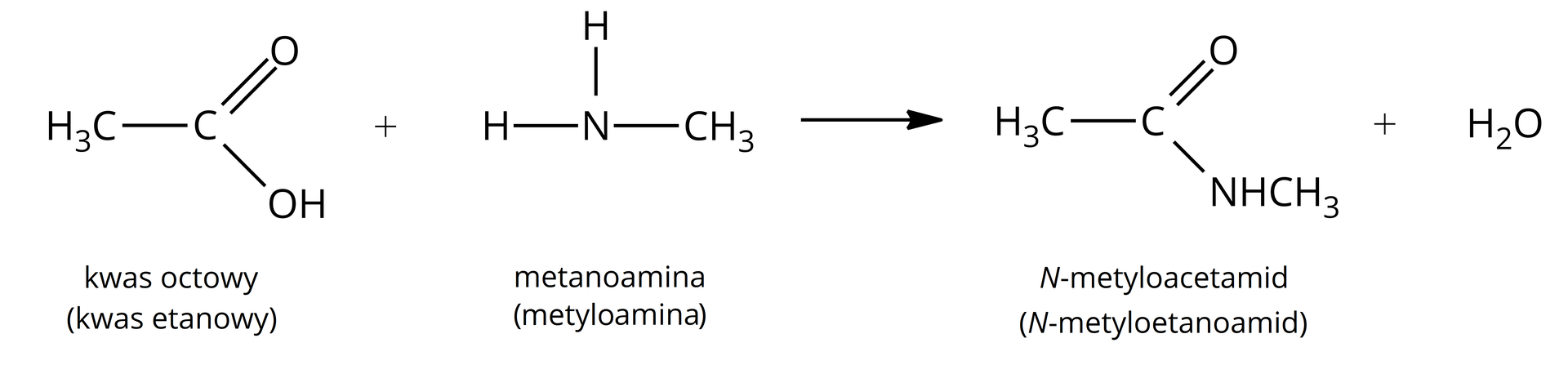
AmidyAmidy kwasowe (karbamidy) są to związki organiczne, które reagują zarówno z kwasami, jak i zasadami, dlatego nazywane są amfolitamiamfolitami. Ta właściwość jest efektem występowania w nich tautomerii amidowo‑imidowej. Otrzymywane są w wyniku kondensacjikondensacji kwasów karboksylowych z aminami lub amoniakiem. Podczas reakcji mieszanina kwasu karboksylowego z amoniakiem jest ogrzewana.
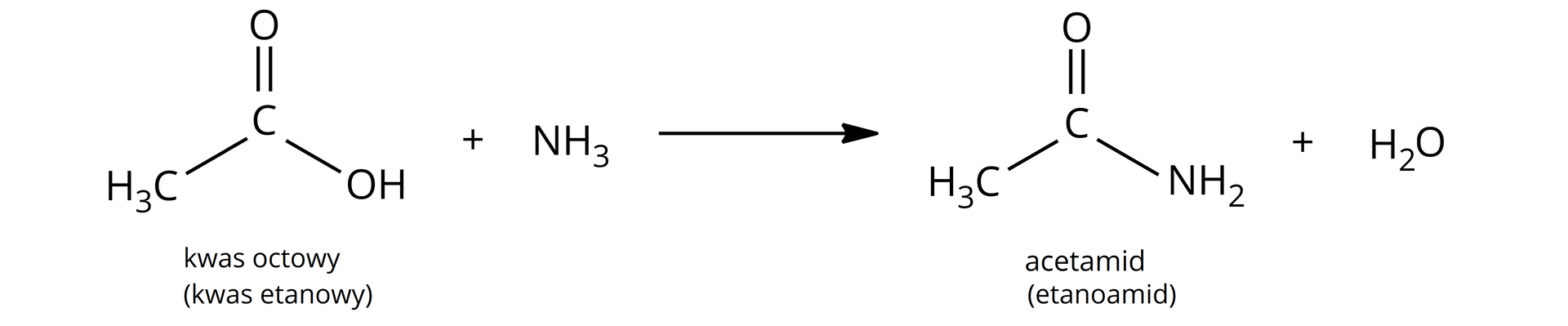
W celu otrzymania amidów z kwasów karboksylowych i amin, należy również zastosować intensywne ogrzewanie mieszaniny.
Reaktywność amidów kwasowych
Reaktywność amidów kwasowych jest związana z ich tautomeriątautomerią amidowo‑iminową. Polega ona na przemieszczaniu się protonu pomiędzy grupą aminową i karbonylową w amidzie. Zlokalizowana na atomie azotu wolna para elektronowa pozwala na reagowanie z kwasami (forma amidowa), natomiast dzięki możliwości odłączenia protonu z grupy hydroksylowej w formie imidowej, związek ten może reagować z zasadami.
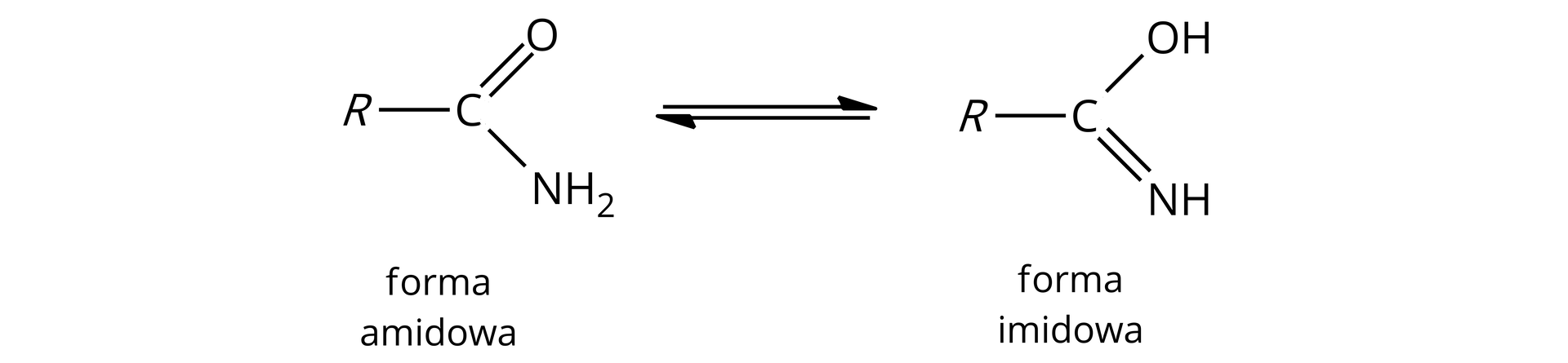
Amidy kwasowe hydrolizują w środowisku kwasowym i zasadowym.
np.:Ilustracja przedstawiająca reakcję hydrolizy amidów w obecności kwasów na przykładzie etanoamidu (acetamidu). Cząsteczka zbudowana z podstawnika związanego z grupą . Dodać cząsteczkę chlorowodoru . Strzałka w prawo, nad strzałką cząsteczka wody, za strzałką cząsteczka kwasu karboksylowego składającego się z podstawnika związanego z atomem węgla połączonym za pomocą wiązania podwójnego z atomem tlenu oraz za pomocą wiązania pojedynczego z grupą hydroksylową . Dodać cząsteczkę soli amoniowej ., Hydroliza amidów w obecności zasad Ilustracja przedstawiająca schemat ogólny hydrolizy amidów w środowisku zasadowym. Cząsteczka zbudowana z podstawnika związanego z grupą . Dodać cząsteczkę wodorotlenku sodu . Strzałka w prawo, nad strzałką cząsteczka wody, za strzałką cząsteczka karboksylanu sodu składającego się z podstawnika połączonego z grupą . Dodać cząsteczkę aminy . (, – podstawniki alifatyczne, aromatyczne lub wodór)
np.:Ilustracja przedstawiająca reakcję hydrolizy amidów w środowisku zasadowym na przykładzie cząsteczki etanoamidu (acetamidu). Cząsteczka zbudowana z podstawnika związanego z atomem węgla połączonym za pomocą wiązania podwójnego z atomem tlenu oraz za pomocą wiązania pojedynczego z azotu tlenu grupy podstawionej grupą . Dodać cząsteczkę wodorotlenku sodu . Strzałka w prawo, nad strzałką cząsteczka wody, za strzałką cząsteczka etoksylanu sodu składającego się z podstawnika połączonego z atomem węgla związanym za pomocą wiązania podwójnego z atomem tlenu oraz za pomocą wiązania pojedynczego z grupą . Dodać cząsteczkę amoniaku . Dodać cząsteczkę wody.
Rodzaje amidów kwasowych
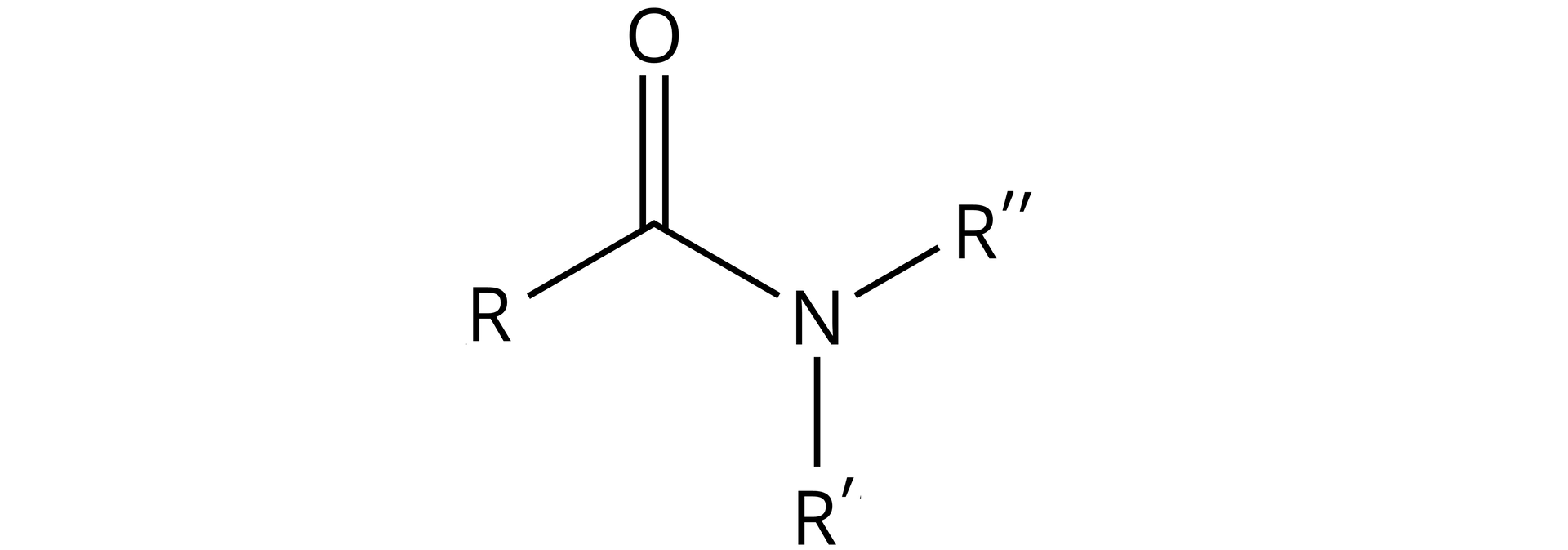
W zależności od podstawienia atomu azotu z grupy aminowej , wyróżnia się amidy ( oznacza resztę, pochodzącą od kwasu karboksylowego):
Nazewnictwo amidów kwasowych
Nazwy prostych amidów możemy tworzyć w następujący sposób:
…amid
Dla amidów pierwszorzędowych: W miejsce wielokropka należy wstawić część nazwy kwasu karboksylowego, np. benzamid
W miejsce wielokropka powinno się wstawić po jednym - (dla -rzędowych), po dwóch - (dla -rzędowych) nazwy grup funkcyjnych, występujących w tym amidzie (z zaznaczeniem ich liczności dla dwóch takich samych podstawników di-, w przypadku amidów -rzędowych), oraz część nazwy kwasu karboksylowego, np. -fenyloetanoamid.
Dla wszystkich amidów (I-, II-, III-rzędowych)
…amid
Dla amidów pierwszorzędowych: W miejsce wielokropka należy wstawić część nazwy kwasu karboksylowego, np. benzamid
W miejsce wielokropka powinno się wstawić po jednym N- (dla II-rzędowych), po dwóch N- (dla II-rzędowych) nazwy grup funkcyjnych, występujących w tym amidzie (z zaznaczeniem ich liczności dla dwóch takich samych podstawników di-, w przypadku amidów III-rzędowych), oraz część nazwy kwasu karboksylowego, np. N-fenyloetanoamid.
Nazwa zalecana przez IUPAC (inne nazwy) | Wzór ogólny | Wzór grupowy |
Formamid (metanoamid) | 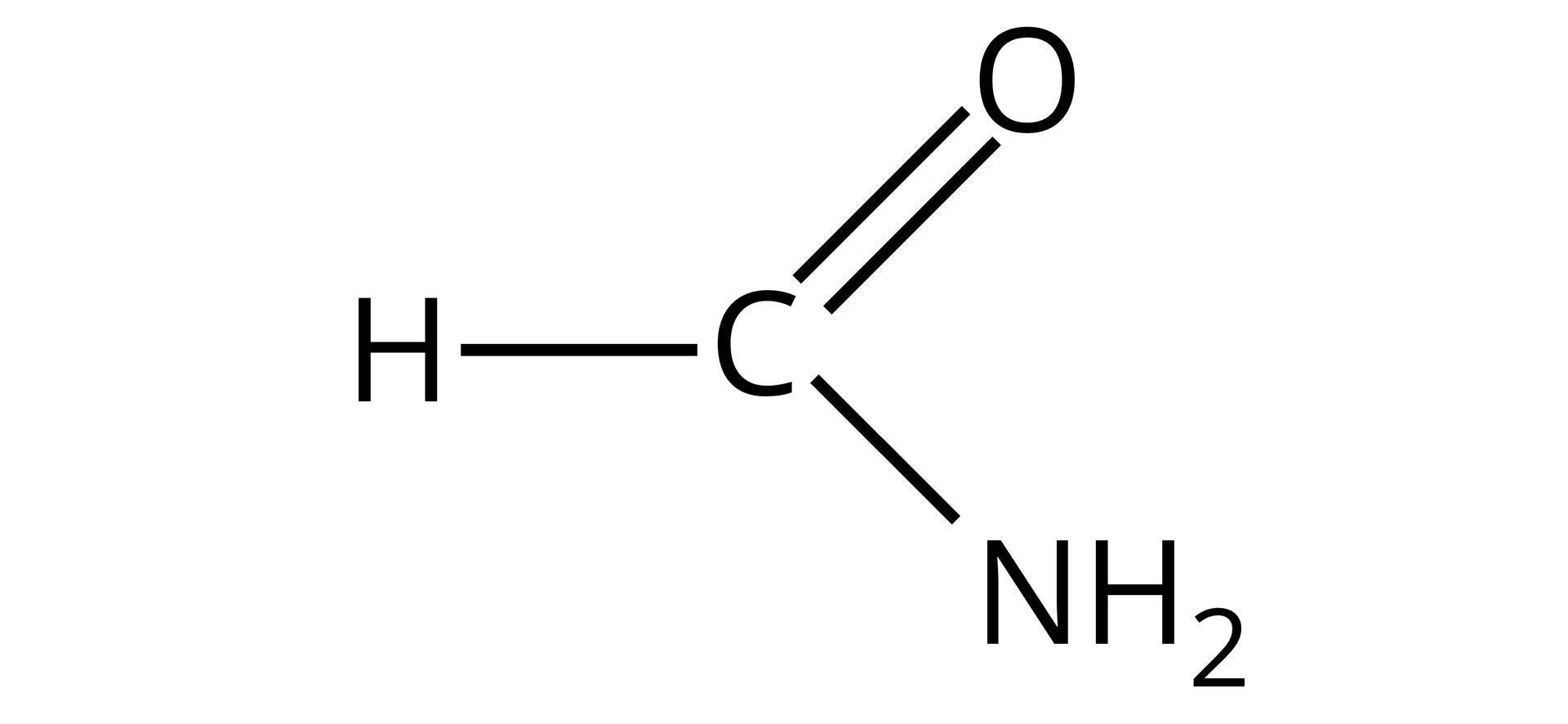 Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | |
Acetamid (etanoamid) | 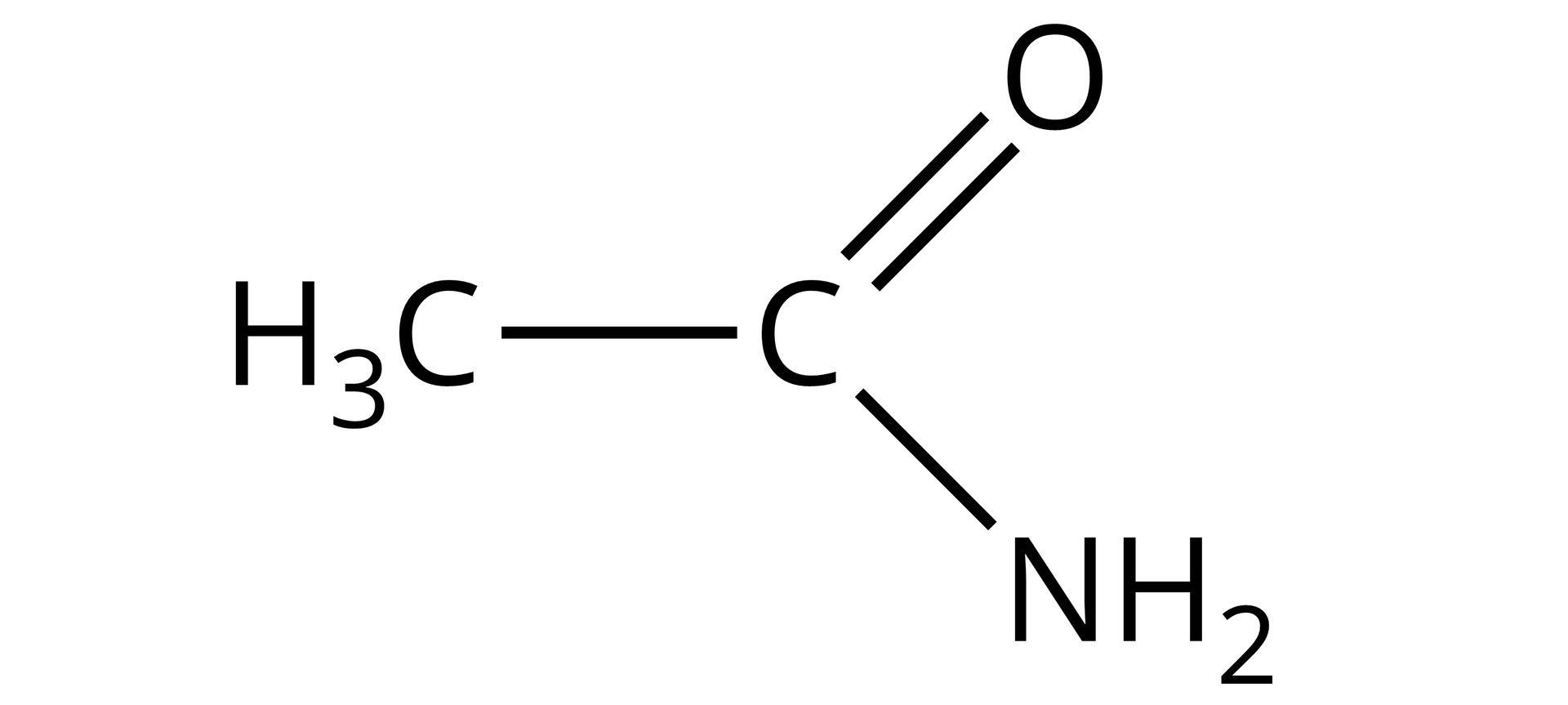 Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | |
Mocznik (diamid karbonowy, diamid kwasu węglowego) | 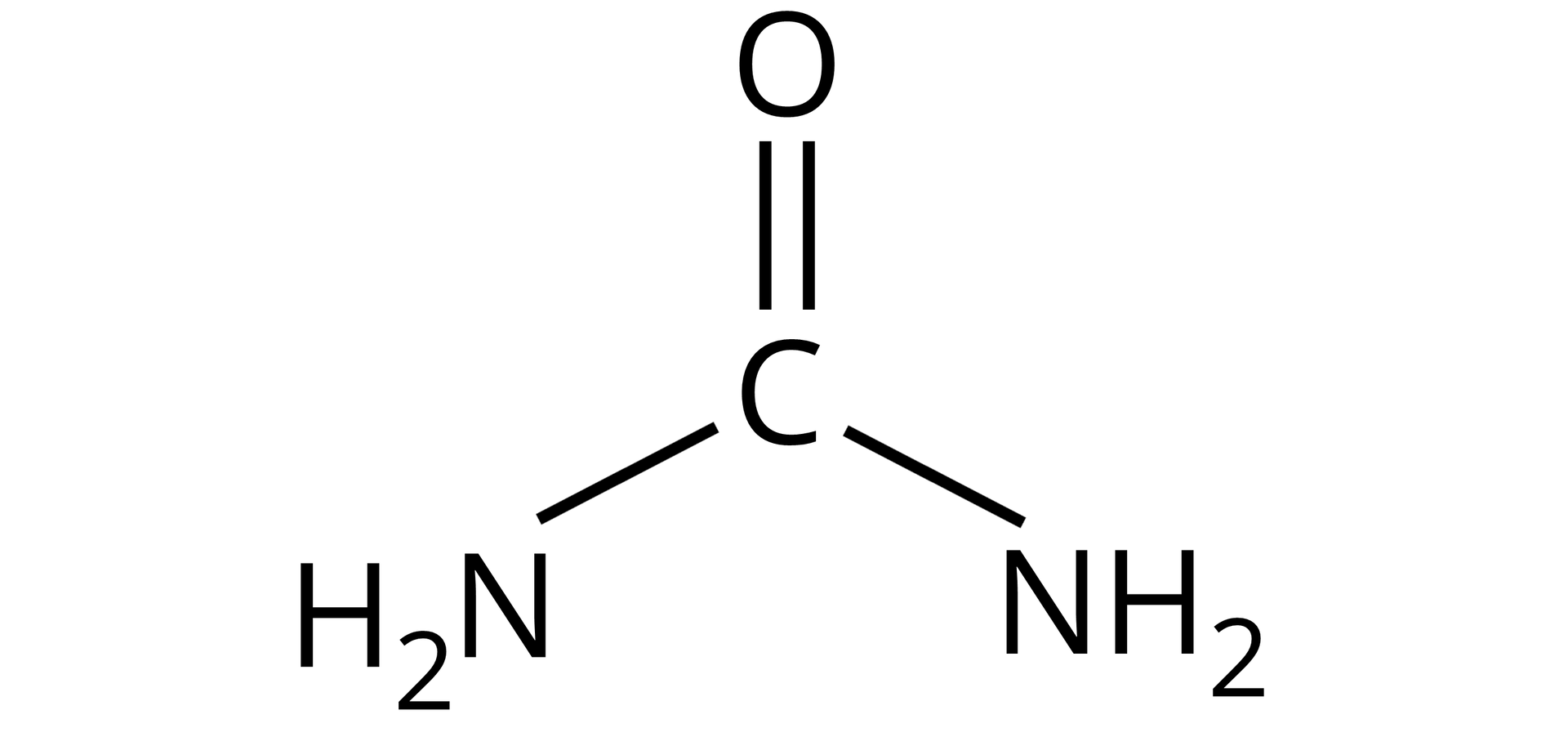 Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | |
,-dimetyloformamid |  Źródło: GroMar Sp. z o. o., licencja: CC BY-SA 3.0. | |
Benzamid (benzenokarboksyamid) |  Źródło: GroMar Sp. z o.o., licencja CC BY‑SA 3.0 |
Indeks górny Opracowano na podstawie: Lelek‑Borkowska U., Podstawy chemii organicznej., online: www.chemia.odlew.agh.edu.pl/dydaktyka/Dokumenty/ChO_IMiR/Lab_niestacjonarne/Podstawy%20chemii%20organicznej_teoria.pdf, dostęp: 29.09.2021. Indeks górny koniecOpracowano na podstawie: Lelek‑Borkowska U., Podstawy chemii organicznej., online: www.chemia.odlew.agh.edu.pl/dydaktyka/Dokumenty/ChO_IMiR/Lab_niestacjonarne/Podstawy%20chemii%20organicznej_teoria.pdf, dostęp: 29.09.2021.
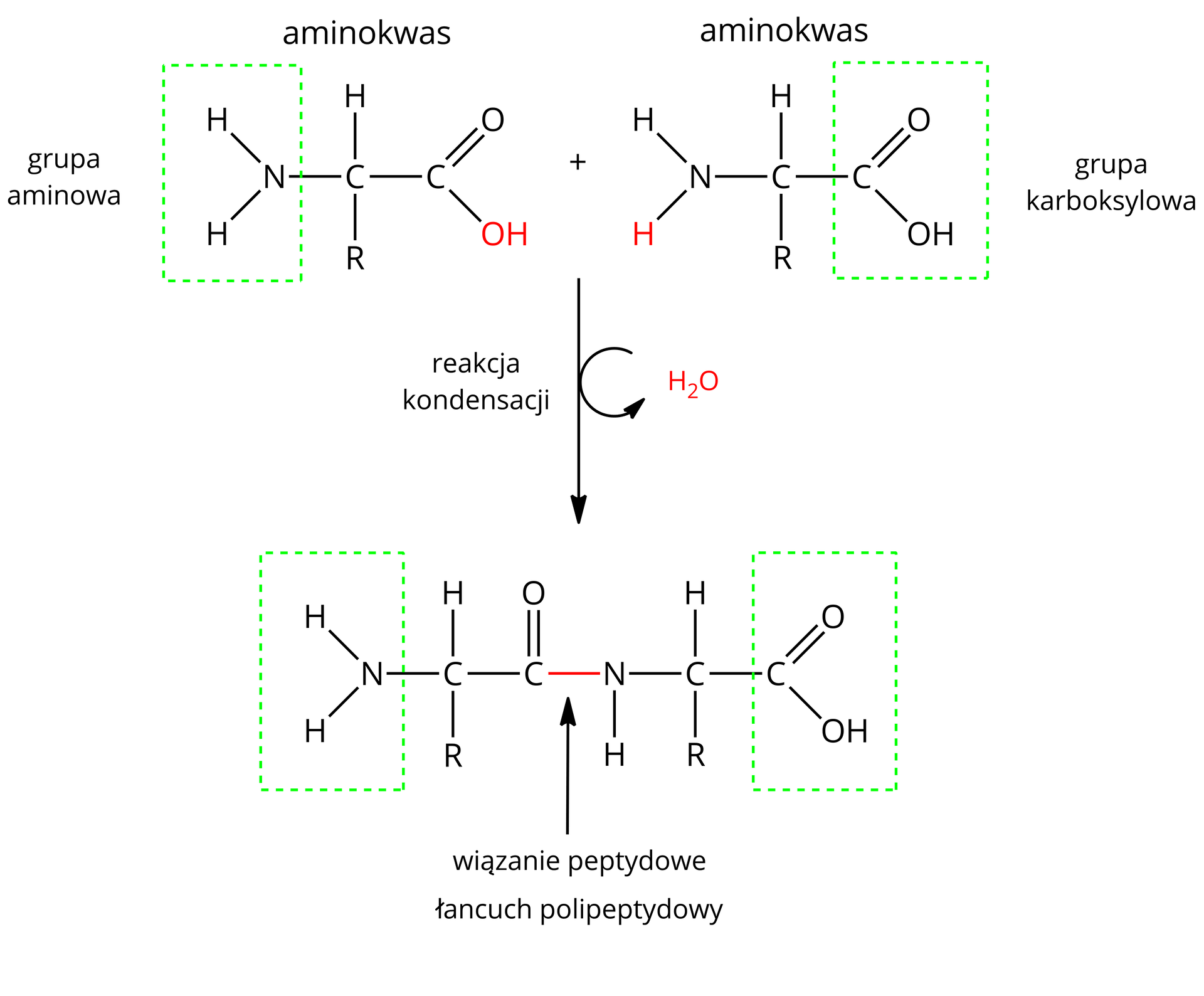
Reakcja między aminami i kwasami karboksylowymi, która prowadzi do tworzenia amidów, jest bardzo ważna z biologicznego punktu widzenia. To właśnie dzięki niej aminokwasy (cząsteczki zawierające zarówno podstawniki aminowe, jak i karboksylowe) łączą się ze sobą w duże liniowe związki (polipeptydy będące przykładami polimerów), tworząc tym samym białka. Białka to duże cząsteczki biologiczne, zbudowane z długich łańcuchów polipeptydowych. Organizmy wykorzystują je do różnych funkcji życiowych, np.: do transportu cząsteczek przez błony komórkowe, replikacji DNA czy katalizowania reakcji metabolicznych.
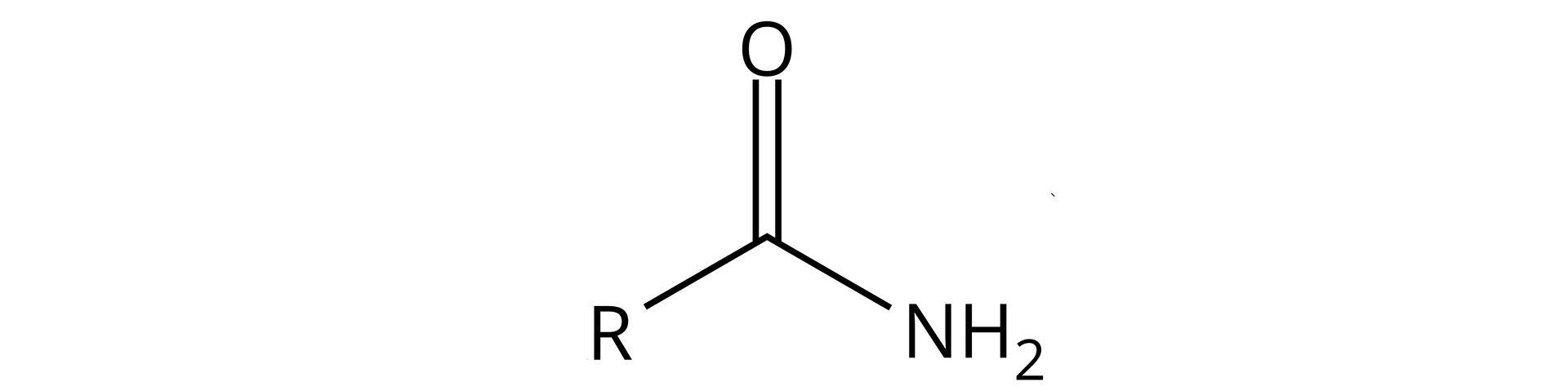
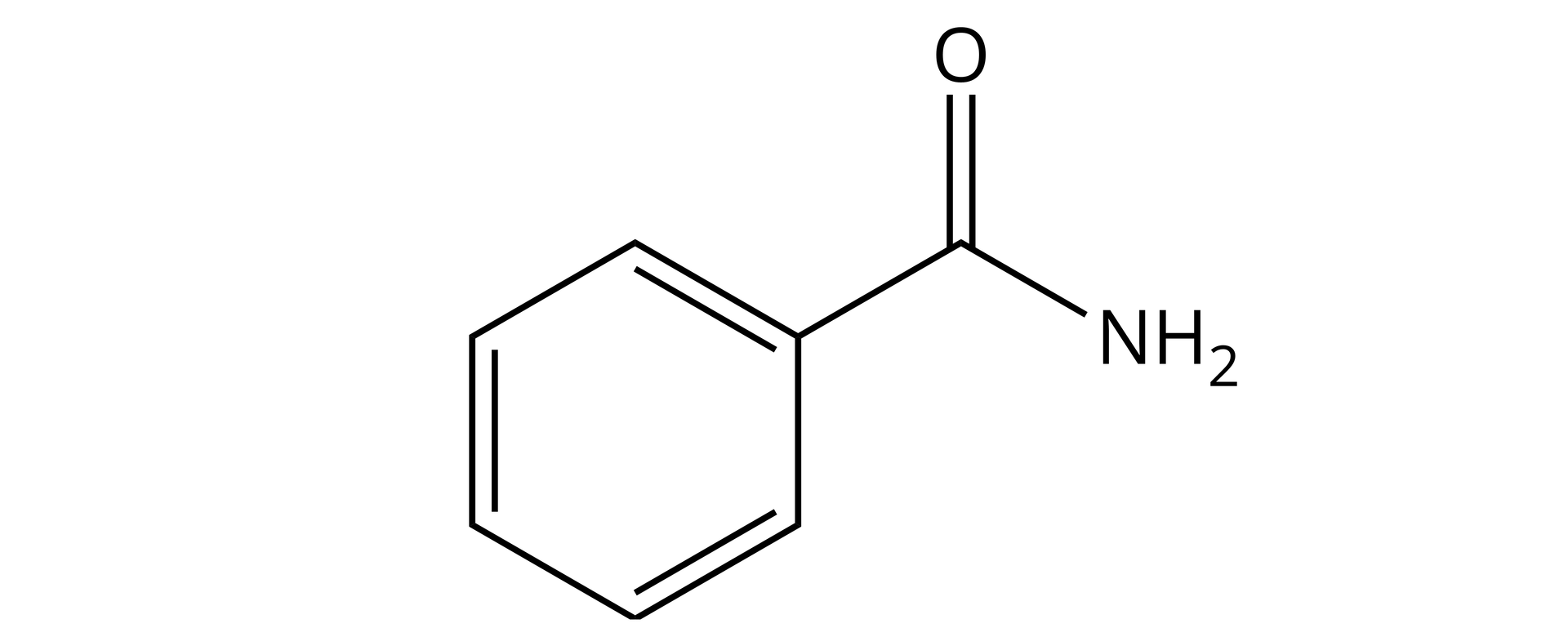
Narysuj wzór strukturalny benzamidu.
Nazwa podanego amidu wskazuje na to, że jest to amid pierwszorzędowy. Ogólny wzór strukturalny amidów pierwszorzędowych jest następujący:
Nazwa amidu wskazuje na to, że w miejsce podstawnika należy wstawić grupę fenylową. Wygląda ona następująco:

Grupę tę należy umieścić we wzorze ogólnym, w miejscu podstawnika . Wówczas wzór strukturalny amidu wygląda następująco:
Narysuj wzór strukturalny -etylo--metyloformamidu.
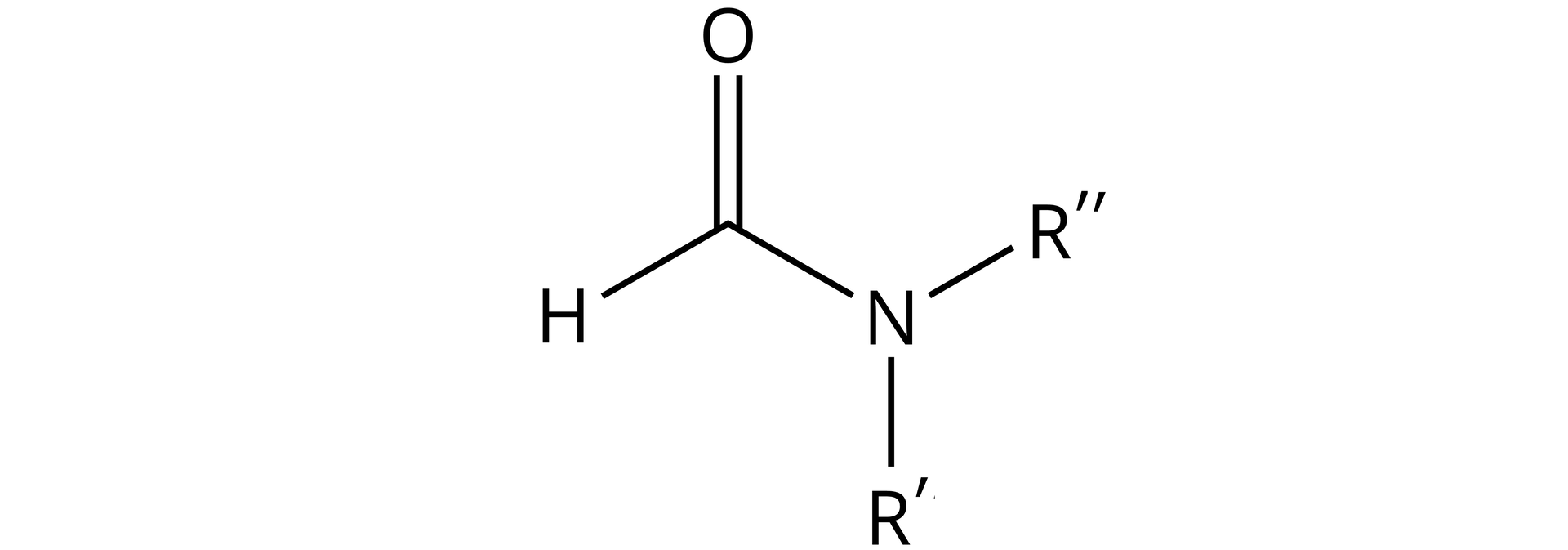
Nazwa podanego amidu wskazuje na to, że jest to amid trzeciorzędowy (ponieważ dwa atomy azotu z grupy aminowej są podstawione i wskazują na to litery umieszczone w nazwie amidu). Ogólny wzór strukturalny amidów trzeciorzędowych jest następujący:
Nazwa amidu wskazuje na to, że w miejsce podstawnika należy wstawić atom wodoru, ponieważ amid ten jest pochodną kwasu mrówkowego (kwasu metanowego) (w nazwie amidu czytamy -etylo--metyloformamidu). Kwas mrówkowy posiada wyłącznie jeden atom węgla, zatem:
Jednym z podstawników, który występuje przy atomie azotu, jest grupa etylowa:
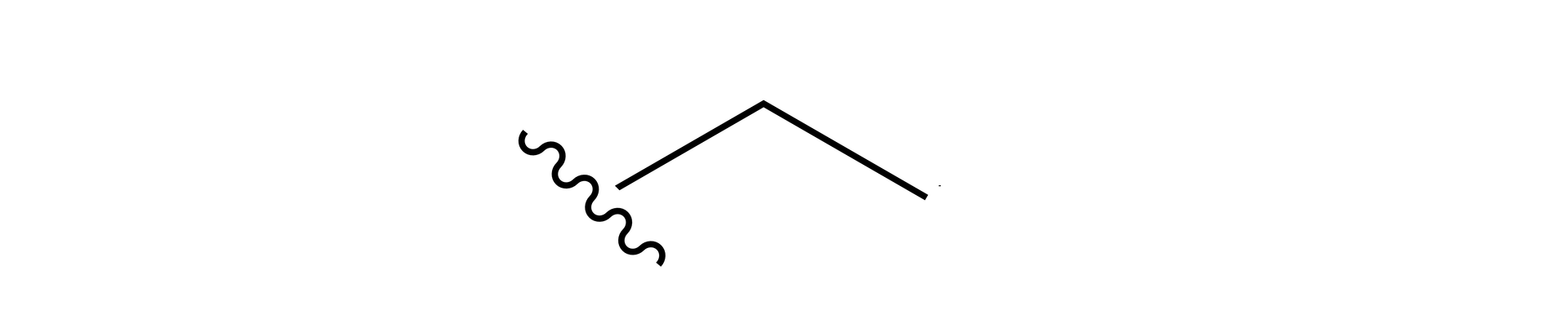
Po wstawieniu tej grupy, częściowy wzór strukturalny tego amidu wygląda następująco:
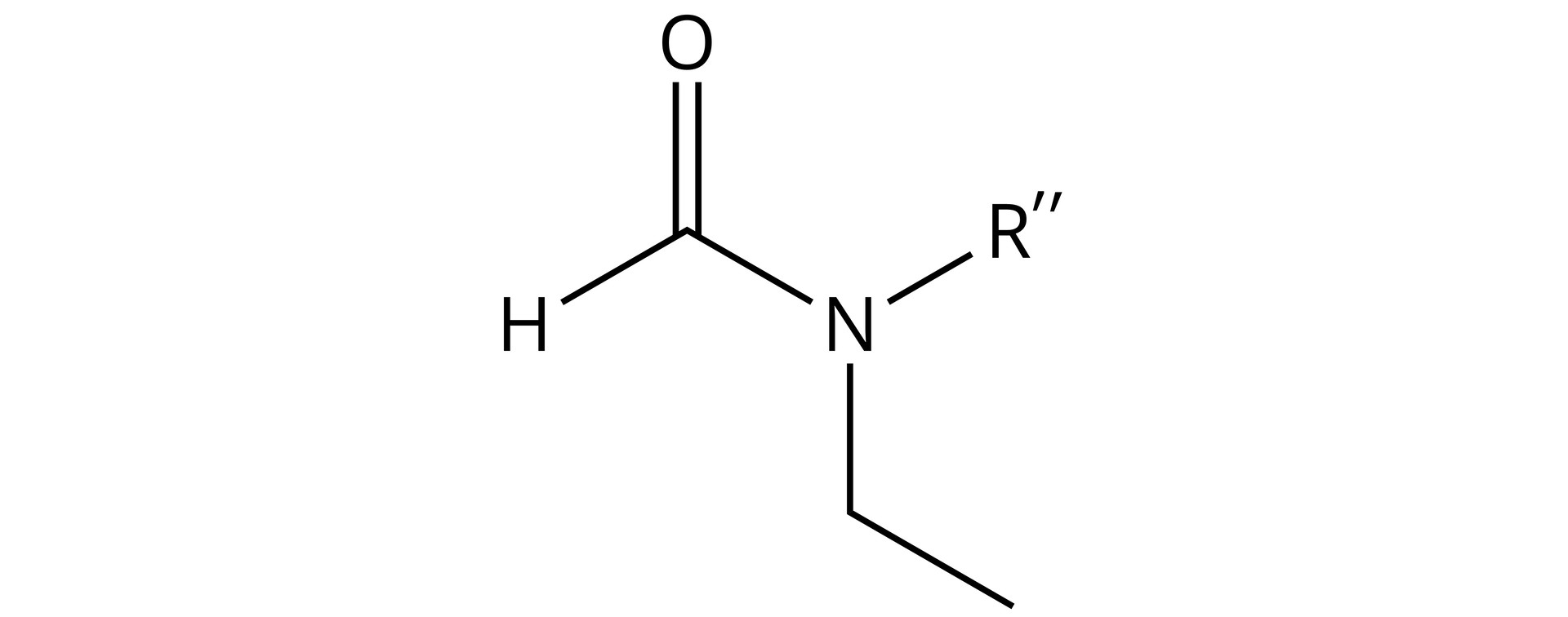
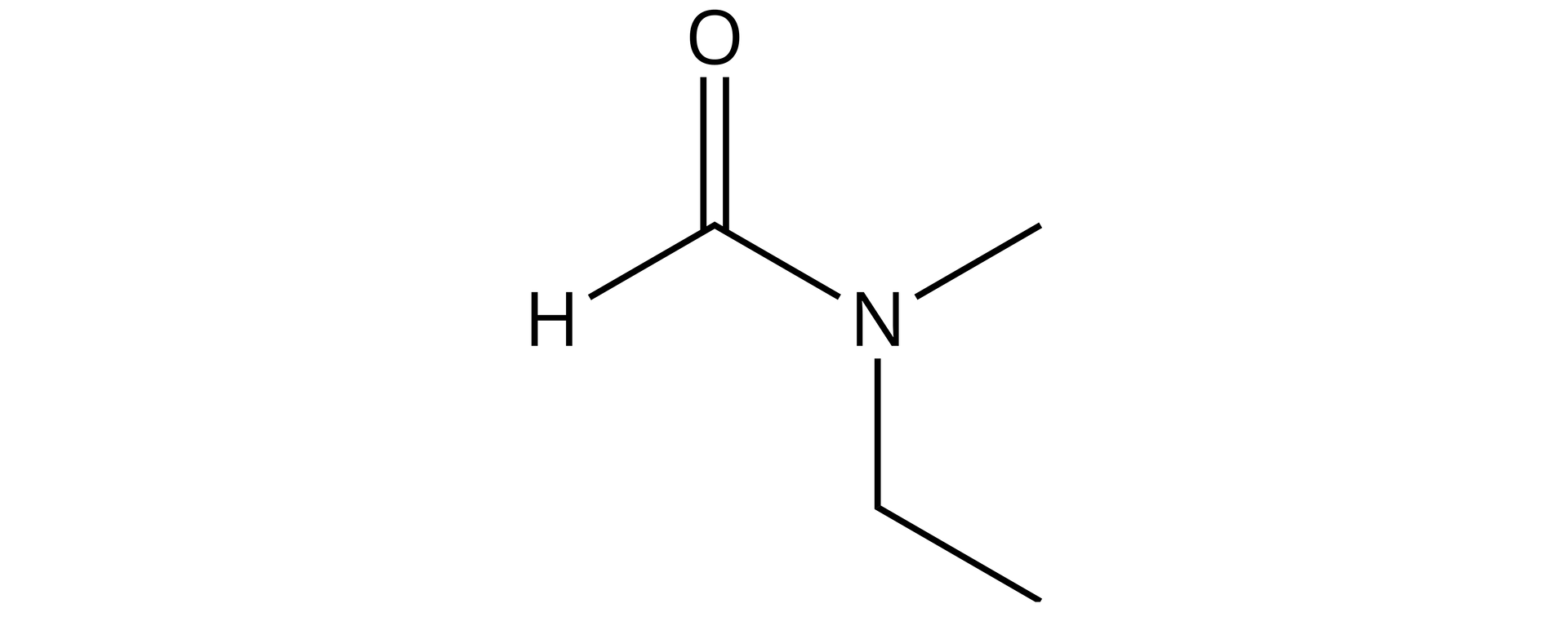
Drugim i zarazem ostatnim możliwym podstawnikiem na atomie azotu jest grupa metylowa. Po wstawieniu jej do wzoru strukturalnego tego amidu, wzór ostateczny wygląda następująco:
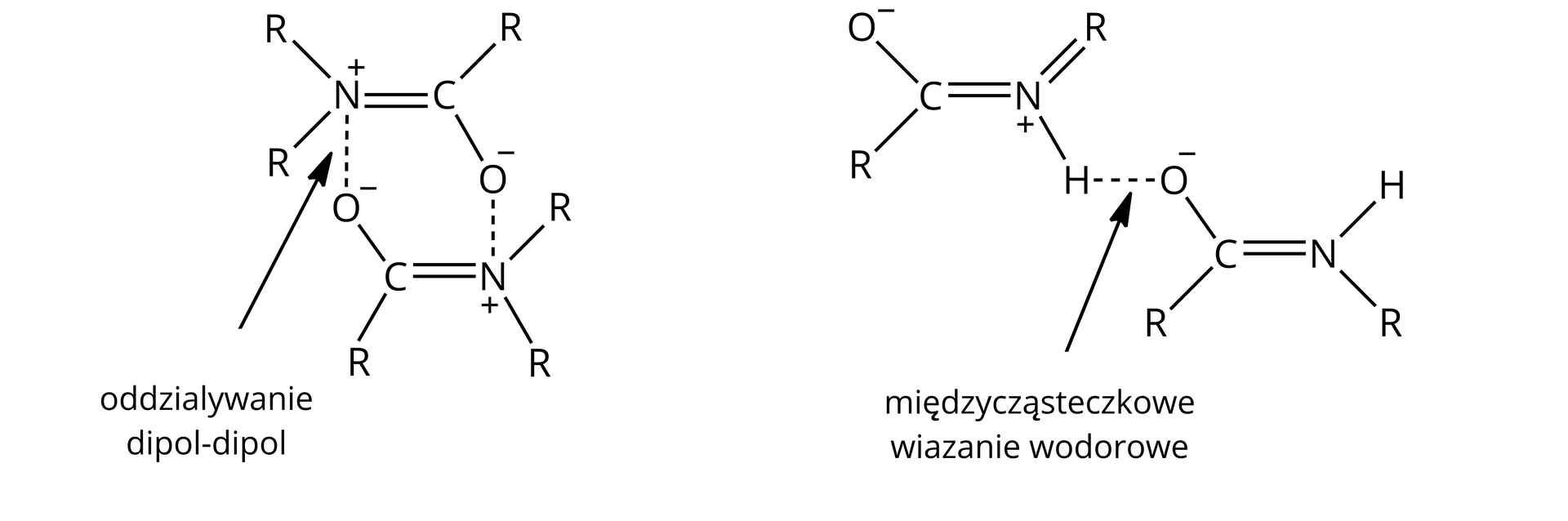
Amidy kwasowe posiadają wysokie temperatury wrzenia, które uwarunkowane są występowaniem pomiędzy ich cząsteczkami oddziaływań międzycząsteczkowych, tj. dipol‑dipol i wiązań wodorowych. Amidy pierwszorzędowe i drugorzędowe, ze względu na występujące w ich budowie wiązania azotowo‑wodorowe, mogą tworzyć wiązania wodorowe. Te oddziaływania międzycząsteczkowe wpływają na właściwości tych związków, dzięki czemu charakteryzują się m.in. wyższymi temperaturami wrzenia.

Z amidów otrzymywane są różne polimery, które – ze względu na swoje unikalne właściwości – wykorzystywane są w różnych celach. Przykładami takich polimerów są np. polipeptydy, nylon i kevlar. Ten ostatni jest syntetycznym polimerem (poliamidem), otrzymywanym z monomerów benzeno-,-diaminy i chlorku tereftaloilu (firma DuPont, rok). Posiada on wysoką wytrzymałość na rozciąganie (jest około pięć razy mocniejszy niż stal) i nie rozpuszcza się w rozpuszczalnikach organicznych. Jego wysoka wytrzymałość związana jest ze sposobem przędzenia włókien – są wyciągane z roztworu kevlaru w kwasie siarkowym, w którym powstaje faza ciekłokrystaliczna. Dzięki temu włókno wykazuje bardzo wysoki stopień organizacji cząsteczek. Dodatkowo włókna polimeru są stabilizowane występowaniem wiązań wodorowych pomiędzy nimi. Ze względu na to Kevlar stosowany jest jako zamiennik stali w oponach wyścigowych, jako materiał do produkcji żagli, kamizelek kuloodpornych, hełmów bojowych, masek na twarz, do ochrony pojazdów bojowych i lotniskowców, a także do produkcji sprzętu ochronny dla personelu ratunkowego czy odzieży termicznej dla strażaków.
Słownik
związki organiczne, będące pochodnymi kwasów organicznych, w których grupa hydroksylowa została podstawiona grupą aminowa (pochodzącą od aminy lub amoniaku)
oddziaływania międzycząsteczkowe pomiędzy cząsteczkami, które posiadają trwałe momenty dipolowe (o ujemnym namiarowym ładunku z jednej strony, a niedomiarem z drugiej strony), dzięki którym oddziałują ze sobą jak jony
jeden z rodzajów oddziaływań międzycząsteczkowych; są tworzone przez atom wodoru z wolnymi parami elektronowymi silnie elektroujemnych atomów, zwłaszcza azotu, tlenu i fluoru (o małych promieniach atomowych); może powstawać pomiędzy cząsteczkami tego samego rodzaj jak i różnych związków
związek organiczny, którego cząsteczka zawiera grupę karboksylową () połączoną z grupą alifatyczną, alicykliczną, aromatyczną lub heterocykliczną
związek organiczny; pochodna amoniaku, w którego cząsteczce jeden, dwa lub trzy atomy wodoru są zastąpione grupami alifatycznymi (aminy alifatyczne) lub aromatycznymi (aminy aromatyczne)
substancja amfoteryczna; indywiduum chemiczne mogące w zależności od środowiska reakcji zachowywać się jak kwas lub jak zasada
reakcja dwóch cząsteczek, w wyniku której powstaje główny produkt oraz odszczepiony zostaje produkt uboczny
zjawisko występowania stanu równowagi chemicznej między różnymi izomerami strukturalnymi, które przechodzą w siebie nawzajem, najczęściej w wyniku migracji protonów
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Związki organiczne zawierające azot oraz wielofunkcyjne pochodne węglowodorów. Repetytorium i zadania, Kraków 2021.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Równowagi i procesy jonowe, Gdynia 2005.
Amines and Amides. Learning Objectives, online: https://openstax.org/books/chemistry‑atoms‑first‑2e/pages/21‑4-amines‑and‑amides, dostęp: 29.09.2021.