Przeczytaj
Czym są reakcje redoks?
Reakcje redoks, nazywane inaczej reakcjami utleniania‑redukcji, to takie, w wyniku których następuje zmiana stopnia utlenienia atomów pierwiastków chemicznych. Procesy utleniania i redukcji zachodzą równocześnie i żaden z nich nie może zajść bez drugiego.
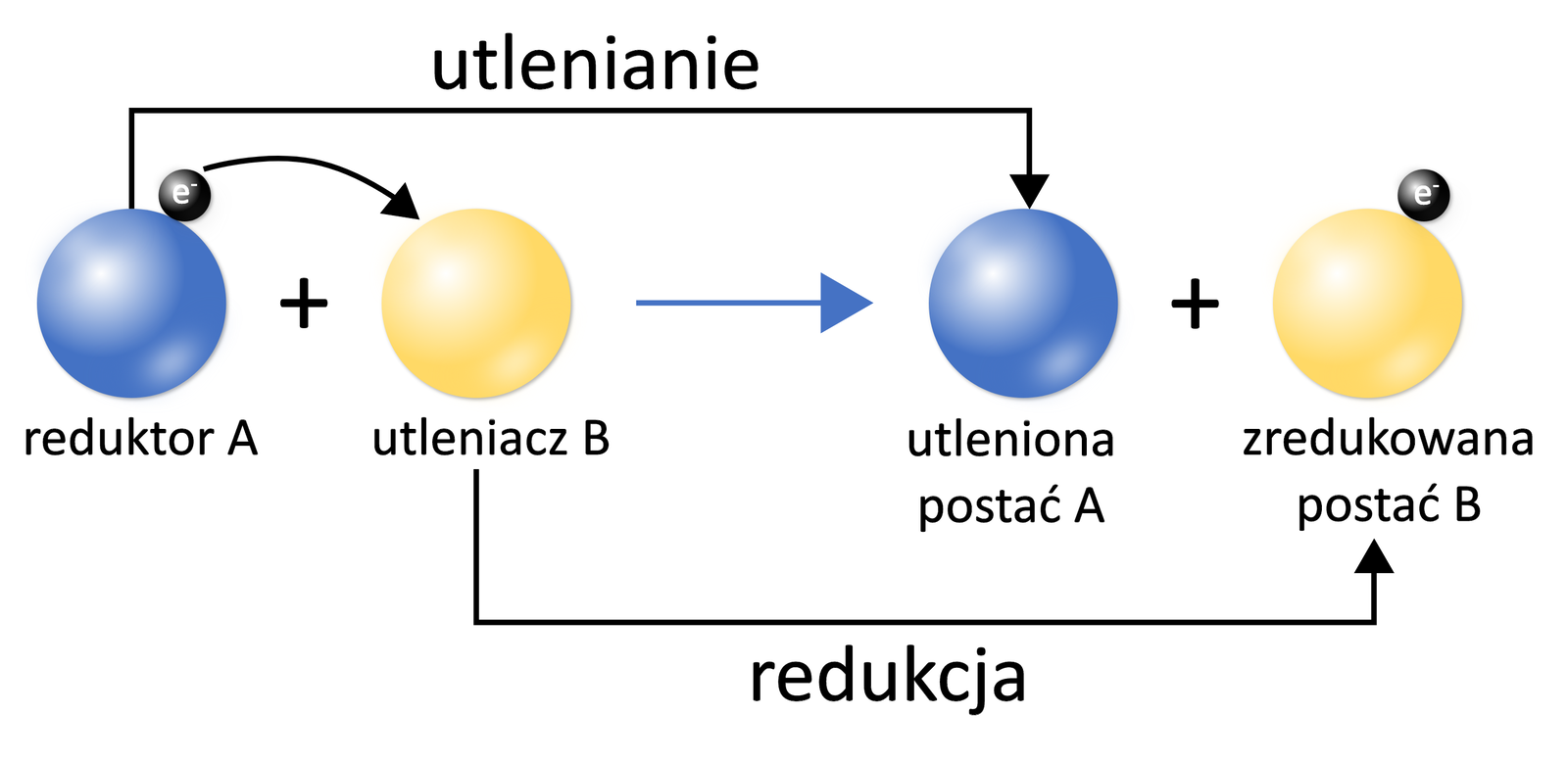
Reakcje utleniania wiążą się ze zwiększaniem stopnia utlenienia atomu (lub atomów) reduktora, a reakcje redukcji ze zmniejszeniem stopnia utlenienia atomu (lub atomów) utleniacza. Utleniacz jest indywiduum, którego atom (lub atomy) ulegają redukcji (zwiększają swój stopień utlenienia), zaś reduktor ulega wówczas utlenieniu (zwiększeniu stopnia utlenienia).
Reakcje redoks dookoła nas
Fotosynteza
To proces zachodzący w roślinach. Dzięki niemu rośliny przekształcają tlenek węgla(), w wyniku czego powstaje m.in. tlen. Sumaryczne równanie procesu fotosyntezy możemy zapisać jako:
W trakcie opisanej reakcji woda pełni rolę donora elektronów, czyli reduktora, a utlenieniu ulega atom tlenu, który wchodzi w jej skład. Rolę akceptora elektronów – utleniacza – pełni z kolei tlenek węgla(), wówczas redukcji ulegają atomy węgla. Reakcje fotosyntezy zachodzą pod wpływem światła w komórkach roślin. Ubocznym produktem tego procesu jest tlen, niezbędny do prawidłowego funkcjonowania wielu organizmów. Stąd właśnie lasy Amazonii nazywane są „zielonymi płucami świata”.
Reakcje redoks w pozyskiwaniu i magazynowaniu energii
Głównym źródłem energii elektrycznej w Polsce jest energetyka konwencjonalna, opierająca się na węglu. Proces spalania węgla w tlenie jest również przykładem reakcji redoks.
W powyższej reakcji chemicznej węgiel jest utleniany, dlatego pełni funkcję reduktora. Tlen natomiast jest utleniaczem, zmniejszając swój stopień utlenienia – redukuje się. W wyniku tej reakcji chemicznej wydziela się znaczna ilość ciepła, którą wykorzystuje się do generowania pary wodnej. Ta z kolei napędza turbiny, co ostatecznie prowadzi do powstania prądu elektrycznego.
Oglądając telewizję i przełączając kanały, również mamy do czynienia z reakcjami redoks. W każdym pilocie znajdują się baterie, które są niczym innym jak ogniwemogniwem Leclanchégo.
Ogniwo Leclanchego oryginalnie zbudowane jest z dwóch elektrodelektrod: węglowej – w porowatym naczyniu ze sproszkowanym tlenkiem manganu() – i cynkowej – zanurzonej w nasyconym roztworze chlorku amonu. Obecnie możemy je znaleźć w bateriach, których obecna budowa znacznie różni się od tej początkowej, zaprojektowanej przez Lechlanchego pod koniec

Bezpośrednim źródłem prądu w ogniwie są reakcje redukcji kationów manganu na elektrodzie węglowej, która pełni funkcję katody, oraz utleniania cynku do kationów cynku na elektrodzie cynkowej, która z kolei pełni funkcję anody. Reakcje zachodzące w ogniwie można zapisać w sposób przedstawiony poniżej.
Reakcja anodowa:
Reakcja katodowa:
Sumaryczne równanie reakcji:
SEMSEM (siła elektromotoryczna) takiego ogniwa wynosi .
Ogniwo Leclanchégo jest ogniwem nieregenerowalnym. Kiedy zużyją się składniki tworzące baterię, nie można ich już odtworzyć. Bateria tego typu nie jest wygodna w użyciu. Zdecydowanie bardziej komfortowe są tzw. akumulatory, czyli ogniwa, które po wyczerpaniu mogą zostać zregenerowane i pracować ponownie. Regeneracja odbywa się w wyniku podłączenia zewnętrznego źródła prądu, który wymusza zajście procesów przeciwnych do tych mających miejsce w czasie pracy ogniwa. Przykładem tego typu układu jest akumulator ołowiowy.
Podczas korzystania z samochodu, bardzo ważnym aspektem jest odpowiedni poziom naładowania akumulatora. Pełni on rolę baterii magazynującej energię. Jednym z najczęściej spotykanych akumulatorów jest kwasowo‑ołowiowy. Składa się z elektrody ołowiowej, elektrody z tlenku ołowiu() oraz z wodnego roztworu kwasu siarkowego( o stężeniu około . W akumulatorach zachodzą procesy odwracalne.
AnodaAnoda:
KatodaKatoda:
Korozja metali
Niezabezpieczone przed czynnikami atmosferycznymi, stalowe części metalowych konstrukcji z czasem pokrywają się charakterystycznym rdzawym nalotem tlenków. Korozja metali jest jednym z przykładów reakcji redoks, zachodzących dookoła nas. To złożony proces, w którym elektrony z atomów żelaza przenoszone są na atomy tlenu. Żelazo pełni funkcję reduktora, oddając elektrony i zwiększając swój stopień utlenienia. Tlen, kiedy przyjmuje elektrony, redukuje się, pełniąc tym samym funkcję utleniacza. Jednym z czynników przyspieszających proces korozji jest woda oraz obecność elektrolitówelektrolitów (np. roztworów soli).
Pod wpływem niskiego pH, żelazo utleniane jest do żelaza():
Następnie jony żelaza() ulegają dalszemu częściowemu utlenieniu do jonów żelaza(). Redukcji ulega wówczas tlen, co można opisać następującym równaniem:
Reakcje utleniania‑redukcji powszechnie występują dookoła nas. Jak łatwo zauważyć, czasami mają pozytywny aspekt w naszym życiu (produkcja i przechowywanie energii czy też otrzymywanie tlenu), a czasami negatywny (korozja metali).
Słownik
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) związek chemiczny, który ulega procesowi rozpadu na jony pod wpływem wody i jest zdolny do przewodzenia prądu elektrycznego; gdy jest całkowicie zdysocjowany, mówimy o elektrolicie mocnym
układ, w którym – na skutek zachodzenia procesów chemicznych – powstaje prąd elektryczny
(gr. ḗlektron „bursztyn”, hodós „droga”) układ składający się z przewodnika elektronowego stykającego się z przewodnikiem jonowym
(gr. káthodos „schodzenie”) elektroda, na której zachodzi reakcja redukcji
(gr. ana „w górę”, hodós „ścieżka”) elektroda, na której zachodzi reakcja utleniania
siła elektromotoryczna, różnica potencjałów katody i anody
Bibliografia
Encyklopedia PWN
Pigoń, Ruziewicz Chemia fizyczna, cz. , PWN, Warszawa
Bielański A., Podstawy chemii nieorganicznej, t. , Warszawa .
Pajdowski L., Chemia ogólna, Warszawa .
Atkins P., Jones L., Podstawy chemii, Warszawa