Przeczytaj
Efekt kierujący podstawników w pierścieniu benzenu
BenzenBenzen () jest związkiem organicznym, stanowiącym najprostszy aromatyczny węglowodór. Aren ten ulega reakcji substytucji elektrofilowej, w efekcie czego znanych jest wiele pochodnych benzenu.
Związki te, ze względu na swoje zróżnicowane właściwości, mają różnorodne zastosowania: w farmacji do syntezy leków (np. kwas acetylosalicylowy), w przemyśle polimerów (np. styropian z polistyrenu), w rolnictwie (np. insektycydy jak karbaryl) czy w przemyśle farbiarskim. Większość z nich stanowi związki o różnych podstawnikach, do których otrzymania należy stosować wieloetapowe syntezy. W wyniku substytucji elektrofilowej, z benzenu można otrzymać wyłącznie jedną pochodną jednopodstawioną. Pozostaje pytanie – w jaki sposób będzie zachodzić reakcja z udziałem podstawionego uprzednio pierścienia benzenowego?
Podstawniki już obecne w benzenie mogą wpływać zasadniczo na dwa aspekty:
1. Na reaktywność pierścienia w reakcjach substytucji.
Niektóre z przyłączonych do pierścienia benzenowego podstawników mogą aktywować pierścień, powodując, że jest on bardziej reaktywny niż benzen, lub też dezaktywować go, w wyniku czego staje się mniej reaktywny od benzenu. Przykładowo, dla reakcji nitrowania podstawnik powoduje zwiększenie aktywności o tysiąckroć (względem benzenu), a podstawnik sprawia, że podstawiony pierścień benzenowy jest razy mniej reaktywny.
2. Na orientację podstawienia w pierścieniu benzenowym.
Podstawniki decydują o miejscu wprowadzenia kolejnych podstawników w pozycje -, - lub - względem siebie. Efekt ten nazywa się kierującym efektem podstawnikaefektem podstawnika (lub kierującej roli podstawnika). Należy mieć jednak na uwadze fakt, że powstaje wówczas na ogół mieszanina różnych produktów. Wśród nich największą wydajność ma ten, który został podstawiony zgodnie z efektem tego podstawnika. Podstawniki dzielą się na trzy grupy:

aktywujące kierujące w położenie - i -;
dezaktywujące kierujące w położenie - i -;
dezaktywujące kierujące w położenie -.
Czy istnieje związek reaktywności z efektem kierującym?
Odpowiedzią na to pytanie może być poniższy schemat. Można z niego wywnioskować, że grupy kierujące w pozycje - i - mają charakter aktywujący, a grupy kierujące w pozycję - mają charakter dezaktywujący.

Kontrola reaktywności i orientacji nowych podstawników w pierścieniu związana jest z efektem indukcyjnym i rezonansowym. Oba te efekty pozwalają na wyjaśnienie, dlaczego dany podstawnik kieruje pozostałe w takie, a nie inne pozycje w pierścieniu. Efekty indukcyjne są związane z elektroujemnością atomów i polarnością wiązań w grupach funkcyjnych. Zatem elektrony są „wyciągane” lub „oddawane” przez wiązania (sigma). Przykładowo: podstawniki, tj. halogeny, „wyciągają” elektrony, a z kolei grupy alkilowe je „oddają”. Efekty rezonansowe są związane z nakładaniem się dwóch orbitali (orbiatlu podstawnika i orbitalu pierścienia). Ich wynikiem jest „wyciąganie” lub dostarczanie elektronów przez wiązania . Znów – analizując podstawniki nitrylowy i karbonylowy, to te „wyciągają” elektrony na skutek tego efektu.
Wszystkie grupy aktywujące dostarczają elektrony, co powoduje stabilizację produktu pośredniego – karbokationukarbokationu, i sprawiają, że jest on szybciej tworzony. Grupy dezaktywujące „wyciągają” elektrony, tym samym destabilizując karbokation (tworzy się wolniej). Obydwa efekty nie muszą działać zgodnie w jednym kierunku.

W prezentowanym przykładzie, nitrowanie toluenu może nastąpić w trzech pozycjach. Jednak analiza tworzonych karbokationów pozwala zauważyć, że najbardziej trwałe są podstawione w pozycji orto i para, ponieważ ładunek dodatni jest zgromadzony na trzeciorzędowym atomie węgla.
Jaki produkt główny powstanie w wyniku poniższej reakcji?
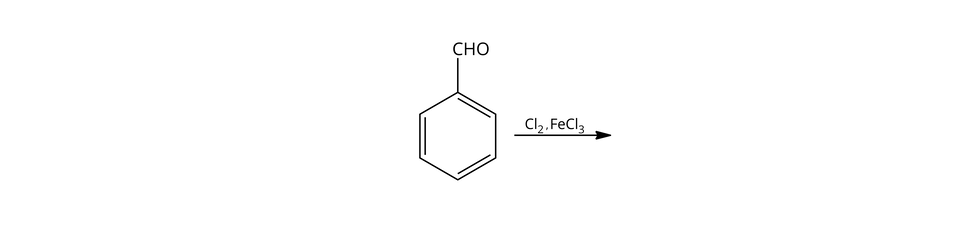
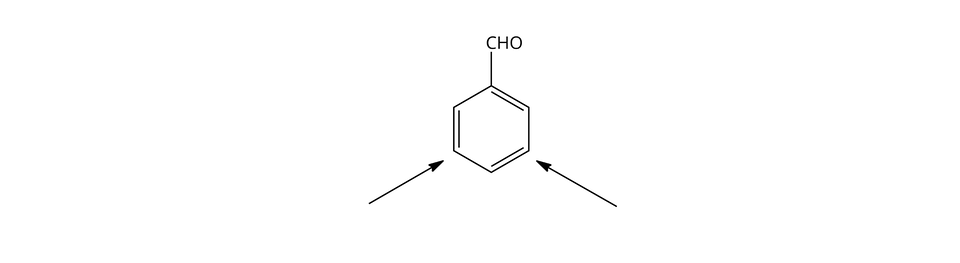
Należy ustalić efekt kierujący grupy .

Efekt kierujący tej grupy jest w pozycję -.
Dlatego produktem głównym tej reakcji będzie benzaldehyd, podstawiony w pozycji - (-chlorobenzaldehyd).
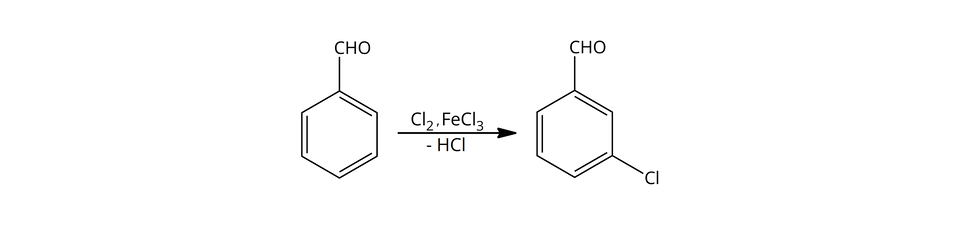
Przykłady efektu kierującego podstawników

Jak widać w przypadku prezentowanych przykładów, pomimo efektu kierującego, często otrzymywana jest mieszanina różnie podstawionych produktów. To, jaką ilość danego produktu otrzymamy, możemy wyznaczyć doświadczalnie. Ale o tym, jaki produkt główny powstanie w wyniku danej reakcji, wywnioskujemy już po efekcie kierującym podstawnika.
Addytywność efektu podstawnikowego
Addytywność efektu podstawnikowego jest związana z efektem indukcyjnym i rezonansowym. Zależy ona od trzech zasad:
Jeśli efekty kierujące dwóch podstawników są zgodne i kierują podstawnik w to samo miejsce, to tylko wzajemnie się wzmacniają, w efekcie czego powstaje jeden produkt substytucji elektrofilowejsubstytucji elektrofilowej, np.:

Jeśli efekty kierujące dwóch podstawników są niezgodne, w efekcie powstaje w głównej mierze produkt (często mieszaniny produktów), sugerowany przez silniejszą grupę aktywującą, np.:

W przypadku reakcji substytucji elektrofilowej fenolu zwykle powstaje pochodna tri, podstawiona ze względu na silnie aktywujący wpływ grupy hydroksylowej.
Jeśli podstawienie trzeciej grupy ma mieć miejsce w związku z podstawieniem w pozycji -, to możliwe jest tylko powstawanie dwóch typów związków. Rzadko kiedy zostaje podstawiona pozycja pomiędzy dwoma podstawnikami, ponieważ jest ona wówczas sterycznie zbyt zatłoczona.

Słownik
związek organiczny o wzorze sumarycznym ; stanowi podstawowy węglowodór aromatyczny (najprostszy aren)
w trakcie substytucji elektrofilowej, obecny w pierścieniu benzenowym podstawnik decyduje o miejscu podstawienia nowo wprowadzanego podstawnika
(łac. carbo „węgiel”, gr. katiṓn „idący w dół”) jon organiczny, w którym dodatni ładunek jest zlokalizowany na atomie węgla, co spowodowane jest deficytem elektronów
reakcja charakterystyczna dla związków aromatycznych, w której czynnikiem atakującym w niej jest elektrofil; oznaczana symbolem lub ; przykładami tej reakcji są: halogenowanie, nitrowanie, sulfonowanie, alkilowanie Friedela-Craftsa, acylowanie Friedela-Craftsa, formylowanie Gattermana-Kocha
Bibliografia
Dudek‑Różycki K., Płotek M., Wichur T., Węglowodory. Repetytorium i zadania, Kraków 2020.
Dudek‑Różycki K., Płotek M., Wichur T., Kompendium terminologii oraz nazewnictwa związków organicznych. Poradnik dla nauczycieli i uczniów, Kraków 2020.
www.chemia.uni.lodz.pl (dostęp: 06.09.2021)