Przeczytaj
Wodorki to związki wodoru z innymi pierwiastkami. Ze względu na skład, wodorki możemy podzielić na:
wodorki niemetaliniemetali – związki, w których wodór występuje na stopniu utlenieniastopniu utlenienia;
wodorki metalimetali – związki, w których wodór występuje na stopniu utlenienia.
Zmiany wartościowości pierwiastków bloku i względem wodoru
Pierwiastki chemiczne mogą tworzyć wodorki metali i niemetali. Tworzą je głównie pierwiastki bloku i , jak na poniższej grafice.

Pierwiastki bloku tworzą z wodorem tzw. wodorki metaliczne (śródwęzłowe). W większości nie można wyrazić ich prostymi wzorami, ponieważ są to związki niestechiometryczne.
Nomenklatura i wzory
Wzory sumaryczne wodorków tworzy się poprzez umieszczenie pierwiastka bardziej elektroujemnego po prawej stronie. Zatem poprawny zapis dla tego typu związku z sodem to , a nie . Do ustalenia wzoru sumarycznego wodorków ważne jest ustalenie, z jakim typem związku mamy do czynienia i jaki jest stopień utlenienia pierwiastka macierzystego (innego niż wodór), który go tworzy:
Wodorki pierwiastków i grupy układu okresowego
Wzory wodorków pierwiastków grupy i włącznie zapisuje się następująco:
– atom metalu lub niemetalu grupy , , , , oraz metale bloku ;
– symbol wodoru;
– indeks stechiometryczny, będący, co do wartości, równy stopniowi utlenienia metalu.
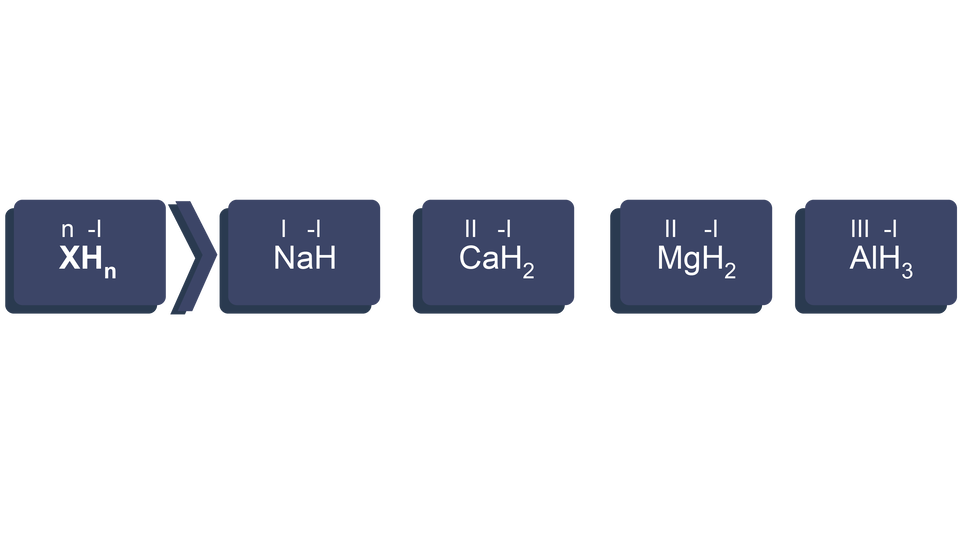
Nazwy takich wodorków tworzymy przez podanie słowa „wodorek” oraz podanie nazwy pierwiastka w dopełniaczu:
– wodorek sodu;
– wodorek wapnia;
– wodorek magnezu;
– wodorek glinu.
Wodorki pierwiastków i grupy układu okresowego
Wzory wodorków i grupy układu okresowego można zapisać ogólnie:
– atom niemetalu grupy i ;
– atom wodoru;
– indeks stechiometryczny, będący, co do wartości, równy wartości bezwzględnej ze stopnia utlenienia atomu niemetalu, połączonego z atomem wodoru.
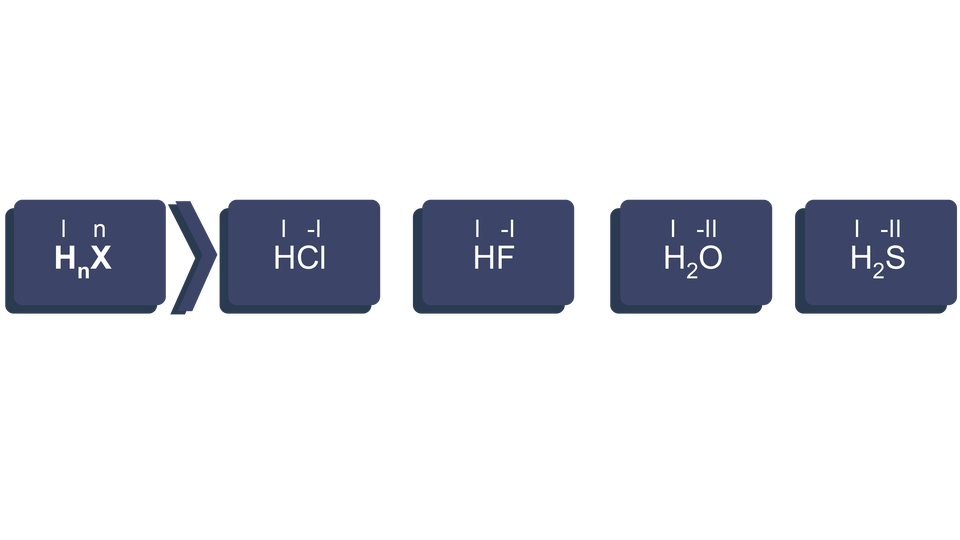
Nazwy tych wodorków tworzymy przez połączenie nazwy pierwiastka ze słowem „wodór” za pomocą litery „o”:
– chlorowodór;
– fluorowodór;
– siarkowodór;
– dla tego związku zwyczajowo stosujemy nazwę: woda.
Oczywiście dopuszczalne jest stosowane nazw „wodorek fluoru” w miejsce „chlorowodór”, czy „wodorek siarki” w miejsce „siarkowodór”, etc. Jako ciekawostkę należy wskazać, że nazwą zalecaną dla tlenku wodoru, czyli wody, jest oksydan, a dla amoniaku – (wodorku azotu) azan.
Pozostałe
Do innych znanych wodorków niemetali można zaliczyć następujące związki:
związek wodoru z azotem na stopniu utlenienia: (amoniak);
związek wodoru z fosforem na stopniu utlenienia: ;
związek wodoru z krzemem: .
Nazwa wodorku | Wzór wodorku | Stopień utlenienia pierwiastka macierzystego |
|---|---|---|
wodorek litu | ||
wodorek sodu | ||
wodorek potasu | ||
wodorek rubidu | ||
wodorek wapnia | II | |
wodorek strontu | Indeks dolny 22 | II |
wodorek miedzi() | ||
wodorek chromu() | ||
wodorek skandu() | ||
metan | ||
benzen | ||
monosilan | ||
wodorek arsenu | ||
amoniak (azan) | ||
siarkowodór (sulfan) | ||
fluorowodór |
Ustal wzór sumaryczny wodorku wapnia.
Wapń występuje w drugiej grupie głównej układu okresowego pierwiastków. Jego stopień utlenienia zatem to . Analizując tę informacje w kontekście wzoru ogólnego wodorków metali:
Otrzymujemy wzór wodorku wapnia:
Ustal nazwę wodorku .
Dla wodorków niemetali moglibyśmy zastosować dwie alternatywne nazwy. Jedna, opisowa, polega na zastosowaniu słowa „wodorek”, a następnie określenie, czego (dopełniacz) ten wodorek jest. W tym wypadku byłby to wodorek krzemu. Drugi sposób to połączenie nazwy pierwiastka ze słowem „wodór” za pomocą litery „o”, zatem krzemowodór.
Otrzymywanie wodorków
Wodorki można otrzymać różnymi metodami:
bezpośrednia synteza w określonych warunkach (czasami w obecności katalizatora), np.:
wodorki niemetali, np.
wodorki metali, np.
inne wybrane przykłady, np.
— substraty są stopione;
(reakcja zachodzi w środowisku eteru).
Słownik
(łac. metallum gr. métallon „kopalnia”, „kruszec”) substancje odznaczające się dobrym przewodnictwem elektrycznym i cieplnym, charakterystycznym połyskiem, dużą wytrzymałością mechaniczną oraz plastycznością
substancje, które, w odróżnieniu od metali, są złymi przewodnikami ciepła i elektryczności; niemetale stanowią około wszystkich pierwiastków chemicznych. Do typowych niemetali należą: fluorowce, tlen, azot, siarka, fosfor oraz helowce
to ładunek jonu, w jaki przekształciłby się atom danego pierwiastka, gdyby wszystkie tworzone przez niego wiązania miały charakter jonowy
chemiczna substancja, która oddaje elektrony substancji redukowanej, sama zaś ulega utlenieniu. Stopień utlenienia reduktora po reakcji się zwiększa
Bibliografia
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia: Liceum – poziom podstawowy i rozszerzony, Warszawa–Bielsko‑Biała 2010.