Przeczytaj
Położenie w układzie okresowym a stopień utlenienia
Pierwiastki, w zależności od położenia w układzie okresowym pierwiastków, mogą przyjmować różne stopnie utlenieniastopnie utlenienia (zapisywane cyframi rzymskimi).
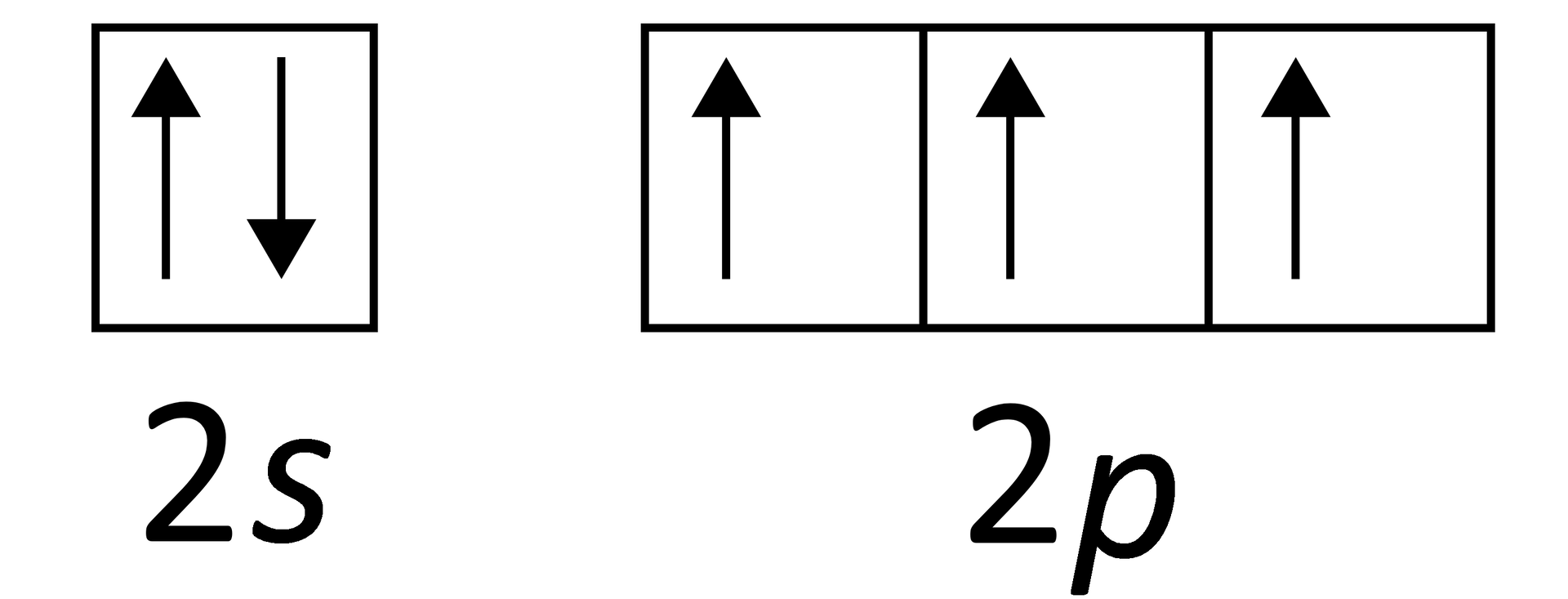
Atomy pierwiastków dążą do trwałej konfiguracji, co objawia się zazwyczaj przez uzyskanie oktetu lub dubletu elektronowego (poza gazami szlachetnymi, które mają ją wypełnioną całkowicie). Aby przewidzieć możliwe maksymalne oraz minimalne stopnie utlenienia pierwiastka, należy:
określić charakter pierwiastka w związkach – czy jest to metal, czy niemetal; metale przyjmują dodatnie stopnie utlenienia, w przypadku niemetali mogą one przyjmować dodatnie lub ujemne wartości stopnia utlenienia;
określić liczbę elektronów atomu danego pierwiastka oraz liczbę elektronów walencyjnych;
określić, w jaki sposób atom będzie dążył do trwałej konfiguracji, a więc do oktetu lub dubletu elektronowego; na tej podstawie można przewidzieć, jaką liczbę elektronów powinien przyjąć, oddać lub uwspólnić atom w czasie tworzenia związku chemicznego, tak aby osiągnąć wspomniany oktet lub dublet.
Reguły określania stopnia utlenienia
Aby przypisać stopień utlenienia pierwiastka chemicznego w związku lub w jonie, korzysta się z poniższych reguł.
Pierwiastki w stanie wolnym (bez względu na liczbę wiązań występujących między atomami pierwiastka w cząsteczce) występują na zerowym stopniu utlenienia.
Określ stopień utlenienia następujących indywiduów: , , , .
| Indywiduum | Stopień utlenienia |
|---|---|
Litowce w związkach chemicznych występują na +I stopniu utlenienia
Określ stopień utlenienia metalu w następujących indywiduach: , , , , .
| Indywiduum | Stopień utlenienia litowca |
|---|---|
Berylowce w związkach chemicznych występują na +II stopniu utlenienia
Określ stopień utlenienia metalu w następujących indywiduach: , , , .
| Indywiduum | Stopień utlenienia berylowca |
|---|---|
Fluor w związkach chemicznych występuje zawsze na -I stopniu utlenienia.
Określ stopień utlenienia fluoru w następujących indywiduach: , , .
| Indywiduum | Stopień utlenienia fluoru |
|---|---|
Wodór
W połączeniach z niemetalami występuje na +I stopniu utlenienia.
W wodorkach metali występuje na -I stopniu utlenienia.
Określ stopień utlenienia wodoru w następujących indywiduach: , , , .
| Indywiduum | Stopień utlenienia fluoru |
|---|---|
Tlen
W tlenkach, kwasach nieorganicznych i ich solach występuje na stopniu utlenienia: -II;
W nadtlenkach występuje na stopniu utlenienia:-I;
W ponadtlenkach występuje na stopniu utlenienia: -½;
We fluorku tlenu występuje na stopniu utlenienia: +I lub +II.
Określ stopień utlenienia tlenu w następujących indywiduach: , , , , , , .
| Indywiduum | Stopień utlenienia tlenu |
|---|---|
Stopień utlenienia pierwiastka w jonie prostym jest równy ładunkowi tego jonu.
Określ stopień utlenienia pierwiastków w następujących indywiduach: , , , .
| Indywiduum | Stopień utlenienia |
|---|---|
Suma stopni utlenienia wszystkich atomów w cząsteczce obojętnej równa jest zero, a w jonie złożonym równa jest jego ładunkowi.
Aby więc określić stopień utlenienia pierwiastka w związkach chemicznych lub jonach, należy kierować się powyższymi regułami, które w prosty sposób nam to ułatwią.
Słownik
liczba dodatnich lub ujemnych ładunków elementarnych, jakie można przypisać atomom pierwiastka danego związku chemicznego, gdyby wszystkie wiązania utworzone przez atom były jonowe
elektrony występujące na zewnętrznych powłokach elektronowych atomu, zajmujące orbitale o największej energii (dla danego pierwiastka); biorą udział w tworzeniu wiązań chemicznych i decydują o właściwościach pierwiastka
rozmieszczenie elektronów należących do atomów danego pierwiastka na poszczególnych powłokach oraz podpowłokach
zewnętrzna powłoka elektronowa w atomie pierwiastka
Bibliografia
Bielański A., Chemia ogólna i nieorganiczna. Warszawa 1981, s. 233‑234.
Encyklopedia PWN
Trzebiatowski W., Chemia nieorganiczna, Warszawa 1978, wyd. 8.