Przeczytaj
Chlor
Chlor jest drugim przedstawicielem grupy 17. układu okresowego pierwiastków – fluorowców. W warunkach ciśnienia atmosferycznego i temperatury pokojowej jest gazem o charakterystycznym żółto‑zielonym zabarwieniu i ostrym, duszącym zapachu. W naturze występuje głównie w postaci związanej, najczęściej w postaci soli kwasu solnego (chlorowodorowego) – chlorków. Jego odkrycie przypisuje się szwedzkiemu chemikowi, Carlowi Wilhelmowi Scheele, który to w 1774 r. otrzymał go w wyniku reakcji kwasu solnego (chlorowodorowego) z tlenkiem manganu(IV).
Nazwę nowemu pierwiastkowi nadał 36 lat później Sir Humphry Davy. Nazwa chlor pochodzi od greckiego słowa chilambdaomegarhoomicronς (chlōros), oznaczającego „żółtozielony”.

Konfiguracja elektronowa w formie podpowłokowej skróconej (zaw. rdzeń gazu szlachetnego) dla atomu chloru przyjmuje postać:
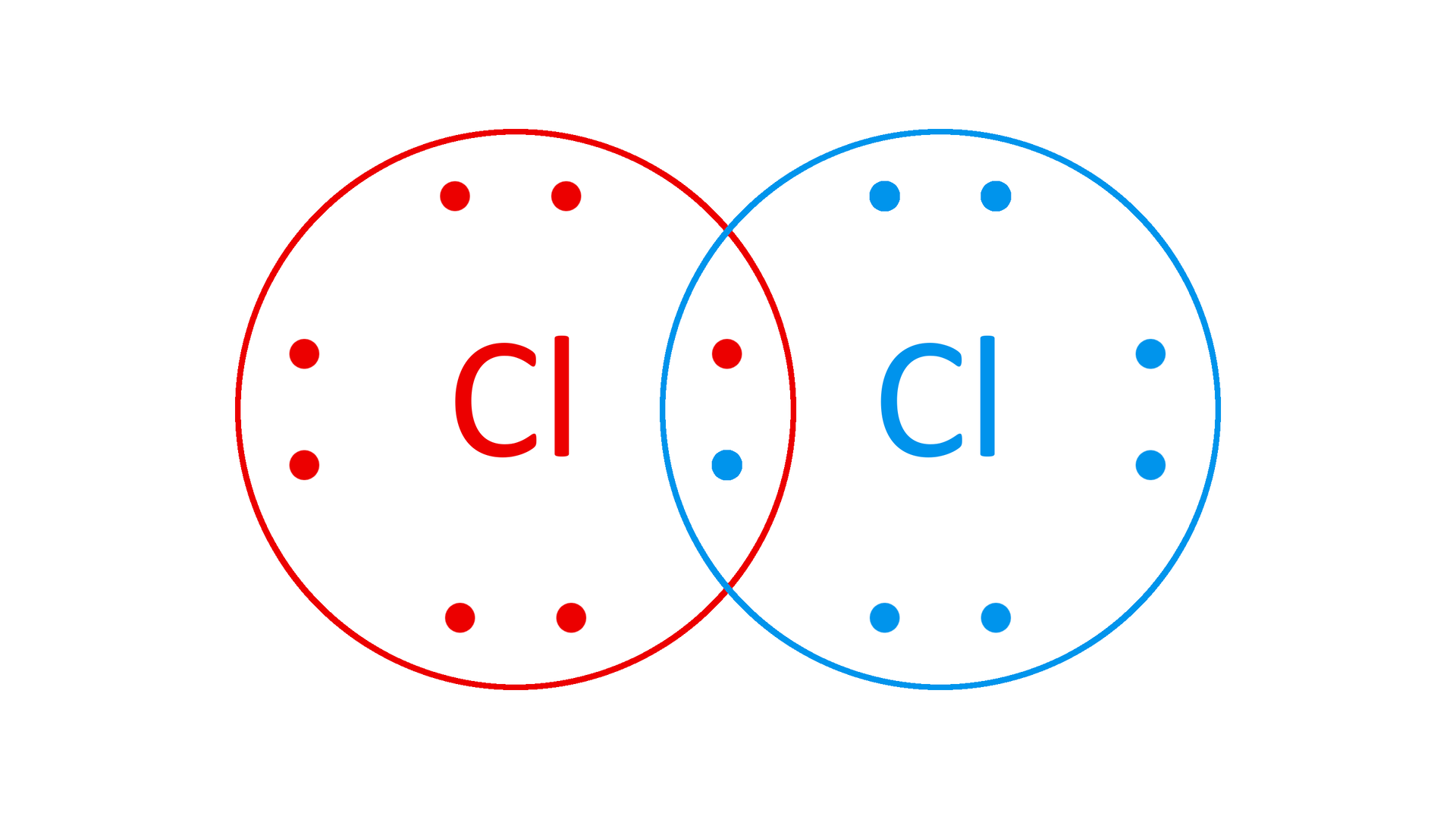
Na powłoce walencyjnej chloru znajduje się siedem elektronów walencyjnych. Do całkowitego wypełnienia podpowłoki 3pIndeks górny 55 i osiągnięcia korzystnej energetycznie konfiguracji elektronowej brakuje jednego elektronu. Tłumaczy to występowanie chloru, podobnie jak pozostałych przedstawicieli tej grupy w stanie wolnym w postaci dwuatomowych cząsteczek . Dwa atomy chloru uwspólniają jedną parę elektronową, tworząc wiązanie atomowe (kowalencyjne).
Silne właściwości utleniające chlor znalazły szereg zastosowań w życiu codziennym. Jest rozpuszczalny w wodzie, z którą wchodzi w reakcję, zapisaną przy pomocy poniższego równania:
Powyższa reakcja jest reakcją równowagową, dlatego chlor pozostaje w równowadze z produktami reakcji dysproporcjonowaniadysproporcjonowania – kwasem chlorowym(I) i kwasem solnym (chlorowodorowym). Zakwaszenie środowiska reakcji przesuwa równowagę w lewo – czyli do wypierania chloru z roztworu.
Zastosowanie chloru
Pierwsze wzmianki o wykorzystaniu roztworu chloru w wodzie pochodzą z XIX w., kiedy to wykorzystano ten roztwór do produkcji strun w instrumentach muzycznych. W tamtym czasie wykonywano je z katgutukatgutu, produkowanego ze zwierzęcych jelit. Jako materiał biologiczny, jelita ulegały procesom gnilnym, co towarzyszyło wydzielaniu się nieprzyjemnych zapachów. Gdy do produkcji wykorzystano wodny roztwór chloru, zauważono, że nieprzyjemny zapach znika, a materiał rozkłada się wolniej. Po czasie zaczęto wykorzystywać powyższy roztwór do dezynfekcji w szpitalach i lazaretach. Na początku lat 30. XIX w. wodny roztwór chloru zalecano do odkażania ran, jak i również do mycia rąk w szpitalach przez lekarzy. Medycyna w tamtym czasie znała już różnego rodzaju zakażenia, ale dopiero pół wieku później poznano działanie drobnoustrojów.
Właściwości utleniające chloru
Brak znajomości zasad higieny oraz niedostatecznie rozwinięta medycyna były skutkiem wybuchu wielu epidemii, m.in. cholery. Poznanie i zastosowanie właściwości wodnego roztworu chloru znacznie przyczyniło się do zwalczania epidemii. W drugiej połowie XIX w. rozpoczęto wprowadzanie chloru do wody wodociągowej, celem jej uzdatniania. Obecnie również korzysta się z tej techniki np. w przypadku sieci wodociągowej czy w basenach. Dlaczego tak się dzieje?
Chlor ma silne właściwości utleniające, dlatego może reagować z wieloma indywiduami chemicznymi – w tym również z materią organiczną, zawartą w zanieczyszczeniach. Niszczy różnego rodzaju bakterie oraz drobnoustroje (np. bakterie z grupy E. coli). W procesie oczyszczania wody, ważnym elementem jest odpowiedni moment uzdatniania. Trzeba jednak wówczas uważać, aby chlor został wprowadzony dopiero w końcowej fazie tego procesu. W przeciwnym wypadku, ze względu na jego wysoką reaktywność, dzięki zachodzącej reakcji ze związkami organicznymi, zawartymi w nieoczyszczonej wodzie, tworzy toksyczny dla ludzi i środowiska chloroform (trichlorometan).
Słownik
elektrony, które są odpowiedzialne za tworzenie wiązań chemicznych, znajdują się na najbardziej zewnętrznych powłokach elektronowych
cienka nić wykonana z jelita zwierzęcego lub wytworzona sztucznie
reakcja, w której jeden związek pełni funkcję utleniacza i reduktora
Bibliografia
Atkins P., Jones L., Laverman L., Chemical Principles, 7th Edition, New York 2016.
Bielański A., Podstawy chemii nieorganicznej, t. 2, Warszawa 2012.
Encyklopedia PWN
Greenwood N. N., Earnshaw A., Chemistry of the Elements, 2nd Edition, Oksford 1997.

