Przeczytaj
Wzór ogólny kwasów nieorganicznych
Kwasy nieorganiczne możemy podzielić na kwasy beztlenowe i tlenowe, a ich wzór ogólny przedstawia się następująco:

Wzór ogólny kwasów karboksylowych
Kwasy karboksylowe to związki organiczne. Ze względu na liczbę atomów węgla w cząsteczce można wyróżnić kwasy karboksylowe i wyższe kwasy karboksylowe, tzw. kwasy tłuszczowe. Wzór ogólny kwasów karboksylowych:

Dysocjacja elektrolityczna
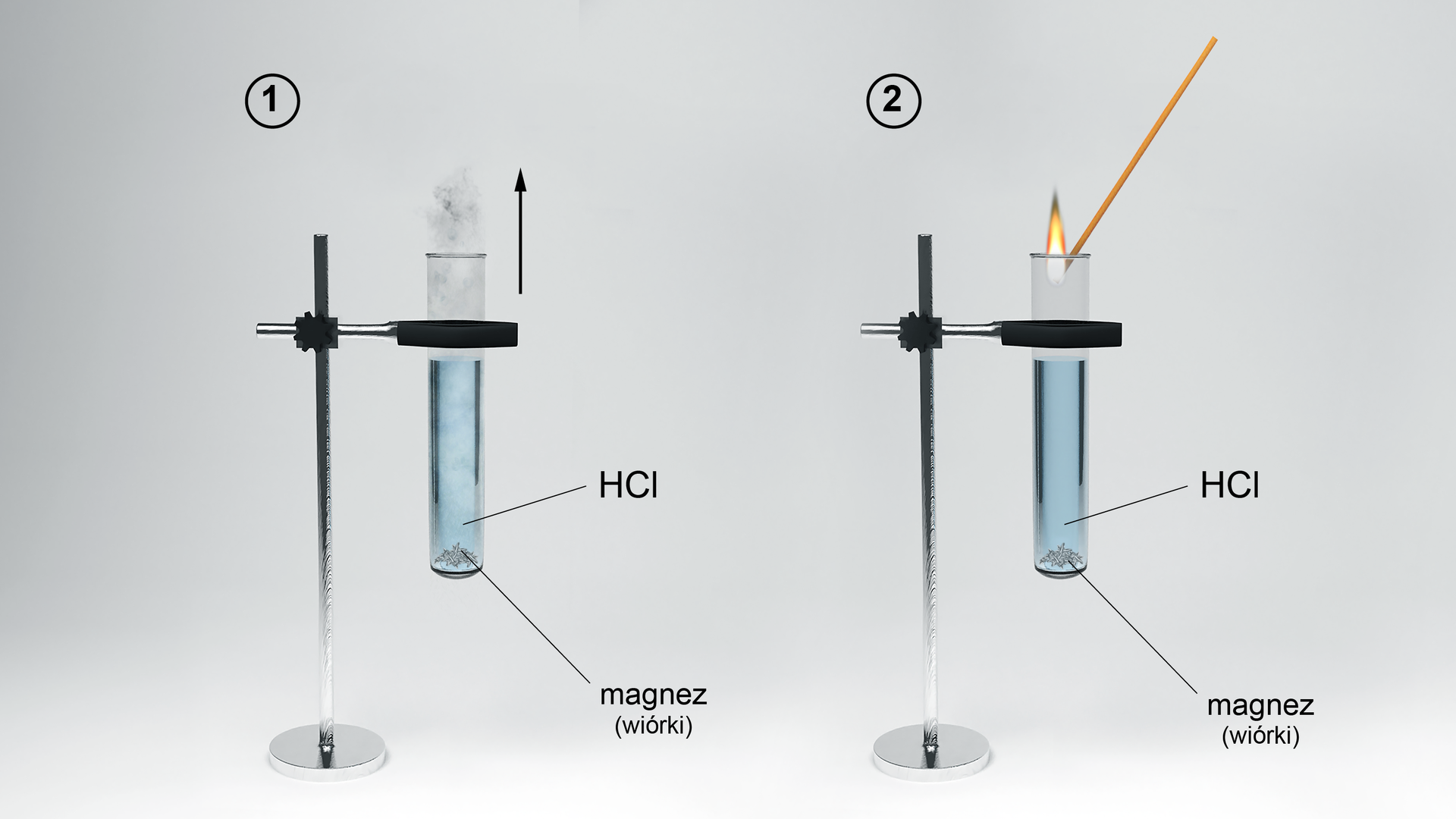
Doświadczenie nr 1
Przeanalizuj doświadczenie nr 1 i zastanów się, jakie mogą być obserwacje i wnioski.
Reakcje:
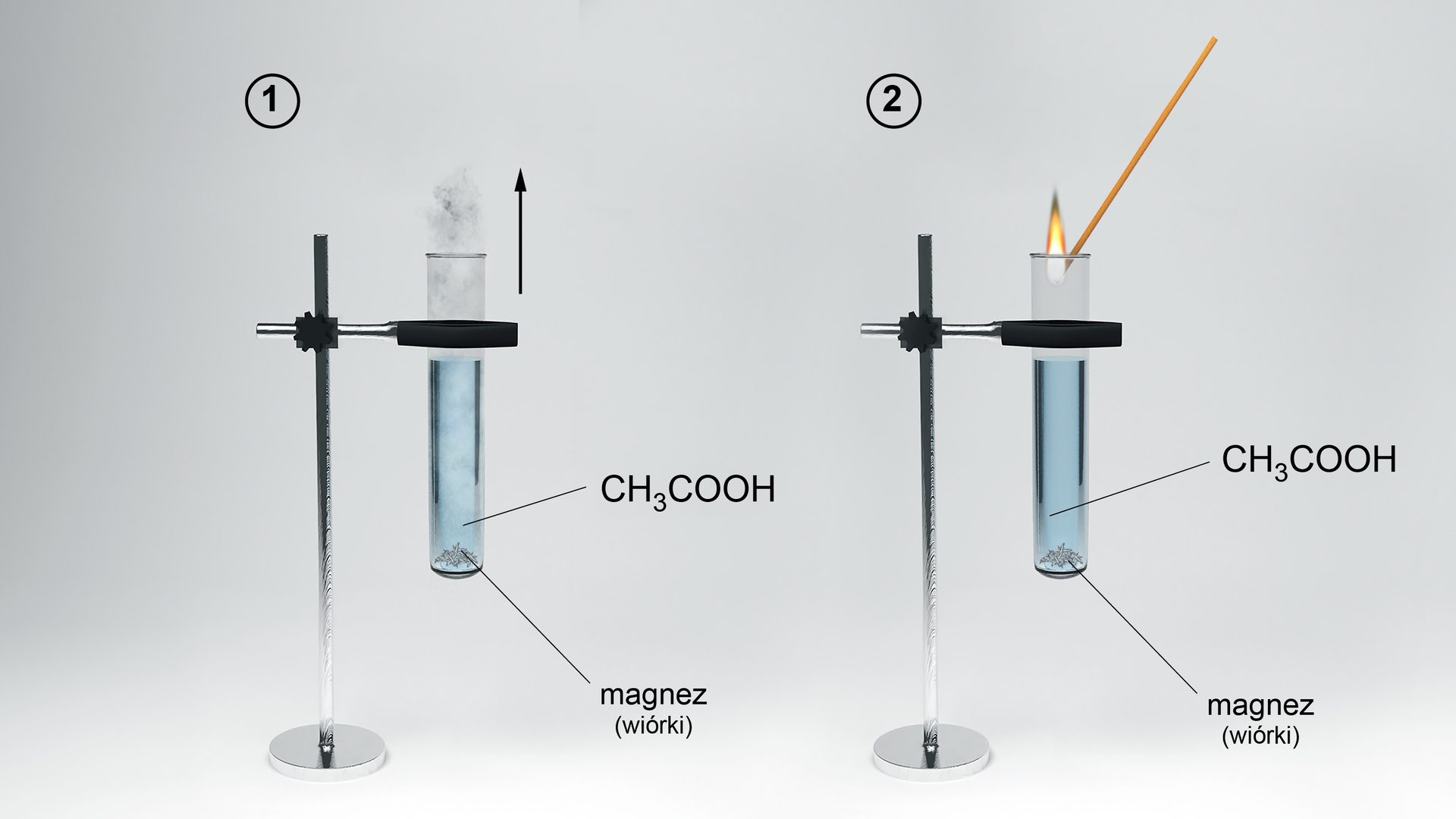
Doświadczenie nr 2
Przeanalizuj doświadczenie nr 2 i zastanów się, jakie mogą być obserwacje i wnioski.
Kwasy nieorganiczne dzielimy na mocne i słabe elektrolity. Równania dysocjacji elektrolitycznejdysocjacji elektrolitycznej kwasów nieorganicznych jednoprotonowych:
Z kolei kwasy nieorganiczne wieloprotonowewieloprotonowe ulegają dysocjacji stopniowej,dysocjacji stopniowej, co ukazują poniższe równania dysocjacji:
Kwasy karboksylowe to słabe elektrolity. Równania dysocjacji elektrolitycznej wybranych kwasów monokarboksylowychkwasów monokarboksylowych:
Kwasy polikarboksyloweKwasy polikarboksylowe ulegają dysocjacji stopniowej. Równanie dysocjacji elektrolitycznej kwasu szczawiowego (etanodiowego):
Należy podkreślić, że nie wszystkie kwasy karboksylowe rozpuszczają się w wodzie i ulegają dysocjacji elektrolitycznej. Takim przykładem są kwasy tłuszczowe.
Reakcja z metalami
Doświadczenie nr 3
Przeanalizuj doświadczenie nr 3 i zastanów się, jakie mogą być obserwacje i wnioski.
Równanie reakcji możemy opisać w sposób ogólny:
Kwasy nieorganiczne energicznie reagują z aktywnymi metalami, a w wyniku reakcji powstaje wodór.
zapis cząsteczkowy:
zapis jonowy skrócony:
Kwasy karboksylowe, które są rozpuszczalne w wodzie, reagują z aktywnymi metalami, w wyniku czego powstaje wodór.
zapis cząsteczkowy:
zapis jonowy skrócony:
Reakcja z tlenkami metali
Doświadczenie nr 4
Przeanalizuj doświadczenie nr 4 i zastanów się, jakie mogą być obserwacje i wnioski.

Równanie reakcji możemy opisać w sposób ogólny:
Kwasy nieorganiczne reagują z tlenkami metali. W reakcji kwasu chlorowodorowego (kwasu solnego) z tlenkiem żelaza(III) powstaje chlorek żelaza(III) i woda.
zapis cząsteczkowy:
zapis jonowy skrócony:
Kwasy karboksylowe, które są rozpuszczalne w wodzie, reagują z tlenkami metali. W reakcji kwasu octowego (etanowego) z tlenkiem żelaza(III) powstaje octan (etanian) żelaza(III) i woda.
zapis cząsteczkowy:
Reakcja z wodorotlenkami metali
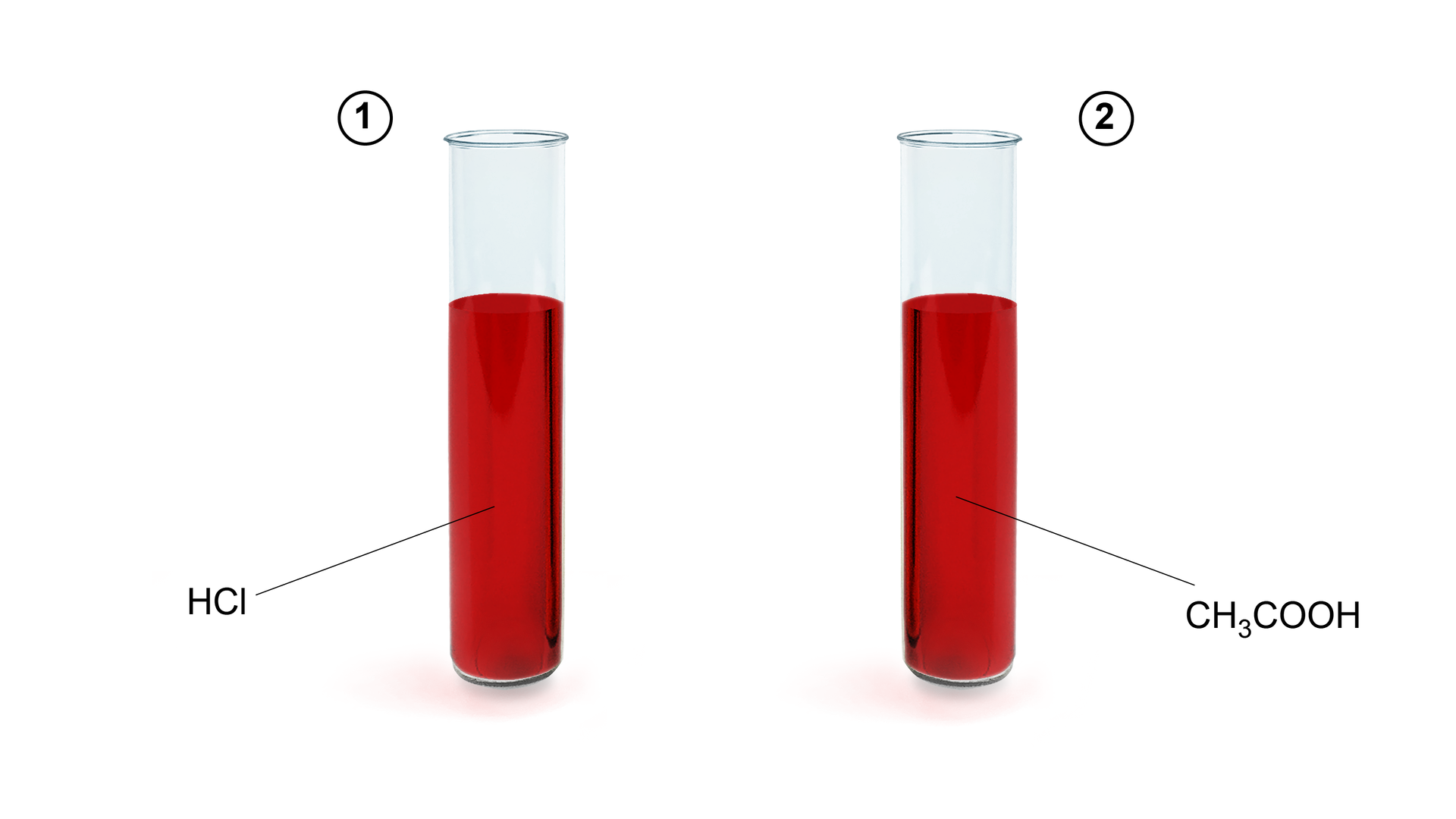
Doświadczenie nr 5
Przeanalizuj doświadczenie nr 5 i zastanów się, jakie mogą być obserwacje i wnioski.
Równanie reakcji możemy opisać w sposób ogólny:
W reakcji kwasu chlorowodorowego (kwasu solnego) z wodorotlenkiem sodu powstaje chlorek sodu i woda.
zapis cząsteczkowy:
zapis jonowy skrócony:
W reakcji kwasu octowego (etanowego) z wodorotlenkiem sodu powstaje octan (etanian) sodu i woda.
zapis cząsteczkowy:
zapis jonowy skrócony:
Reakcja z solami słabszych kwasów
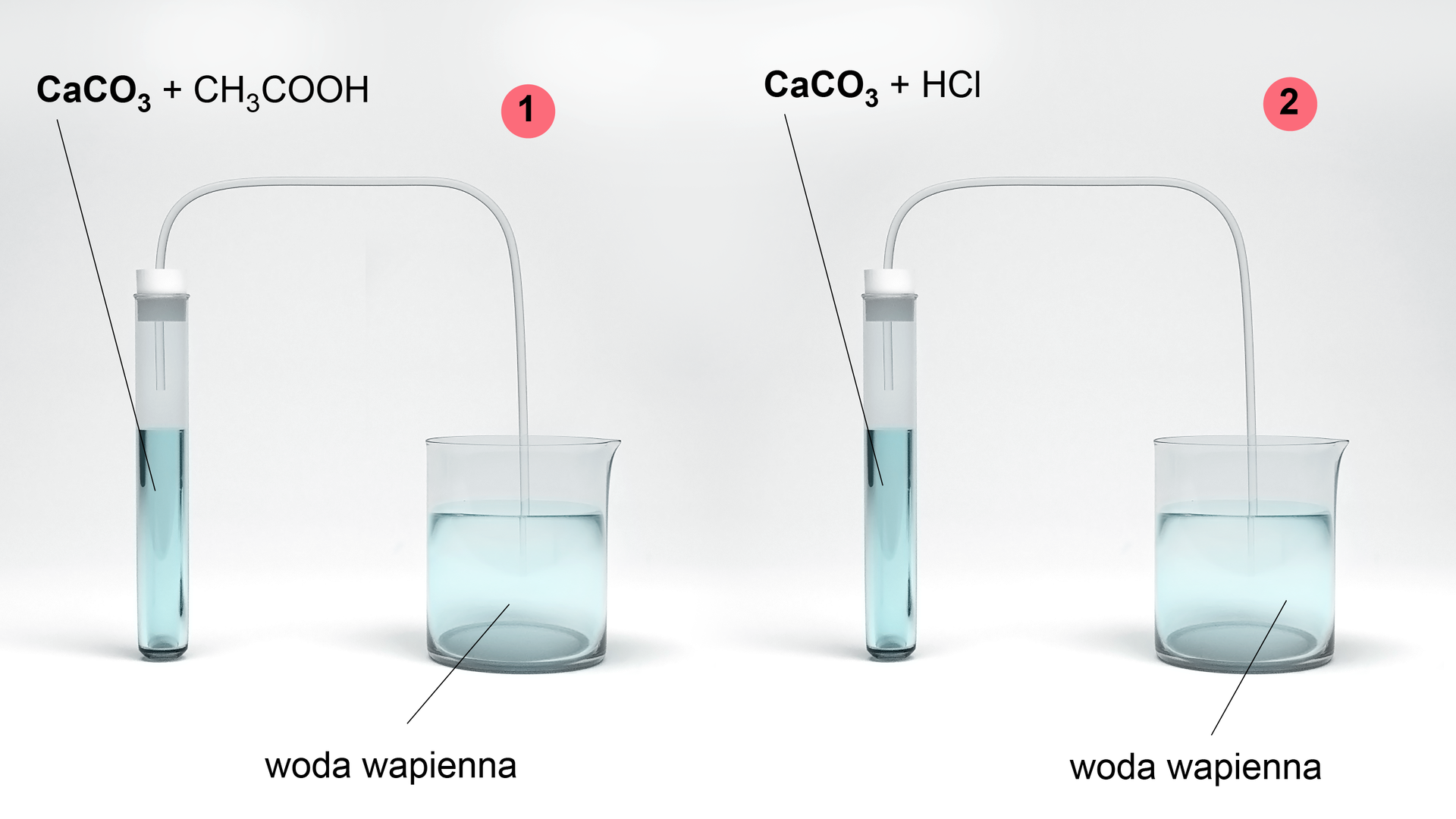
Doświadczenie nr 6
Przeanalizuj doświadczenie nr 6 i zastanów się, jakie mogą być obserwacje i wnioski.
Równanie reakcji możemy opisać w sposób ogólny:
W reakcji kwasu chlorowodorowego (kwasu solnego) z węglanem wapnia powstaje chlorek wapnia, tlenek węgla(IV) i woda.
zapis cząsteczkowy:
zapis jonowy skrócony:
W reakcji kwasu octowego (etanowego) z węglanem wapnia powstaje octan (etanian) wapnia, tlenek węgla(IV) i woda.
zapis cząsteczkowy:
zapis jonowy skrócony:
Mętnienie wody wapiennejwody wapiennej świadczy o powstaniu węglanu wapnia.
Podsumowanie
słaby elektrolitsłaby elektrolitWśród kwasów nieorganicznych wyróżniamy mocnemocne i słabesłabe elektrolityelektrolity. Jeśli mowa o kwasach karboksylowych, to są one słabymi elektrolitami.
Kwasy nieorganiczne i niektóre kwasy karboksylowe ulegają dysocjacji elektrolitycznej.
Podobne reakcje niektórych kwasów karboksylowych i kwasów nieorganicznych:
reakcja z metalami;
reakcja z tlenkami metali;
reakcja z wodorotlenkami;
reakcja z solami słabszych kwasów niż kwasy karboksylowe.
Słownik
rozpad substancji na jony pod wpływem rozpuszczalnika (najczęściej wody)
dysocjacja zachodząca na więcej niż jednym etapie. Na każdym etapie wydajność dysocjacji jest inna. Wydajność kolejnych dysocjacji jest coraz mniejsza. Przykładem substancji dysocjującej stopniowo jest kwas ortofosforowy(V) –
kwas posiadający jeden atom wodoru, który jest zdolny do „oderwania się” od cząsteczki substancji podczas dysocjacji elektrolitycznej
kwas, który zawiera więcej niż jeden atom wodoru. Atomy wodoru są zdolne do „oderwania się” od cząsteczki substancji podczas dysocjacji elektrolitycznej. Kwasy wieloprotonowe dysocjują stopniowo
kwas organiczny zawierający jedną grupę karboksylową (kwas polikarboksylowy)
kwas organiczny zawierający więcej niż jedną grupę karboksylową
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) substancja, która ulega dysocjacji elektrolitycznej; jest zdolna do przewodzenia prądu elektrycznego
substancja, która ulega całkowitej lub prawie całkowitej dysocjacji elektrolitycznej; do mocnych elektrolitów zaliczamy: większość soli, zasady, niektóre kwasy nieorganiczne np.: , , ,
substancja, która w małym stopniu dysocjuje, jak np. kwas octowy
klarowny, nasycony, wodny roztwór wodorotlenku wapnia
Bibliografia
Bobrański B., Chemia organiczna, Warszawa 1992.
Buczek I., Chrzanowski M, Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska- Kazimierczuk M., Kuśmierczyk K., Chemia 1. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2002.
Czerwiński A., Czerwińska A., Jelińska- Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2003.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Lautenschläger K. H., Schröter W., Wanninger A., Nowoczesne kompendium chemii, Warszawa 2007.
Litwin M., Styka – Wlazło Sz., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
McMurry J., Chemia organiczna 4, Warszawa 2004.
McMurry J., Chemia organiczna 3, Warszawa 2003.
Pazdro K. M., Rola – Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2017.