Przeczytaj
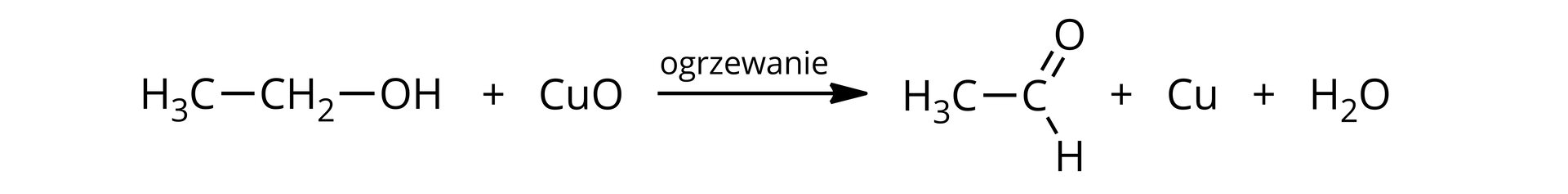
Reakcja utleniania alkoholi pierwszorzędowych
Zapoznaj się z poniższym doświadczeniem. Przeanalizuj instrukcję oraz schemat doświadczenia, a następnie zapisz obserwacje oraz wnioski. Jeśli masz taką możliwość, przeprowadź doświadczenie w laboratorium chemicznym.
Zachowaj środki ostrożności przy wykonywaniu tego doświadczenia, ponieważ w wyniku tej reakcji powstaje produkt, który jest toksyczny. Powoduje on podrażnienie błon śluzowych i łzawienie oczu.
Problem badawczy: Jak z metanolu otrzymać metanal?
Hipoteza: Po ogrzaniu w płomieniu palnika pojawi się czarny nalot na drucie miedzianym, który zanika po zanurzeniu w roztworze metanolu.
Sprzęt i odczynniki laboratoryjne:
probówka;
drut miedziany;
palnik;
szczypce metalowe;
roztwór metanolu;
stojak na probówki;
cylinder miarowy.
Instrukcja wykonania doświadczenia:
Do probówki wlej około 2 roztworu metanolu.
W płomieniu palnika rozgrzej drut miedziany do czerwoności, po czym ostudź go.
Ponownie ogrzej drut miedziany, a następnie wprowadź do probówki, zanurzając w roztworze alkoholu.
Powtórz kilka razy czynność z punktu nr 3.
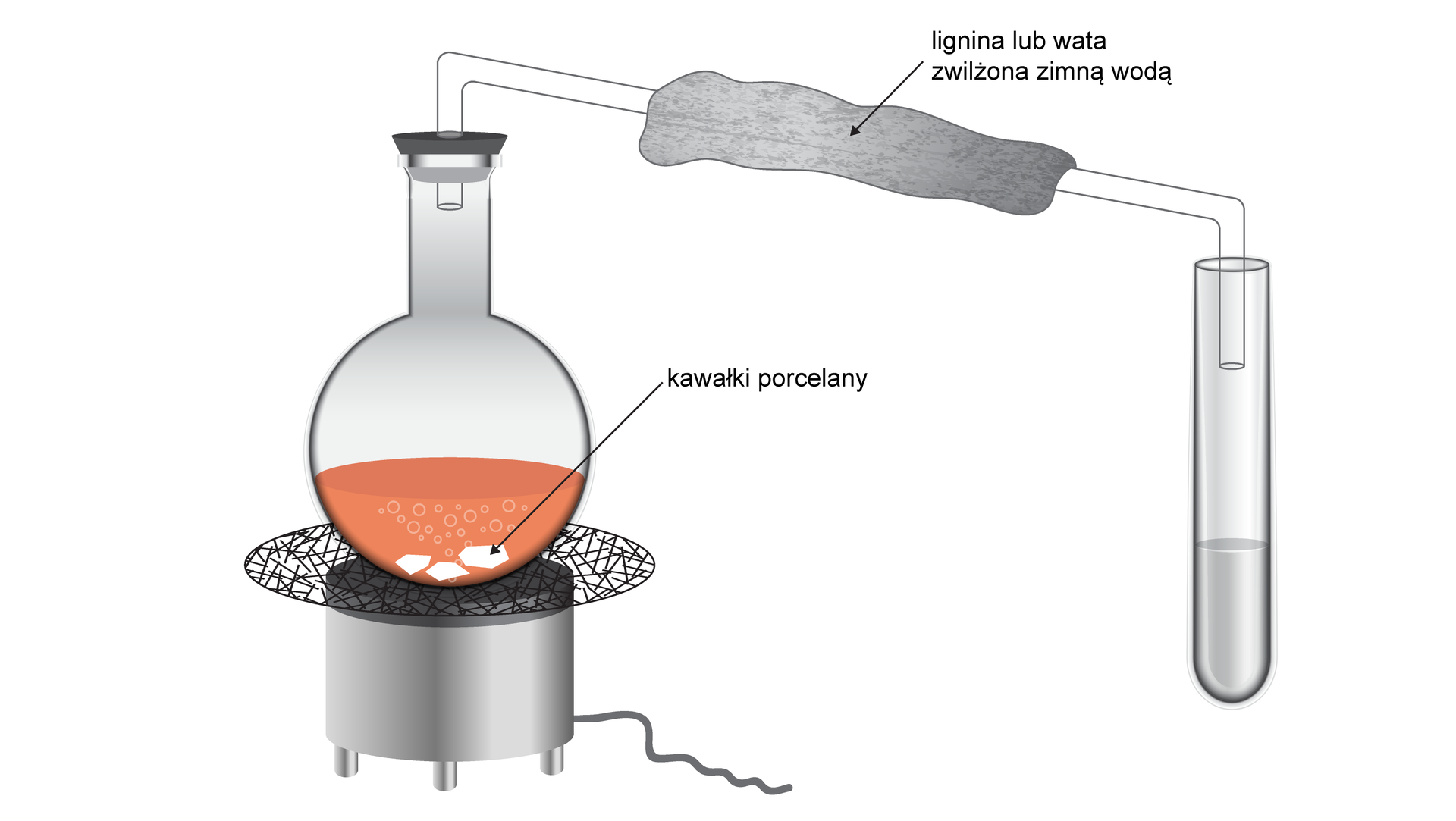
Schemat doświadczenia:
Wnioski:
Przykładowa odpowiedź:
Obserwacje
Po ogrzaniu w płomieniu palnika, drut miedziany pokrywa się czarnym nalotem. Po zanurzeniu w roztworze metanolu czarny nalot zanika, a drut przyjmuje wcześniejszą barwę. Z probówki wydobywa się wyczuwalny, charakterystyczny i drażniący zapach.
Wnioski
Pojawienie się czarnego nalotu na drucie świadczy o powstaniu tlenku miedzi(II), czyli produktu utleniania miedzi. Zanik czarnego nalotu po zanurzeniu w roztworze metanolu świadczy o reakcji utleniania metanolu do metanalu, a tym samym reakcji redukcji atomów miedzi w tlenku miedzi(II) do metalicznej miedzi. Wyczuwalny drażniący zapach wydobywający się z probówki potwierdza powstanie metanalu.
Reakcja utlenianiaReakcja utleniania alkoholi pierwszorzędowychalkoholi pierwszorzędowych, w obecności łagodnych utleniaczyutleniaczy (np.: ), prowadzi do otrzymania aldehydów.
![Na ilustracji znajduje się ogólny wzór alkoholu I rzędowego, w którym do atomu węgla przyłączone są dwa atomy wodoru, R i grupa hydroksylowa, poniżej podpis: alkohol I-rzędowy. Strzałka w prawo, zapis: [O] ogrzewanie, minus cząsteczka wody. Powstaje aldehyd RCHO w którym do atomu węgla przyłączona jest grupa R, atom wodoru poprzez wiązania pojedyncze oraz atom tlenu poprzez wiązanie podwójne.](https://static.zpe.gov.pl/portal/f/res-minimized/R1TA1JwC0Niz3/1624483143/1Gom81z11loaVNgyrp58GKZpBHpUyHl8.png)
Zapisz równanie reakcji utleniania etanolu przy użyciu tlenku miedzi(II). Jaka jest nazwa systematyczna głównego produktu?

Usuwanie etanolu z organizmu człowieka to długotrwały proces. W wątrobie jest wytwarzany enzym (dehydrogenaza alkoholowa), który katalizuje reakcję utleniania etanolu do acetaldehydu (aldehydu octowego). Acetaldehyd jest substancją 10‑krotnie bardziej toksyczną dla organizmu niż etanol; powoduje m.in. bóle głowy, rozszerzenie naczyń krwionośnych, nudności oraz wymioty. Jest utleniany do kwasu octowego (etanowego) również dzięki dehydrogenazie alkoholowej. Z kolei kwas octowy jest utleniany do tlenku węgla(IV) oraz wody. W ciągu godziny wątroba zdrowego mężczyzny jest zdolna utlenić nawet 10 g etanolu. Spożycie ok. 450 g czystego etanolu (czyli ponad cztery promile alkoholu we krwi) jest uznawane jako dawka śmiertelna dla zdrowego dorosłego człowieka.
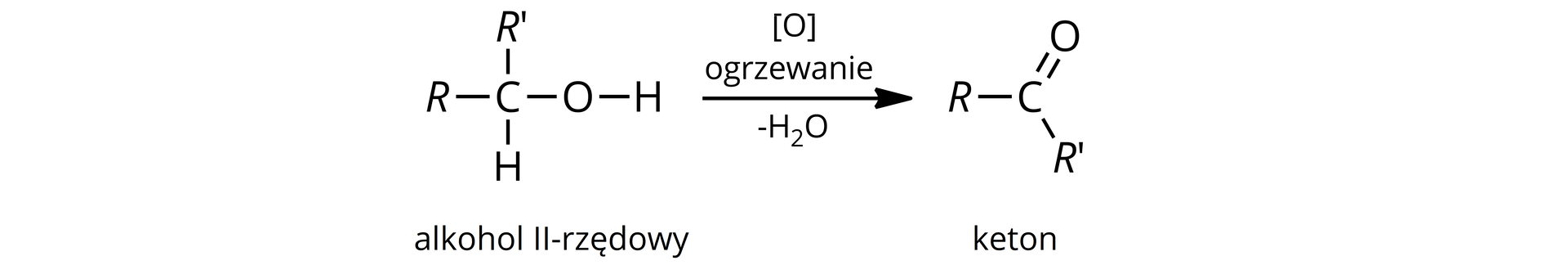
Reakcja utleniania alkoholi drugorzędowych
Reakcja utleniania alkoholi drugorzędowychalkoholi drugorzędowych, w obecności utleniaczy, prowadzi do otrzymania ketonów.
Czynnikiem utleniającym może być:
tlenek miedzi(II) – ;
dichromian(VI) potasu - w środowisku kwasu siarkowego(VI) – .

Zapisz równanie reakcji utleniania butan‑2-olu przy użyciu tlenku miedzi(II). Podaj nazwę systematyczną powstałego produktu reakcji.
Nazwa systematyczna produktu:
Poniżej przedstawiono doświadczenie, mające na celu utlenienie propan‑2-olu przy użyciu dichromianu(VI) potasu w środowisku kwasowym. Uzupełnij brakujące pola w dzienniku laboratoryjnym: obserwacje oraz wnioski.
Czy propan-2-ol ulega reakcji utleniania przy wykorzystaniu dichromianu(VI) potasu w środowisku kwasowym?
Mieszanina reakcyjna w kolbie zmieni zabarwienie z pomarańczowej na ciemnozieloną oraz wyczuwalny będzie charakterystyczny zapach.
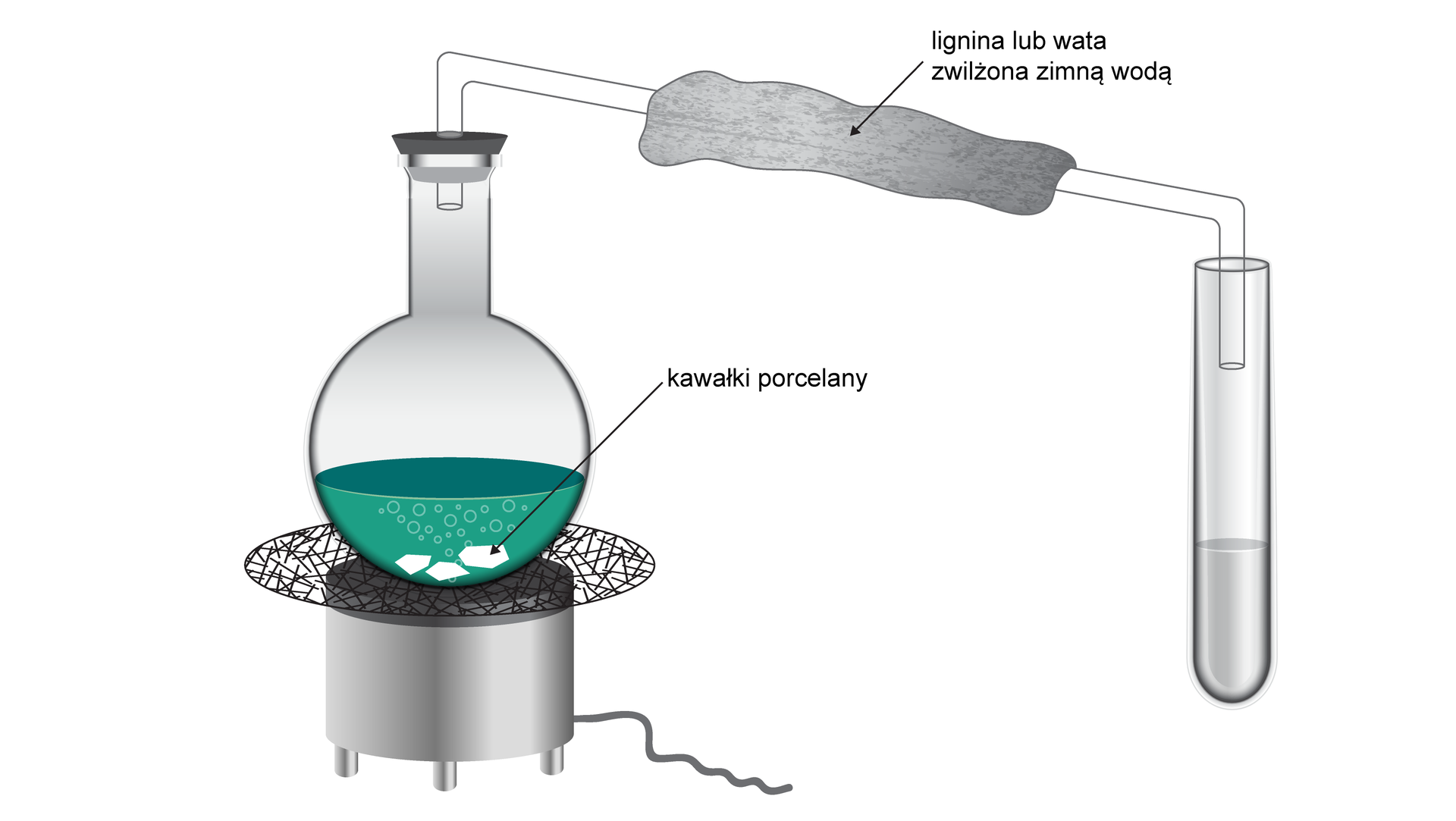
Schemat doświadczenia:
- probówka;
- kolba okrągłodenna (o pojemności 100 cm3) z korkiem i rurką szklaną;
- płaszcz grzewczy;
- kawałki porcelany;
- roztwór propan-2-olu;
- stały dichromian(VI) potasu;
- woda destylowana;
- stężony kwas siarkowy(VI);
- wata;
- stojak na probówki;
- cylinder miarowy;
- pręcik szklany;
- waga;
- zlewka;
- pipeta.
- Do kolby wprowadź około 2 cm3 alkoholu, 4 cm3 wody oraz kawałki porcelany.
- Przygotuj mieszaninę utleniającą w zlewce – w tym celu odważ 4 g dichromianu(VI) potasu, a następnie rozpuść go w ok. 20 cm3 wody.
- Powoli dodaj 16 cm3 stężonego kwasu siarkowego(VI), cały czas mieszając.
- Do kolby z roztworem alkoholu wprowadź mieszaninę utleniającą. Kolbę zatkaj korkiem, z wprowadzoną do niego rurką szklaną. Drugi koniec rurki wprowadź do probówki.
- Zawartość kolby łagodnie ogrzewaj do wrzenia.
- Rurkę szklaną, która ma służyć jako chłodnica, owiń watą zwilżoną zimną wodą.
- Zbierz około 1-2 cm3 destylatu w probówce. Po zebraniu, przerwij reakcję.
Przykładowa odpowiedź:
Obserwacje
Podczas ogrzewania kolby, w probówce pojawia się bezbarwna ciecz o charakterystycznym zapachu. Mieszanina w kolbie zmienia zabarwienie z pomarańczowego na ciemnozielone.
Wnioski
Zmiana zabarwienia mieszaniny reakcyjnej z pomarańczowej na ciemnozieloną świadczy o redukcji jonów dichromianowych(VI) do jonów chromu(III). Wyczuwalny, charakterystyczny zapach, wydobywający się z probówki, potwierdza powstanie propanonu (tzw. acetonu), czyli produktu utlenienia propan‑2-olu.

Trufle wytwarzają androsterol, który jest alkoholem drugorzędowym.

Androsterol może ulec reakcji utleniania do androstenonu, co przedstawia poniższy schemat:
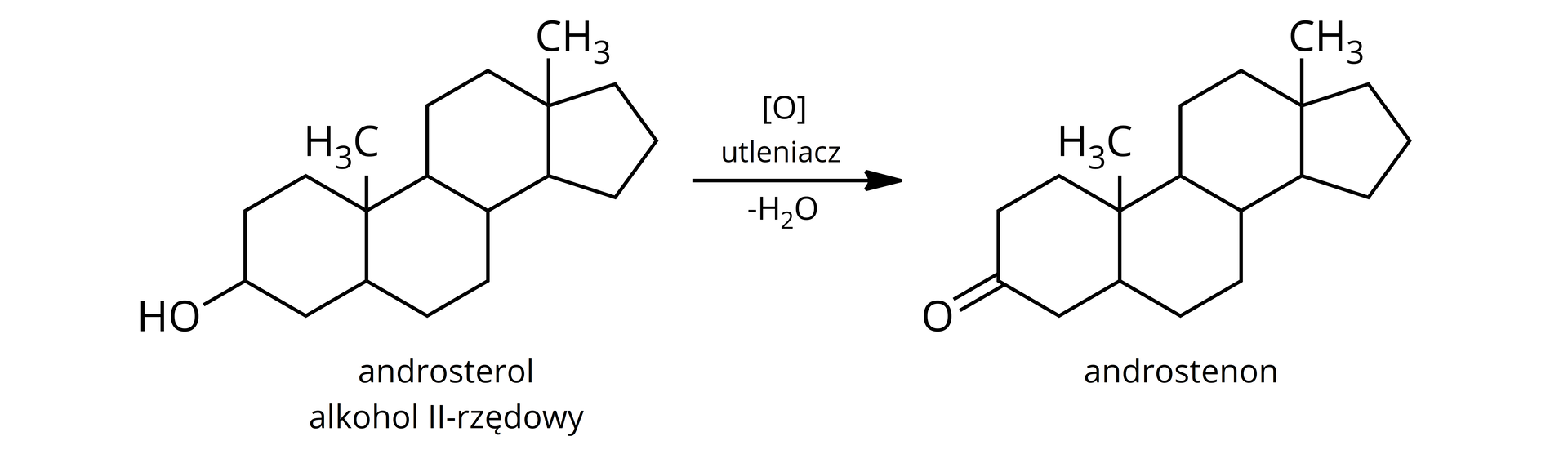
Zarówno androsterol, jak i androstenon pełnią ważne funkcje biologiczne, ponieważ są feromonami płciowymi dzików i świń domowych. To właśnie dzięki temu dzik jest w stanie wyczuć trufle, nawet, jeśli znajdują się one głęboko pod ziemią.
Reakcja utleniania alkoholi trzeciorzędowych
Alkohole trzeciorzędoweAlkohole trzeciorzędowe nie ulegają reakcji utleniania, ponieważ w ich cząsteczkach atom węgla, przyłączony do grupy hydroksylowej, nie posiada atomów wodoru.

Podsumowanie
Reakcja utleniania alkoholi I‑rzędowych, pod wpływem łagodnych utleniaczy (np.: tlenku miedzi(II) – ), prowadzi do otrzymania aldehydów.
Reakcja utleniania alkoholi II‑rzędowych, pod wpływem utleniaczy (np.: tlenek miedzi(II) lub dichromian(VI) potasu w środowisku kwasowym), prowadzi do otrzymania ketonów.
Alkohole III‑rzędowe nie ulegają reakcji utleniania pod wpływem słabego utleniacza.
Słownik
(arab. al – kuhl „coś delikatnego”) alkohol, w którego cząsteczce grupa funkcyjna – grupa hydroksylowa jest przyłączona do pierwszorzędowego atomu węgla; przykładem alkoholu pierwszorzędowego jest propan‑1-ol
(arab. al – kuhl „coś delikatnego”) alkohol, w którego cząsteczce grupa funkcyjna – grupa hydroksylowa jest przyłączona do drugorzędowego atomu węgla; przykładem alkoholu drugorzędowego jest propan‑2-ol
(arab. al – kuhl „coś delikatnego”) alkohol, w którego cząsteczce grupa funkcyjna – grupa hydroksylowa jest przyłączona do trzeciorzędowego atomu węgla; przykładem alkoholu jest 2‑metylopropan‑2-ol
(łac. destillatio „kapanie”) czysta substancja, która jest pozyskiwana w wyniku destylacji, czyli metody polegającej na rozdzieleniu ciekłej mieszaniny różnych substancji; destylat jest zbierany w odbieralniku
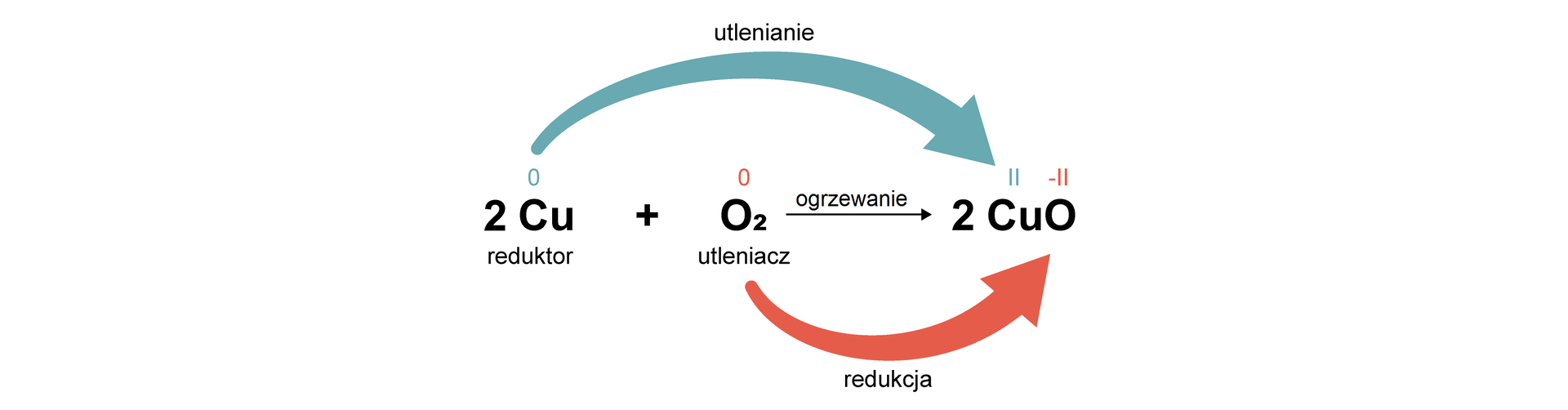
(utlenianie, oksydacja; fr. oxygéne dosłownie „kwasoród”, „tlen”) reakcja polegająca na oddawaniu elektronów przez atomy lub jony pierwiastka, skutkiem czego jest podwyższenie ich stopnia utlenienia
(redukcja; łac. reductio „cofnięcie”, „odzyskanie”) reakcja polegająca na przyjmowaniu elektronów przez atomy lub jony pierwiastka, skutkiem czego jest obniżenie ich stopnia utlenienia
(łac. reductio „cofnięcie”, „odzyskanie”) substancja posiadająca właściwości redukujące; substancja ta redukuje inną substancję, sama utleniając się; reduktor oddaje elektrony, przez co podwyższa swój stopień utlenienia
(fr. oxygéne dosłownie „kwasoród”, „tlen”) substancja, która utlenia inną substancję, sama redukując się; utleniacz przyjmuje elektrony, przez co obniża swój stopień utlenienia
liczba ładunku elementarnego, jaki posiadałby atom, gdyby w danej substancji wszystkie wiązania były jonowe
Bibliografia
Buczek I., Chrzanowski M., Dymara J., Persona A., Kowalik E., Kuśmierczyk K., Odrowąż E., Sobczak M., Sygniewicz J., Chemia. Rozszerzenie. Repetytorium matura, Warszawa 2014.
Czerwiński A., Czerwińska A., Jelińska- Kazimierczuk M., Kuśmierczyk K., Chemia 2. Podręcznik dla Liceum ogólnokształcącego, liceum profilowanego, technikum, Warszawa 2003.
Danikiewicz W., Chemia. Związki organiczne. Podręcznik do liceów i techników. Zakres rozszerzony, Warszawa 2016.
Hassa R., Mrzigod A., Mrzigod J., To jest chemia. Podręcznik dla szkół ponadgimnazjalnych. Zakres podstawowy, Warszawa 2016.
Kopaliński W., Słownik wyrazów obcych i zwrotów obcojęzycznych, Warszawa 1983.
Litwin M., Styka – Wlazło S., Szymońska J., To jest chemia 2. Chemia organiczna. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony, Warszawa 2016.
Majewski W., Mechanizmy reakcji chemicznych, Lublin 2012.
McMurry J., Chemia organiczna 4, Warszawa 2004.
Pazdro K. M., Rola – Noworyta A., Chemia. Repetytorium dla przyszłych maturzystów i studentów, Warszawa 2017.