Przeczytaj
Co rozumiesz pod pojęciem reakcja zobojętniania?
Reakcja zobojętnianiaReakcja zobojętniania jest najczęściej reakcją pomiędzy kwasem a zasadą. Produktami tej reakcji są sól i woda. Roztwór wodny soli może mieć odczyn kwasowy, zasadowy lub obojętny – w zależności od mocy kwasu i zasady, jakie biorą udział w reakcji.
Po zmieszaniu (w ilościach stechiometrycznych) wodnego roztworu wodorotlenku sodu () i kwasu solnego (), które są mocnymi elektrolitamimocnymi elektrolitami, powstaje sól – chlorek sodu (), której roztwór wodny ma odczyn obojętny.:
Reakcję zobojętniania można także przedstawić jako reakcję tworzenia cząsteczek wody z jonów oksoniowych (), pochodzących z dysocjacji elektrolitycznejdysocjacji elektrolitycznej kwasu oraz jonów wodorotlenkowych (). Uwalniane są one do roztworu w wyniku dysocjacji elektrolitycznej .
ulega dysocjacji elektrolitycznej z wytworzeniem jonów oksoniowych:
ulega dysocjacji elektrolitycznej, uwalniając anion wodorotlenkowy:
Pełne równanie w postaci jonowej:
Anion wodorotlenkowy reaguje z jonem oksoniowym, tworząc dwie cząsteczki wody. Zatem równanie reakcji zobojętniania można przedstawić w postaci jonowej skróconej:
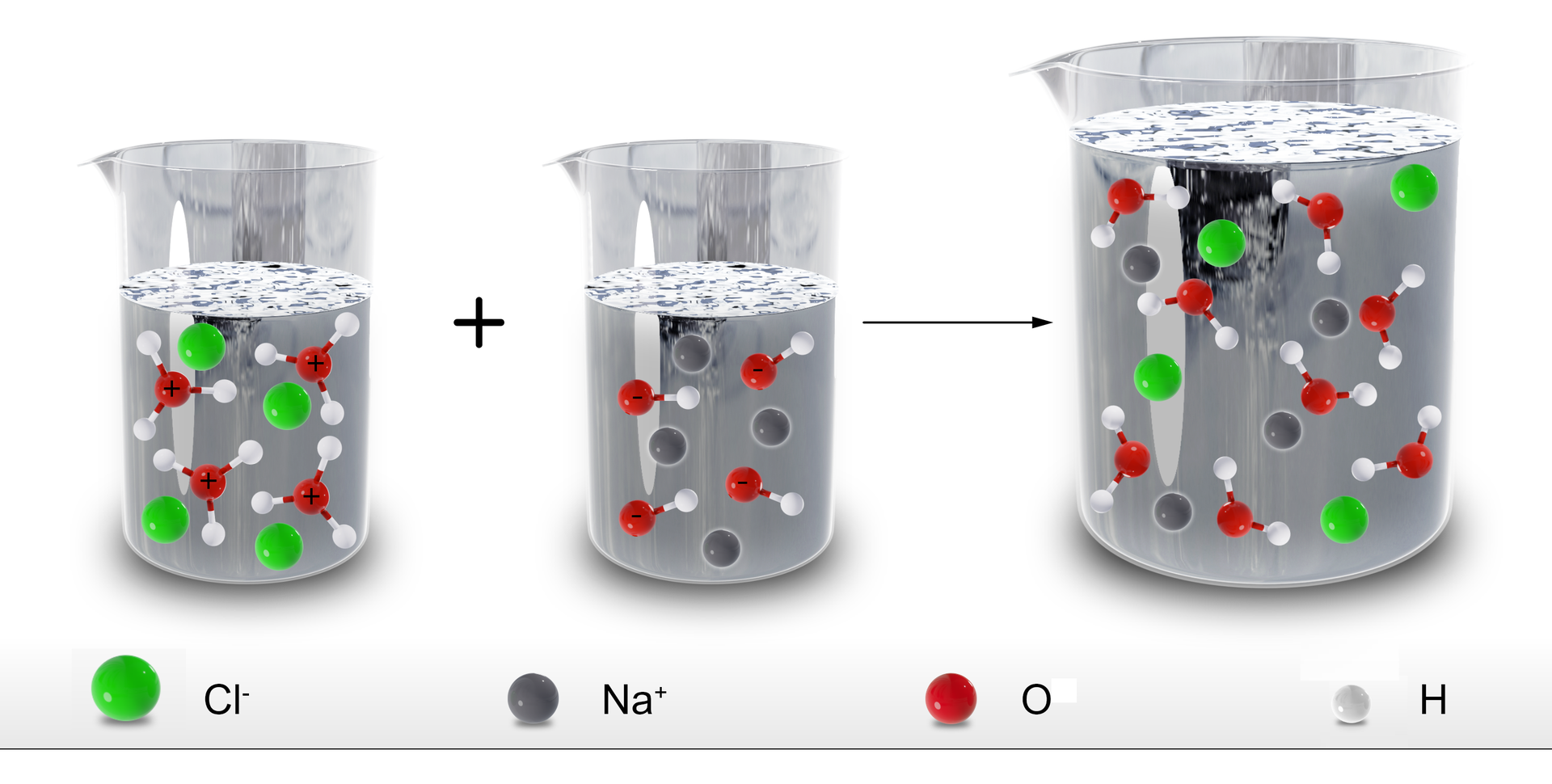
W jaki sposób zapisać i uzgodnić równanie reakcji zobojętniania?
Rozpatrzymy reakcje zachodzące pomiędzy różnymi parami kwas‑zasada.
Mocny kwas ‑ mocna zasada
Zapisz cząsteczkowe, jonowe pełne i jonowe skrócone równania reakcji kwasu azotowego(V) z wodnym roztworem wodorotlenku potasu.
W jaki sposób zapisać równanie reakcji zobojętniania, w której powstaje osad?
Soli trudno rozpuszczalnych w wodzie lub praktycznie nierozpuszczalnych nie rozpisujemy na jony nawet w zapisie jonowym. Przykład reakcji:
Mocny kwas - słaba zasada
Zapisz cząsteczkowe, jonowe pełne i jonowe skrócone równania reakcji kwasu siarkowego(VI) z wodorotlenkiem glinu.
Reakcja zobojętniania zachodzi, nawet jeśli jeden reagent nie znajduje się w fazie wodnej. Na przykład reakcja chemiczna pomiędzy kwasem chlorowodorowym a wodorotlenkiem żelaza(III) przebiega zgodnie z równaniem:
nawet jeśli jest związkiem nierozpuszczalnym w wodzie.

Słaby kwas‑mocna zasada
Zapisz cząsteczkowe, jonowe pełne i jonowe skrócone równania reakcji kwasu siarkowodorowego z wodorotlenkiem sodu.
Słaby kwas‑słaba zasada
Zapisz cząsteczkowe, jonowe, jonowe skrócone równanie reakcji kwasu ortofosforowego(V) z wodnym roztworem amoniaku.
Słabych kwasów i słabych zasad nie rozbijamy na jony w zapisie jonowym.
Słownik
reakcja chemiczna między kwasem a zasadą, która prowadzi do zmiany pH środowiska reakcji w kierunku odczynu bardziej obojętnego
(łac. dissociatio „rozdzielenie”) samorzutny proces rozpadu cząsteczek elektrolitów (kwasów, wodorotlenków, soli) w roztworach, na dodatnio i ujemnie naładowane cząstki, tj. jony pod wpływem działania rozpuszczalnika
(gr. ḗlektron „bursztyn”, lytós „rozpuszczalny”) elektrolit zdysocjowany praktycznie w 100%
wykładnik stężenia jonów oksoniowych (hydroniowych), ujemny logarytm dziesiętny ze stężenia jonów oksoniowych:
Bibliografia
Encyklopedia PWN
Kocjan R., Chemia analityczna. Podręcznik dla studentów, Warszawa 2002.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia: Liceum - poziom podstawowy i rozszerzony, Warszawa - Bielsko‑Biała 2010.
Lipiec T., Szmal Z., Chemia analityczna z elementami analizy instrumentalnej, Warszawa 1980.
Minczewski J., Marczenko Z., Chemia analityczna. T. 2. Chemiczne metody analizy ilościowej, Warszawa 2011, wyd. 10.
Young P. R., Acids‑Bases Reactions: Neutralization, Chicago, online: https://chem.libretexts.org/Bookshelves/Introductory_Chemistry/Book%3A_Introductory_Chemistry_Online_(Young)/08%3A_Acids%2C_Bases_and_pH/8.4%3A_Acids‑Bases_Reactions%3A_Neutralization, dostęp: 10.11.2021.