Przeczytaj
Czym jest kinetyka chemiczna?
Dział chemii fizycznej, który analizuje szybkość reakcjiszybkość reakcji chemicznych w odniesieniu do różnych warunków, takich jak ciśnienie, temperatura, stężenie oraz natura reagentów, to kinetyka chemicznakinetyka chemiczna. Dzięki niej, badacze są w stanie określić złożoność danej reakcji chemicznej i poznać jej mechanizmmechanizm. Najważniejszymi pojęciami w tym dziale są:
szybkość reakcji;
cząsteczkowość reakcjicząsteczkowość reakcji;
stała szybkościstała szybkości reakcji;
rząd reakcjirząd reakcji.
Czym jest rząd reakcji chemicznej?
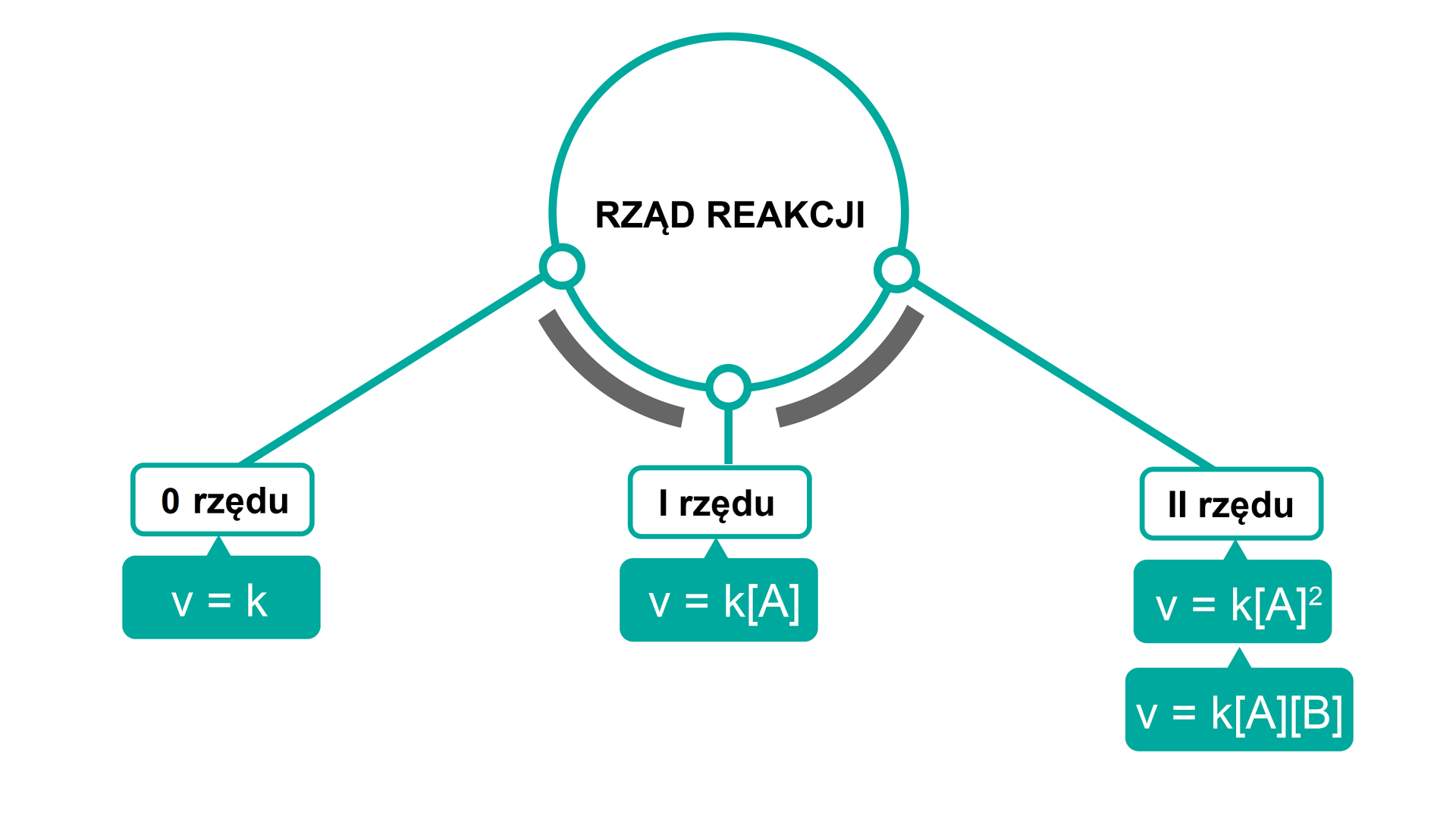
Zgodnie z definicją, rząd reakcji chemicznej jest sumą wykładników potęgowych, w których występują stężenia reagentów w równaniu kinetycznymrównaniu kinetycznym (na szybkość reakcji chemicznej). Równaniem kinetycznym nazywana jest zależność szybkości reakcji chemicznej od stężenia reagentów i temperatury. Dla reakcji syntezy jodowodoru, która to jest reakcją prostą i jednoetapową, przedstawioną równaniem reakcji:
równanie kinetyczne wygląda następująco:
gdzie:
– szybkość reakcji;
– stała szybkości reakcji;
, , ... – stężenia substratów biorących udział w reakcji.
Wykładniki potęg dla substratów odpowiadają w tym przypadku współczynnikom stechiometrycznym reakcji, dlatego równanie możemy zapisać następująco (dla współczynników równych 1 ich zapis nie jest konieczny):
Zapis ten wskazuje, że cząstkowy rząd reakcji względem wynosi 1, względem również wynosi 1, a całkowity rząd reakcji, będący sumą tych cząstkowych rzędów reakcji, wynosi 2 .
Powyższy przykład dotyczył prostej dwucząsteczkowej reakcji elementarnejreakcji elementarnej, zachodzącej w jednym etapie. Jednak w praktyce nieczęsto zdarzają się tak proste przykłady. Reakcje chemiczne mogą być proste lub złożone. Prosta reakcja to taka, która przebiega jednoetapowo od substratów do produktów. Taki rodzaj nazywany jest reakcją elementarną. Reakcje złożone dzielą się na następcze i równoległe. W reakcjach następczych, kolejne etapy zachodzą po kolei. Przykładem tego są procesy naturalnych szeregów promieniotwórczych. Reakcje równoległe polegają na jednoczesnym przebiegu kilku procesów, począwszy od tego samego substratu. Przykładem takiej reakcji jest nitrowanie fenolu.
Równania kinetyczne dla reakcji złożonych, składających się z kilku etapów, które ustala się doświadczalnie, często nie odzwierciedlają równania stechiometrycznego reakcjirównania stechiometrycznego reakcji. Wówczas rzędowość reakcji nie musi być wartością całkowitą, jak dla reakcji prostych. Rząd reakcji jest to wartość ustalana doświadczalnie – w danych warunkach reakcji może przyjmować wartości liczb całkowitych lub ułamkowych, a nawet być zerowa.
- - stężenie molowe substratu pozostałe po czasie ;
- - początkowe stężenie molowe substratu;
- - stała szybkości reakcji;
- - czas przebiegu reakcji.
- - stężenie molowe substratu pozostałe po czasie ;
- - początkowe stężenie molowe substratu;
- - stała szybkości reakcji;
- - czas przebiegu reakcji;
- - logarytm naturalny o podstawie e (liczba Eulera), gdzie e=2,718281828...
- - stężenie molowe substratu pozostałe po czasie t;
- - początkowe stężenie molowe substratu;
- - stała szybkości reakcji;
- - czas przebiegu reakcji.
Jakie są metody wyznaczania rzędu reakcji?
Znanych jest sześć metod wyznaczania rzędu reakcji chemicznej:
- – dla reakcji 0 rzędu;
- – dla reakcji I rzędu;
- – dla reakcji II rzędu;
- – dla reakcji III rzędu.
Metoda podstawienia do wzoru
Do wzorów na stałą szybkości reakcji k (dla różnych rzędów reakcji) podstawiane są dane doświadczalne C oraz t. Niezmienne (stałe) wartości k, obliczone z konkretnego wzoru, potwierdzają dany rząd reakcji.
Metoda graficzna
W tej metodzie rysuje się odpowiednie wykresy zależności liniowych (stężenia od czasu) dla reakcji o znanych rzędach:
- – dla reakcji 0 rzędu;
- – dla reakcji I rzędu;
- – dla reakcji II rzędu;
- – dla reakcji III rzędu.
Metoda różnicowa van’t Hoffa
Opiera się o zależność początkowej szybkości reakcji od stężenia początkowego substratu. Rząd reakcji wyznaczany jest ze wzoru:
Metoda izolacyjna Ostwalda
Metoda, w której wykorzystuje się szybkości początkowe, wyznaczane w kilku doświadczeniach tak, aby można było wyeliminować wpływ stężenia jednego substratu.
Metoda okresów półtrwania reakcji
Dla reakcji o różnej rzędowości zależność czasu połowicznej przemiany jest inna. Dla reakcji 0 rzędu czas ten jest wprost proporcjonalny do stężenia początkowego, dla reakcji I rzędu nie ma zależności, a dla reakcji II rzędu jest odwrotnie proporcjonalny. Metody te są często bardzo skomplikowane i wykorzystują bardzo złożony aparat matematyczny. Są jednak reakcje, dla których możemy nawet w szkolnym laboratorium wyznaczyć równanie kinetyczne – zastanów się wraz z nauczycielem, w jaki sposób doświadczalnie oraz jaką stosując metodę wyznaczyć równanie kinetyczne reakcji tiosiarczanu(VI) sodu z .
Metoda całkowa Ostwalda i Zawidzkiego
Na podstawie pomiarów oraz dla dwóch reakcji o różnych stężeniach początkowych 𝑖 , rząd reakcji wyliczamy ze wzoru:
Słownik
współczynnik proporcjonalności w równaniu kinetycznym, wyznaczany doświadczalnie, charakterystyczny dla danej reakcji chemicznej, zależny od temperatury i katalizatora; jednostkę stałej szybkości determinuje równanie kinetyczne w taki sposób, aby szybkość reakcji chemicznej wyrażona była w ; zależność jednostki stałej szybkości reakcji od rzędu reakcji przedstawia poniższy wzór (n - rząd reakcji):
opis dokładnego przebiegu reakcji chemicznej wskazujący na produkty pośrednie powstające w trakcie reakcji
zależność szybkości reakcji chemicznej od stężenia reagentów i temperatury
reakcja przebiegająca w jednym etapie od substratów do produktów
zmiana stężenia molowego substratów lub produktów w jednostce czasu
liczba cząsteczek biorąca udział w reakcji elementarnej
suma wykładników potęgowych w równaniu kinetycznym
dział chemii fizycznej analizujący szybkość reakcji chemicznych w różnych warunkach ciśnienia, temperatury, stężenia i natury reagentów
zapis przebiegu reakcji chemicznej, uwzględniający stechiometryczne ilości substratów i produktów reakcji (ilość odpowiednich pierwiastków po lewej stronie jest równa tej po prawej stronie)
Bibliografia
Bełtowska‑Brzezinska M., Podstawy kinetyki chemicznej. Skrypt do wykładów, Poznań 2009.
Bielański A., Podstawy chemii nieorganicznej, Warszawa 1994.
Encyklopedia PWN
Hejwowska S., Marcinkowski R., Chemia ogólna i nieorganiczna, Gdynia 2005.